1 . 按照如图所示的操作步骤,完成铝与盐酸反应的实验。

回答下列问题:
(1)实验过程中观察到的实验现象是__ 。
(2)写出铝与盐酸反应的离子方程式__ 。
(3)该反应是放热反应还是吸热反应__ 。

回答下列问题:
(1)实验过程中观察到的实验现象是
(2)写出铝与盐酸反应的离子方程式
(3)该反应是放热反应还是吸热反应
您最近一年使用:0次
2020-01-30更新
|
128次组卷
|
3卷引用:人教版高中化学必修2第二章《化学反应与能量》测试卷3
名校
解题方法
2 . 观察是研究物质性质的一种基本方法。某同学将一小块金属钠露置于空气中,观察到下列现象:银白色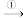 变暗
变暗 变白色
变白色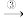 出现液滴
出现液滴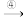 白色固体粉末。则下列说法正确的是( )
白色固体粉末。则下列说法正确的是( )
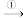 变暗
变暗 变白色
变白色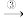 出现液滴
出现液滴 白色固体粉末。则下列说法正确的是( )
白色固体粉末。则下列说法正确的是( )| A.①发生反应生成了过氧化钠 |
| B.④只发生物理变化 |
| C.③是碳酸钠吸收空气中的水蒸气形成了溶液 |
| D.②变白色主要是因为生成了氢氧化钠 |
您最近一年使用:0次
2020-01-30更新
|
150次组卷
|
6卷引用:鲁教版高中化学必修1第一章《认识化学科学》测试卷2
解题方法
3 . 取一支大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,用铁架台固定好,放在光亮处一段时间,下列对观察到的现象的描述及说明正确的是( )
| A.试管中气体颜色变浅,是因为发生了加成反应 |
| B.试管中有少量白雾生成,这是氯化氢与水蒸气形成的盐酸小液滴 |
| C.试管内壁出现油状液体,这是甲烷与氯气的混合溶液 |
| D.试管内甲烷和氯气恰好完全反应,全部生成一氯甲烷小液滴 |
您最近一年使用:0次
解题方法
4 . 某同学设计实验验证非金属元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。他设计了如图所示装置以验证氮、碳、硅元素的非金属性强弱。

该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:A.___ B.____ C.___
(2)写出烧杯中发生反应的离子方程式:___ 。

该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:A.
(2)写出烧杯中发生反应的离子方程式:
您最近一年使用:0次
解题方法
5 . 某化学兴趣小组在学校科技节活动中表演了“滴水生火”、“吹气生火”的小魔术。如图所示,在蒸发皿上放一小团脱脂棉,在里面裹入一种淡黄色的化合物,对着脱脂棉吹气或者用胶头滴管滴几滴水,一会儿脱脂棉会燃烧起来。
(1)淡黄色的化合物为___ 。
(2)由“滴水生火”的小魔术可以得出Na2O2和H2O发生反应的依据:a.有氧气生成;b.__ 。该反应的化学方程式是___ 。
(3)“吹气生火”的过程中发生的化学反应方程式为__ ,用双线桥标出反应中电子转移的方向和数目:___ 。

(1)淡黄色的化合物为
(2)由“滴水生火”的小魔术可以得出Na2O2和H2O发生反应的依据:a.有氧气生成;b.
(3)“吹气生火”的过程中发生的化学反应方程式为
您最近一年使用:0次
解题方法
6 . 干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体。并将A、B、C按如图所示装置连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
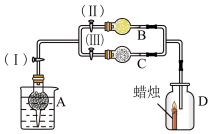
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是______________ 。
(2)在装置B中的淡黄色粉末是______________ 。
(3)在干燥管C中的白色固体应为________________ 。

试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是
(2)在装置B中的淡黄色粉末是
(3)在干燥管C中的白色固体应为
您最近一年使用:0次
2020-01-30更新
|
135次组卷
|
2卷引用:人教版高中化学必修1第三章《金属及其化合物》测试卷4
名校
解题方法
7 . 某研究性学习小组在做过氧化钠与水反应实验时,发现过氧化钠与水反应后的溶液中滴加酚酞溶液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去;
乙:因为所加水的量较少,红色褪去可能是生成的氢氧化钠溶液浓度较大的影响;
丙:过氧化钠具有强氧化性,生成物中氧气、过氧化氢(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质 。
(1)验证甲同学的推测是否正确的方法是____________________ ,验证乙同学的推测是否正确的方法是______________________ ;当出现____________ 现象时,即可说明丙同学的推测正确。
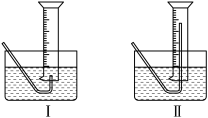
(2)有同学提出用定量的方法探究丙同学方案中是否含有过氧化氢,其实验方法为:称取2.6 g过氧化钠固体,使之与足量的水反应,测量产生氧气的体积,与理论值比较可得出结论。测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的_____________ ,理由是______________ 。
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去;
乙:因为所加水的量较少,红色褪去可能是生成的氢氧化钠溶液浓度较大的影响;
丙:过氧化钠具有强氧化性,生成物中氧气、过氧化氢(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质 。
(1)验证甲同学的推测是否正确的方法是
(2)有同学提出用定量的方法探究丙同学方案中是否含有过氧化氢,其实验方法为:称取2.6 g过氧化钠固体,使之与足量的水反应,测量产生氧气的体积,与理论值比较可得出结论。测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的

您最近一年使用:0次
2020-01-30更新
|
53次组卷
|
3卷引用:苏教版高中化学必修1专题2《从海水中获得的化学物质》测试卷
名校
解题方法
8 . 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
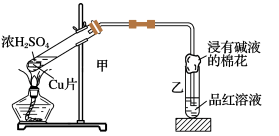
(1)判断铜与浓硫酸反应有二氧化硫生成所依据的现象是__________ 。
(2)甲装置中发生的主要反应的化学方程式是__________ 。
(3)装置乙中试管口放有一团浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花,请写出二氧化硫与氢氧化钠溶液反应的离子方程式:_______ 。
(4)该反应中若有3.2 g 铜参加反应,则被还原硫酸的物质的量为______ 。
(5)含有0.2 mol 硫酸的浓硫酸,在加热时能否溶解6.4 g铜,结论和理由是______ 。

(1)判断铜与浓硫酸反应有二氧化硫生成所依据的现象是
(2)甲装置中发生的主要反应的化学方程式是
(3)装置乙中试管口放有一团浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花,请写出二氧化硫与氢氧化钠溶液反应的离子方程式:
(4)该反应中若有3.2 g 铜参加反应,则被还原硫酸的物质的量为
(5)含有0.2 mol 硫酸的浓硫酸,在加热时能否溶解6.4 g铜,结论和理由是
您最近一年使用:0次
2020-01-29更新
|
266次组卷
|
6卷引用:人教版高一化学必修1第四章《非金属及其化合物》测试卷
人教版高一化学必修1第四章《非金属及其化合物》测试卷(已下线)3.2.2 硫酸 酸雨及其防治练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质练习(1)——《高中新教材同步备课》(苏教版 必修第一册)湖北省武汉市外国语学校2019-2020学年高一下学期期中考试化学试题河北省张家口市宣化第一中学2020-2021学年高一下学期期中考试化学试题陕西省西安市西航一中2021~2022学年高一上学期期末考试化学试题
解题方法
9 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
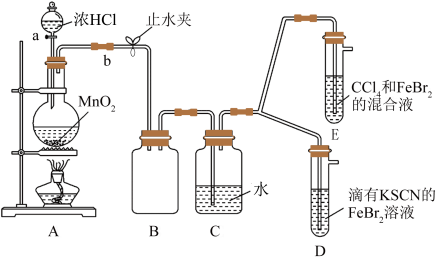
(1)①装置A中发生反应的离子方程式是______________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________ 。

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
Ⅰ.Fe3++3SCN- Fe(SCN)3是一个可逆反应。 Fe(SCN)3是一个可逆反应。Ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2  (SCN)2。 (SCN)2。Ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点 约5  C,它与水能发生水解反应,且该反应为非氧化还原反应。 C,它与水能发生水解反应,且该反应为非氧化还原反应。Ⅳ.AgClO、AgBrO均可溶于水。 |
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因
您最近一年使用:0次
10 . 某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)。
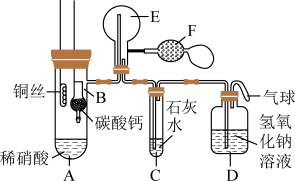
实验操作及现象为:
(1)操作Ⅰ中产生气体的离子反应方程式为__ ;
(2)操作Ⅰ的目的是__ ;
(3)C中白色沉淀的化学式是__ ,操作Ⅱ中当C产生白色沉淀时立刻将B上提的原因是__ ;
(4)操作Ⅲ中装置A产生无色气体的化学方程式是__ ;
(5)烧瓶E内气体颜色逐渐加深的原因是__ ;
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)__ ;
(7)D装置的作用是__ 。

实验操作及现象为:
| 操作 | 现象 |
| I,将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C处产生白色沉淀,立刻将B装置上提 | |
| III.将A中铜丝放入稀硝酸中,给装置A微加热 | 装置A中产生无色气体,装置E中开始时出现浅红棕色气体 |
| IV.用F向E中鼓入空气 | 烧瓶E内气体颜色逐渐加深 |
| V.一段时间后 | C中白色沉淀溶解 |
(2)操作Ⅰ的目的是
(3)C中白色沉淀的化学式是
(4)操作Ⅲ中装置A产生无色气体的化学方程式是
(5)烧瓶E内气体颜色逐渐加深的原因是
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)
(7)D装置的作用是
您最近一年使用:0次



