1 . 根据如图实验装置,请回答:___________ 。
(2)检查装置A气密性的方法是夹紧止水夹,___________ ,则气密性良好。
(3)用H2O2制取氧气,选择的发生装置为___________ (填字母),反应的化学方程式为___________ 。
(4)用装置F和另一仪器(除导管外)收集并测量O2体积,另一仪器名称为___________ ,在F中气体应从导管___________ (填“b”或“c”)端通入。
(5)实验室里,常用加热无水醋酸钠和碱石灰固体混合物的方法,制备甲烷。
①选择的发生装置为___________ (填字母)。用装置E收集甲烷,利用了甲烷___________ 的物理性质;用装置C而不用装置D收集甲烷,原因是___________ 。
②设计实验证明CH4中含有氢元素:检验其纯度后,___________ 。

(2)检查装置A气密性的方法是夹紧止水夹,
(3)用H2O2制取氧气,选择的发生装置为
(4)用装置F和另一仪器(除导管外)收集并测量O2体积,另一仪器名称为
(5)实验室里,常用加热无水醋酸钠和碱石灰固体混合物的方法,制备甲烷。
①选择的发生装置为
②设计实验证明CH4中含有氢元素:检验其纯度后,
您最近一年使用:0次
2 . 实验室模拟合成氨和氨催化氧化的流程如下:

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。

(1)从图中选择制取气体的合适装置:氮气___________ ,氢气___________
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有干燥氮气和氢气以及___________ 。

(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,但不会发生倒吸,原因是___________ 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是___________ 。
(5)写出乙装置中氨氧化的化学方程式___________ 。

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。

(1)从图中选择制取气体的合适装置:氮气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有干燥氮气和氢气以及

(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,但不会发生倒吸,原因是
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是
(5)写出乙装置中氨氧化的化学方程式
您最近一年使用:0次
3 . 氯是一种生产生活中常见的元素,下图是几种含氯产品。

(1) 是有毒气体,为了防止多余
是有毒气体,为了防止多余 污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理
污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理_______ 气体应该由_______ (填a或b)管通入。若要吸收标准状况下 ,至少需要
,至少需要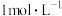 上述溶液
上述溶液_______ mL。
(2)工业上制取漂白粉的化学方程式是_______ 。
(3)同学们探究“84”消毒液在不同pH不使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用 溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
已知溶液中 、
、 和
和 的物质的量分数(a)随溶液pH变化的关系如图所示:
的物质的量分数(a)随溶液pH变化的关系如图所示:
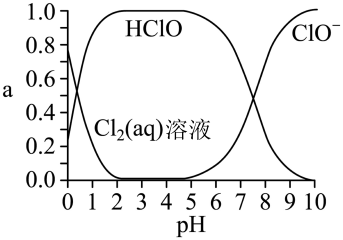
①由实验现象可获得结论:溶液的pH在4~10范围内,pH越大,红纸褪色_______ (填“越快”或“越慢”)。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_______ 。
③预测pH=1、10min后,红纸的颜色(与a、b、c颜色相比)_______ 。

(1)
 是有毒气体,为了防止多余
是有毒气体,为了防止多余 污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理
污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理 ,至少需要
,至少需要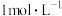 上述溶液
上述溶液
(2)工业上制取漂白粉的化学方程式是
(3)同学们探究“84”消毒液在不同pH不使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用
 溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
| 烧杯 | 溶液的pH | 现象 |
| a | 10 | 10min后,红纸基本不褪色;4h后红纸褪色 |
| b | 7 | 10min后,红纸颜色变浅;4h后红纸褪色 |
| c | 4 | 10min后,红纸颜色变得更浅;4h后红纸褪色 |
 、
、 和
和 的物质的量分数(a)随溶液pH变化的关系如图所示:
的物质的量分数(a)随溶液pH变化的关系如图所示:
①由实验现象可获得结论:溶液的pH在4~10范围内,pH越大,红纸褪色
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是
③预测pH=1、10min后,红纸的颜色(与a、b、c颜色相比)
您最近一年使用:0次
2022-11-05更新
|
188次组卷
|
2卷引用:福建省厦门双十中学2022-2023学年高一上学期期中考试化学试题
4 . 某同学用下图所示装置制取氯水并进行相关实验。
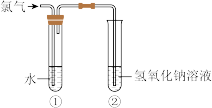
(1)装置②中反应的化学方程式是_______ 。
(2)实验进行一段时间后,装置①中溶液呈黄绿色,说明该溶液中含有的一种物质是(填化学式)_______ 。
(3)下列物质能替代装置②中NaOH溶液的是_______
A.浓硫酸 B.浓FeCl2溶液 C.饱和食盐水
(4)氯水中含有多种成分,因而具有多重性质。将氯水分别加入盛有如图四种物质溶液的试管中,根据发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
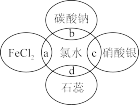
①d过程中溶液先变红后褪色,说明氯水具有的性质是_______ 、_______ 。
②c过程中的现象是_______ 。
③a过程中的化学方程式为_______ 。
④b过程中的离子方程式为_______ 。
(5)欲验证Cl2的氧化性强于I2,取少量氯水加入盛有_______ (填“KI”或“KIO3”)溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到的现象是_______ 。

(1)装置②中反应的化学方程式是
(2)实验进行一段时间后,装置①中溶液呈黄绿色,说明该溶液中含有的一种物质是(填化学式)
(3)下列物质能替代装置②中NaOH溶液的是
A.浓硫酸 B.浓FeCl2溶液 C.饱和食盐水
(4)氯水中含有多种成分,因而具有多重性质。将氯水分别加入盛有如图四种物质溶液的试管中,根据发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。

①d过程中溶液先变红后褪色,说明氯水具有的性质是
②c过程中的现象是
③a过程中的化学方程式为
④b过程中的离子方程式为
(5)欲验证Cl2的氧化性强于I2,取少量氯水加入盛有
您最近一年使用:0次
5 . 氯及其化合物既是重要化工原料,又是高效、广谱消毒剂。
(1)漂白粉是常见的消毒剂,写出工业制取漂白粉的化学方程式:____ 。
(2)实验室利用如图装置制备KClO和KClO3。
已知:6OH-+3Cl2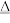 5Cl-+ClO
5Cl-+ClO +3H2O
+3H2O

①盛放浓盐酸的仪器名称是____ ,A中发生反应的离子方程式为____ 。
②B的作用是____ ;C中试管内盛放的试剂为____ 。
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2在标况下的体积为____ 。
(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为____ 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是____ 。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。取含次氯酸钠14.9g·L-1的84消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为___ mol·L-1。
(1)漂白粉是常见的消毒剂,写出工业制取漂白粉的化学方程式:
(2)实验室利用如图装置制备KClO和KClO3。
已知:6OH-+3Cl2
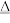 5Cl-+ClO
5Cl-+ClO +3H2O
+3H2O
①盛放浓盐酸的仪器名称是
②B的作用是
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2在标况下的体积为
(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。取含次氯酸钠14.9g·L-1的84消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次
6 . 研究物质的基本程序:观察物质的外观___________ 解释和结论。
您最近一年使用:0次
名校
解题方法
7 . 如表是某城市场上销售的一种“加碘盐”包装上的部分文字说明。
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种___ (填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是__ (填序号)。
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)___ (填“能”或“不能”)溶于水;化学性质:碘酸钾(KIO3)在受热时___ (填“易分解”或“不易分解”)。
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20~40mg·kg-1 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)
您最近一年使用:0次
2021-10-20更新
|
331次组卷
|
13卷引用:2015-2016学年福建省莆田二十五中高一上学期期中测试化学试卷
2015-2016学年福建省莆田二十五中高一上学期期中测试化学试卷(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2013-2014学年甘肃省嘉峪关市一中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷江苏省宿迁市泗阳县桃州中学2020-2021学年高一上学期第一次调研测试化学试题黑龙江省漠河市高级中学2020-2021学年高一上学期12月考化学试题吉林省辉南县第六中学2021-2022学年高一上学期第一次月考化学试题安徽省池州市第一中学2021-2022学年高一上学期10月月考化学试题山东省德州市临邑县第一中学2021-2022学年高一10月月考化学试题四川省雅安中学2021-2022学年高一上学期10月月考化学试题重庆市求精中学2021-2022学年高一上学期第二次月考化学试题
8 . 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)用碳酸锂和_______ 反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为___________________ 。
(2)不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是____________________________ 。
(3)硬脂酸锂是锂肥皂的主要成分,可作为高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法是_________________________ 。
(4)LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF5和__________ 。
(1)用碳酸锂和
(2)不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是
(3)硬脂酸锂是锂肥皂的主要成分,可作为高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法是
(4)LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF5和
您最近一年使用:0次
名校
9 . 为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

①上述3个装置中,不能证明”铜与浓硝酸反应是吸热反应还是放热反应”的是_____ (填“Ⅰ”“Ⅱ”或“Ⅲ”).
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是_________ ,说明该反应属于__________________ (填“吸热”或“放热”)反应.

①上述3个装置中,不能证明”铜与浓硝酸反应是吸热反应还是放热反应”的是
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是
您最近一年使用:0次
2017-06-23更新
|
65次组卷
|
2卷引用:福建省清流县第一中学2016-2017学年高二下学期第三阶段考试化学试卷
10 . 学生设计的用氨催化法制取少量HNO3溶液的实验装置如图所示:

(1)实验室制备NH3,下列方法中适宜选用的是_________ (填序号)。
①固态氯化铵与熟石灰混合加热 ②固态氯化铵加热分解
③碱石灰中滴加浓氨水 ④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为_________________________________________ ;
(3)装置C的作用是_________________________________________________________ ;
装置C中的现象是____________________________________________________________ ;为确保装置D中尽可能多地生成HNO3,所通入O2和NH3的体积比应大于___________ ;
(4)装置D中发生的反应化学方程式为___________________________________________ 。

(1)实验室制备NH3,下列方法中适宜选用的是
①固态氯化铵与熟石灰混合加热 ②固态氯化铵加热分解
③碱石灰中滴加浓氨水 ④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为
(3)装置C的作用是
装置C中的现象是
(4)装置D中发生的反应化学方程式为
您最近一年使用:0次
2016-05-23更新
|
405次组卷
|
2卷引用:2015-2016学年福建省龙海市程溪中学高一下学期期中化学试卷



