1 . 2021年在四川广汉三星堆新发现大量青铜器,如青铜面具、青铜神树等等。如图中的文物是三星堆出土的青铜面具之一,由于时间久远,表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、O2、CO2作用产生的,其化学式为Cu2(OH)2CO3,请用学过的方法对其展开探究。

(1)根据以上信息,可以获知的Cu2(OH)2CO3的物理性质有___________ 、___________ (选取其中两点)。
(2)从不同的物质分类标准的角度分析,“铜绿”不属于___________ 。
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐 F.碱
(3)从“铜绿”的组成、类别和性质的关联角度,预测它可能具有的化学性质,并用化学方程式加以表达(注:选写两个你认为可以实现的反应方程式,并且尽可能使得到的产物形态不同)
①___________ ,②___________ 。
(4)以“铜绿”为反应物可以实现以下物质转化:

反应④使用的是气体还原剂,且得到的产物之一,可以使澄清石灰水变浑浊。请写出反应④的化学方程式___________ 。

(1)根据以上信息,可以获知的Cu2(OH)2CO3的物理性质有
(2)从不同的物质分类标准的角度分析,“铜绿”不属于
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐 F.碱
(3)从“铜绿”的组成、类别和性质的关联角度,预测它可能具有的化学性质,并用化学方程式加以表达(注:选写两个你认为可以实现的反应方程式,并且尽可能使得到的产物形态不同)
①
(4)以“铜绿”为反应物可以实现以下物质转化:

反应④使用的是气体还原剂,且得到的产物之一,可以使澄清石灰水变浑浊。请写出反应④的化学方程式
您最近一年使用:0次
2023-11-02更新
|
336次组卷
|
3卷引用:卷一 物质及其变化 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末复习检测卷
名校
2 . 学习小组利用如下流程制备过氧化钠,并设计实验验证其相关性质。
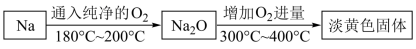
回答下列问题:
(1)金属钠被氧化失去金属光泽,颜色变为_______ 。
(2)流程中生成淡黄色固体的化学方程式为_______ 。
(3)小组同学取一定量淡黄色固体溶于冷水中,待固体全部反应后,仍可缓慢释放氧气。为探究固体溶解后溶液成分,设计如下实验方案进行验证:

①甲中产生较多气泡,证明固体溶解后溶液中有_______ (填化学式),写出甲中发生反应的化学方程式_______ 。
②向乙中滴入酚酞,溶液变红的原因是_______
(4)小组同学将金属钠加热至熔化后,误通入了干燥的CO2进行反应,将反应后固体产物溶于稀盐酸,产生气泡,观察到难溶于水的黑色固体。
①产物中与盐酸反应的物质可能为_______ (填化学式)。
②经检验,黑色固体为单质碳。写出CO2与Na反应的化学方程式_______ 。

回答下列问题:
(1)金属钠被氧化失去金属光泽,颜色变为
(2)流程中生成淡黄色固体的化学方程式为
(3)小组同学取一定量淡黄色固体溶于冷水中,待固体全部反应后,仍可缓慢释放氧气。为探究固体溶解后溶液成分,设计如下实验方案进行验证:

①甲中产生较多气泡,证明固体溶解后溶液中有
②向乙中滴入酚酞,溶液变红的原因是
(4)小组同学将金属钠加热至熔化后,误通入了干燥的CO2进行反应,将反应后固体产物溶于稀盐酸,产生气泡,观察到难溶于水的黑色固体。
①产物中与盐酸反应的物质可能为
②经检验,黑色固体为单质碳。写出CO2与Na反应的化学方程式
您最近一年使用:0次
3 . Ⅰ.如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
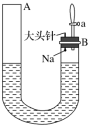
(1)钠与水反应的化学方程式为_______ ;
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_______ ;
②能证明钠的熔点低的现象是_______ ;
③能证明有气体产生的现象是A端液面_______ (填“上升”“下降”或“不变”,下同),B端液面_______ 。
Ⅱ.金属钠和氧气反应,条件不同,产物不同。
(3)钠和氧气在常温下反应的化学方程式_______ ;
(4)钠和氧气在加热条件下反应的化学方程式_______ 。
(5)将足量的过氧化钠加入到酚酞溶液中,则溶液的颜色会发生什么变化?_______ 。

(1)钠与水反应的化学方程式为
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是
②能证明钠的熔点低的现象是
③能证明有气体产生的现象是A端液面
Ⅱ.金属钠和氧气反应,条件不同,产物不同。
(3)钠和氧气在常温下反应的化学方程式
(4)钠和氧气在加热条件下反应的化学方程式
(5)将足量的过氧化钠加入到酚酞溶液中,则溶液的颜色会发生什么变化?
您最近一年使用:0次
4 . 1774年,舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取 的化学方程式为
的化学方程式为___________ 。
(2)实验室中用 溶液吸收尾气中的
溶液吸收尾气中的 的离子方程式为
的离子方程式为___________ ,配制 的
的 溶液
溶液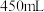 ,所需
,所需 固体的质量为
固体的质量为___________ 。
(3)用 可制备
可制备 溶液,将
溶液,将 溶液加入到滴有酚酞的
溶液加入到滴有酚酞的 溶液中,观察到溶液红色褪去。溶液褪色的原因可能是①
溶液中,观察到溶液红色褪去。溶液褪色的原因可能是① 被
被 中和,②
中和,②___________ 。设计实验探究溶液红色褪去的原因___________ 。
(4) 溶液不能长久存放的原因是
溶液不能长久存放的原因是___________ (用化学方程式表示),检验长久存放的 溶液中阴离子的实验操作及现象是
溶液中阴离子的实验操作及现象是___________ 。
 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取
 的化学方程式为
的化学方程式为(2)实验室中用
 溶液吸收尾气中的
溶液吸收尾气中的 的离子方程式为
的离子方程式为 的
的 溶液
溶液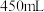 ,所需
,所需 固体的质量为
固体的质量为(3)用
 可制备
可制备 溶液,将
溶液,将 溶液加入到滴有酚酞的
溶液加入到滴有酚酞的 溶液中,观察到溶液红色褪去。溶液褪色的原因可能是①
溶液中,观察到溶液红色褪去。溶液褪色的原因可能是① 被
被 中和,②
中和,②(4)
 溶液不能长久存放的原因是
溶液不能长久存放的原因是 溶液中阴离子的实验操作及现象是
溶液中阴离子的实验操作及现象是
您最近一年使用:0次
2021-11-13更新
|
248次组卷
|
5卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
名校
解题方法
5 . 如表是某城市场上销售的一种“加碘盐”包装上的部分文字说明。
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种___ (填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是__ (填序号)。
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)___ (填“能”或“不能”)溶于水;化学性质:碘酸钾(KIO3)在受热时___ (填“易分解”或“不易分解”)。
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20~40mg·kg-1 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)
您最近一年使用:0次
2021-10-20更新
|
331次组卷
|
13卷引用:山东省德州市临邑县第一中学2021-2022学年高一10月月考化学试题
山东省德州市临邑县第一中学2021-2022学年高一10月月考化学试题(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2013-2014学年甘肃省嘉峪关市一中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷2015-2016学年福建省莆田二十五中高一上学期期中测试化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷江苏省宿迁市泗阳县桃州中学2020-2021学年高一上学期第一次调研测试化学试题黑龙江省漠河市高级中学2020-2021学年高一上学期12月考化学试题吉林省辉南县第六中学2021-2022学年高一上学期第一次月考化学试题安徽省池州市第一中学2021-2022学年高一上学期10月月考化学试题四川省雅安中学2021-2022学年高一上学期10月月考化学试题重庆市求精中学2021-2022学年高一上学期第二次月考化学试题
6 . 化学与人类生活、生产和社会可持续发展密切相关,请回答下列问题:
Ⅰ、(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式_______
(2)用1 L 1.0 mol·L-1的NaOH溶液吸收0.8 mol CO2,所得溶液Na2CO3中和NaHCO3物质的量浓度之比为_______
Ⅱ、如图为铁及其化合物的“价—类”二维图。
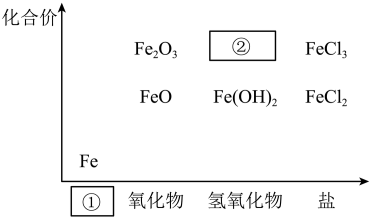
(1)①的类别是_______ ,②的化学式为_______
(2)向沸水中逐滴滴加饱和的FeCl3溶液,至液体呈红褐色,该分散系中分散质粒子的直径范围是_______
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出FeCl3溶液与铜箔发生反应的化学方程式_______ ,检验废腐蚀液中含有Fe3+的实验操作是_______
(4)某小组在探究Fe2+性质的实验中观察到异常现象(实验1),观察到溶液变红,片刻红色褪去,有气体生成(经检验为O2)。
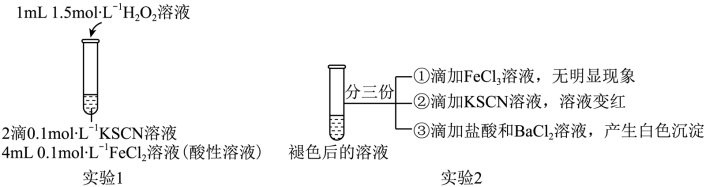
用实验2探究“红色褪去”的原因,则红色褪去的原因是_______ 。
Ⅰ、(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式
(2)用1 L 1.0 mol·L-1的NaOH溶液吸收0.8 mol CO2,所得溶液Na2CO3中和NaHCO3物质的量浓度之比为
Ⅱ、如图为铁及其化合物的“价—类”二维图。

(1)①的类别是
(2)向沸水中逐滴滴加饱和的FeCl3溶液,至液体呈红褐色,该分散系中分散质粒子的直径范围是
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出FeCl3溶液与铜箔发生反应的化学方程式
(4)某小组在探究Fe2+性质的实验中观察到异常现象(实验1),观察到溶液变红,片刻红色褪去,有气体生成(经检验为O2)。

用实验2探究“红色褪去”的原因,则红色褪去的原因是
您最近一年使用:0次
2021-01-28更新
|
318次组卷
|
2卷引用:山东省济宁市2020-2021学年高一上学期质量检测化学试题
名校
7 . 某同学利用如下图所示装置完成了浓硫酸和SO2的性质实验(夹持装置已省略)。请回答下列问题
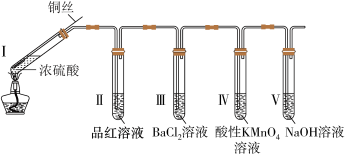
(1)将螺旋状的铜丝伸入浓硫酸中,发生反应的化学方程式为____________ 。
(2)实验中,试管Ⅱ中的品红溶液_____________ (填现象)。
(3)下列说法不正确的是_______ (填字母代号)
A.反应后,将试管I中的液体逐滴加入水中,溶液呈蓝色 B.试管Ⅲ中出现白色浑浊
C.试管Ⅳ中的酸性KMnO4溶液褪色 D.试管V中的NaOH溶液用于吸收尾气
(4)若反应中有0.02 mol H2SO4被还原,则反应产生的气体体积为______ mL(标准状况下)。

(1)将螺旋状的铜丝伸入浓硫酸中,发生反应的化学方程式为
(2)实验中,试管Ⅱ中的品红溶液
(3)下列说法不正确的是
A.反应后,将试管I中的液体逐滴加入水中,溶液呈蓝色 B.试管Ⅲ中出现白色浑浊
C.试管Ⅳ中的酸性KMnO4溶液褪色 D.试管V中的NaOH溶液用于吸收尾气
(4)若反应中有0.02 mol H2SO4被还原,则反应产生的气体体积为
您最近一年使用:0次
2019-08-02更新
|
433次组卷
|
5卷引用:山东济南章丘第四中学2021届高三上学期第一次阶段性检测化学试题
山东济南章丘第四中学2021届高三上学期第一次阶段性检测化学试题山东省济南市平阴县第一中学2021-2022学年高三10月月考化学试题湖南省长郡中学2018-2019学年高一下学期期末考试化学试题(已下线)考点15 常见非金属元素单质及其重要化合物3——硫-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)4.4.2 硫酸和硝酸的氧化性(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)
8 . 草酸亚铁晶体(化学组成为FeC2O4·2H2O)是一种淡黄色晶体粉末,是生产锂电池的原材料。已知FeC2O4·2H2O在300 ℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物。某学习小组欲验证草酸亚铁晶体的分解产物。
I.甲组同学设计了如下实验装置:
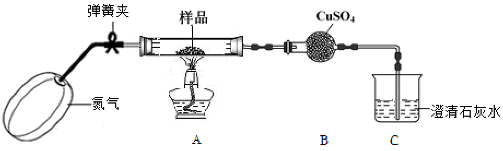
(1)实验开始前,鼓入氮气排出空气的目的是_____________________________ 。
(2)检验水和二氧化碳的装置分别是_______ 和_______ 。
(3)设计实验验证装置A中黑色残留物不含有Fe3O4_______________________________________________________________ (简要说明实验操作,现象和结论)。
II.乙组同学选用甲组实验中的装置A(接口用x表示)和下图所示的装置(可以重复选用)验证分解产物CO。

(4)乙组同学的实验装置中,依次连接的合理顺序为x→______ g→h→a(用接口字母和“→”表示)。装置G反应管中盛有的物质是氧化铜。能证明草酸晶体分解产物中有CO的现象是___________ 。
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是________________________ 。
I.甲组同学设计了如下实验装置:

(1)实验开始前,鼓入氮气排出空气的目的是
(2)检验水和二氧化碳的装置分别是
(3)设计实验验证装置A中黑色残留物不含有Fe3O4
II.乙组同学选用甲组实验中的装置A(接口用x表示)和下图所示的装置(可以重复选用)验证分解产物CO。

(4)乙组同学的实验装置中,依次连接的合理顺序为x→
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是
您最近一年使用:0次
9 . 实验室以Na2SO3粉末和70%H2SO4为原料制取SO2, 且以SO2为原料制取物质和进行性质探究。回答下列问题:
(1)学生甲欲收集一瓶干燥的SO2,选择图中的装置,其连接顺序为_________ (按气流方向,用小写字母表示); SO2有毒,为防止中毒实验应在_________ 中进行。

(2)学生乙欲通过量气法测定在空气中久置的亚硫酸钠粉末的纯度,最好选择下列装置 中 的_________ (填字母) 。

(3)学生丙欲以CuSO4·5H2O 和SO2 等为原料制备谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)实验装置如右图所示。已知谢弗勒尔盐是一种深红色固体,不溶于水和乙醇,100℃时发生分解。

回答下列问题:
装置A中SO2的作用是___________________ ; 体 系 温度 控 制 在 60~80℃ 的目的是___________ 。装置B的作用是_________ 。
(4)学生丁欲利用右图装置探究SO2使品红溶液褪色的实质。实验中观察到Ⅰ中红色褪去;Ⅱ中无现象。据此推断能使品红水溶液褪色的粒子可能是_________ 。如果要比较这些粒子使品红溶液褪色的快慢,请设计实验方案,简述操作和需要观察的现象________________ 。

(1)学生甲欲收集一瓶干燥的SO2,选择图中的装置,其连接顺序为

(2)学生乙欲通过量气法测定在空气中久置的亚硫酸钠粉末的纯度,最好选择下列装置 中 的

(3)学生丙欲以CuSO4·5H2O 和SO2 等为原料制备谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)实验装置如右图所示。已知谢弗勒尔盐是一种深红色固体,不溶于水和乙醇,100℃时发生分解。

回答下列问题:
装置A中SO2的作用是
(4)学生丁欲利用右图装置探究SO2使品红溶液褪色的实质。实验中观察到Ⅰ中红色褪去;Ⅱ中无现象。据此推断能使品红水溶液褪色的粒子可能是

您最近一年使用:0次
10 . 某小组同学欲探究NH3与O2反应的反应过程,按下列装置进行实验。

(1)A、B装置中可选药品:浓氨水、H2O2、CaO、CaCO3、MnO2、浓盐酸、蒸馏水。
①则A装置中发生反应的化学方程式为_____________________________ ;B装置中锥形瓶中盛放的药品是______ 。
②E装置中氨气被催化氧化生成一氧化氮时的化学方程式为_______________ 。
③F装置中可以看到有红棕色气体和白烟生成,红棕色气体是__________ (填化学式,下同),白烟的成分____________ 。
(2)另一小组的同学撤掉A、C装置,只用剩余装置来完成此实验,B装置中分液漏斗盛放的是浓氨水,那么B装置中的锥形瓶中盛放的固体药品是_____________ 。
(3)工业上制取的浓硝酸往往呈黄色,该小组成员设计实验探究硝酸呈黄色的原因,提出如下假设,请你完成假设二。
假设一:可能含有Fe3+;假设二:可能含有_____ ;假设三:可能含有上述两种微粒。检验是否含有Fe3+的方法是:取少量样品于试管中,加水稀释,__________________________ (补充操作步骤、现象和结论)。
(4)工业上用氨、氧气和水为原料制取硝酸铵,如果用17吨氨气,最多可制取_______ 吨硝酸铵 (硝酸铵的相对分子质量为80)。

(1)A、B装置中可选药品:浓氨水、H2O2、CaO、CaCO3、MnO2、浓盐酸、蒸馏水。
①则A装置中发生反应的化学方程式为
②E装置中氨气被催化氧化生成一氧化氮时的化学方程式为
③F装置中可以看到有红棕色气体和白烟生成,红棕色气体是
(2)另一小组的同学撤掉A、C装置,只用剩余装置来完成此实验,B装置中分液漏斗盛放的是浓氨水,那么B装置中的锥形瓶中盛放的固体药品是
(3)工业上制取的浓硝酸往往呈黄色,该小组成员设计实验探究硝酸呈黄色的原因,提出如下假设,请你完成假设二。
假设一:可能含有Fe3+;假设二:可能含有
(4)工业上用氨、氧气和水为原料制取硝酸铵,如果用17吨氨气,最多可制取
您最近一年使用:0次
2016-12-09更新
|
360次组卷
|
2卷引用:2014-2015山东省文登市高一上学期期末考试化学试卷



