名校
1 . 三草酸合铁酸钾晶体 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾 在一定条件下加热分解,对所得气体产物和固体产物进行探究。
在一定条件下加热分解,对所得气体产物和固体产物进行探究。
(1)三草酸合铁酸钾晶体 属于
属于___________ (填“混合物、酸、碱或盐”);已知该物质中铁的化合价为 ,则该物质中C的化合价为
,则该物质中C的化合价为___________ 。
Ⅰ.气体产物成分探究
(2)将气体产物依次通过(A)澄清石灰水(过量)、(B)浓硫酸、(C)灼热氧化铜、(D)澄清石灰水,观察到A、D中澄清石灰水均变浑浊,C中有红色固体生成,则气体产物的成分是___________ 。(填化学式)
Ⅱ.固体产物成分探究
(3)该小组同学查阅资料后推知,固体产物中铁元素以 和Fe存在,完成实验设计。
和Fe存在,完成实验设计。
实验前,先预测 的性质。用新制纯净的
的性质。用新制纯净的 粉末,完成以下实验设计表格:(已知铁元素的化合价有0、
粉末,完成以下实验设计表格:(已知铁元素的化合价有0、 、
、 ,稀溶液中
,稀溶液中 、
、 的颜色分别为浅绿色、黄色)
的颜色分别为浅绿色、黄色)
限选 试剂:炭粉、酸性 溶液、稀盐酸、
溶液、稀盐酸、 溶液、澄清石灰水。
溶液、澄清石灰水。
 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾 在一定条件下加热分解,对所得气体产物和固体产物进行探究。
在一定条件下加热分解,对所得气体产物和固体产物进行探究。(1)三草酸合铁酸钾晶体
 属于
属于 ,则该物质中C的化合价为
,则该物质中C的化合价为Ⅰ.气体产物成分探究
(2)将气体产物依次通过(A)澄清石灰水(过量)、(B)浓硫酸、(C)灼热氧化铜、(D)澄清石灰水,观察到A、D中澄清石灰水均变浑浊,C中有红色固体生成,则气体产物的成分是
Ⅱ.固体产物成分探究
(3)该小组同学查阅资料后推知,固体产物中铁元素以
 和Fe存在,完成实验设计。
和Fe存在,完成实验设计。实验前,先预测
 的性质。用新制纯净的
的性质。用新制纯净的 粉末,完成以下实验设计表格:(已知铁元素的化合价有0、
粉末,完成以下实验设计表格:(已知铁元素的化合价有0、 、
、 ,稀溶液中
,稀溶液中 、
、 的颜色分别为浅绿色、黄色)
的颜色分别为浅绿色、黄色) 溶液、稀盐酸、
溶液、稀盐酸、 溶液、澄清石灰水。
溶液、澄清石灰水。预测的 性质 性质 | 预测的依据 | 预期现象 |
| 能与 | 从组成看, 属于碱性氧化物 属于碱性氧化物 | 固体溶解,溶液为浅绿色 |
| 能与 | ||
| 能与炭粉反应 |
您最近一年使用:0次
名校
解题方法
2 . 氯酸钾为无色或白色晶体,是一种强氧化剂。某化学小组制取氯酸钾并进行有关探究实验。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:
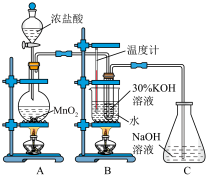
(1)装置A中盛装浓盐酸的仪器名称是___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
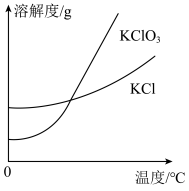
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为___________ (填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、___________ 、洗涤、干燥。
II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
①3号试管实验中x的值为___________ ;1号试管实验的作用是___________ 。
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为___________ 。
③由该系列实验可得出的结论是___________ 。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:

(1)装置A中盛装浓盐酸的仪器名称是
(2)装置A中发生反应的离子方程式为
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为

II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol·L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol·L-1H2SO4/mL | 0 | 3.0 | x | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 5.0 | 0 |
| 取少量反应后溶液滴加淀粉溶液 | 无现象 | 变蓝 | 变蓝 | 无现象 |
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为
③由该系列实验可得出的结论是
您最近一年使用:0次
2023-11-13更新
|
431次组卷
|
2卷引用:广东省汕头市潮阳实验学校2024届高三上学期期中考试化学试题
名校
3 . 双氧水和84消毒液是生活中常用的两种消毒剂,某同学设计如下实验研究 的性质。
的性质。
(1)①已知淀粉遇碘会变蓝,能证明 具有还原性的实验是
具有还原性的实验是_______ (填序号)。
②试写出实验i中反应的离子方程式_______ 。
③依据表格信息,将 、
、 、
、 按氧化性由强到弱依次排序:
按氧化性由强到弱依次排序:_______ 。(写化学式)
(2)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO_______  (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1:1时,该反应的还原产物为
的个数比为1:1时,该反应的还原产物为_______ (填字母序号)。
A. B.
B. C.
C. D.NaCl E.
D.NaCl E.
(3)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,Al被氧化为
,Al被氧化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。上述反应中,被氧化的物质是_______ (写化学式),还原产物是_______ (写化学式)。
 的性质。
的性质。| 序号 | 实验 | 实验现象 |
| i | 向5%  溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5%  溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 具有还原性的实验是
具有还原性的实验是②试写出实验i中反应的离子方程式
③依据表格信息,将
 、
、 、
、 按氧化性由强到弱依次排序:
按氧化性由强到弱依次排序:(2)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1:1时,该反应的还原产物为
的个数比为1:1时,该反应的还原产物为A.
 B.
B. C.
C. D.NaCl E.
D.NaCl E.
(3)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,Al被氧化为
,Al被氧化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
您最近一年使用:0次
2023-10-10更新
|
247次组卷
|
2卷引用:广东省广州市真光中学2023-2024学年高一上学期期中考试化学试题
解题方法
4 . 某兴趣小组在实验室模拟海带提取碘的实验,并探究氧化剂及其作用原理。
Ⅰ.模拟海带提碘实验
该小组同学按如下实验流程进行实验:

(1)“步骤①”中发生反应生成碘单质,其离子方程式为_______ 。
(2)“步骤②”的操作名称是_______ 、_______ 。
Ⅱ.探究可用于海带提碘的氧化剂
ⅰ.实验准备
(3)配制 溶液
溶液
①需要称量 固体的质量是
固体的质量是_______  (保留2位小数)。
(保留2位小数)。
②在实验室配制上述溶液的过程中,需使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______ (填仪器名称)。
ⅱ.选用 作氧化剂
作氧化剂
(4)向试管中加入 溶液,再加入
溶液,再加入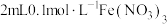 溶液(
溶液(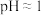 ),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
假设1: 作氧化剂;
作氧化剂;
假设2:酸性条件下 作氧化剂;
作氧化剂;
假设3: 和酸性条件下的
和酸性条件下的 都作氧化剂。
都作氧化剂。
限选试剂: 溶液、
溶液、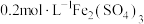 溶液、
溶液、 溶液、
溶液、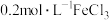 溶液
溶液
ⅲ.选用 作氧化剂
作氧化剂
(5)向试管中加入 溶液,再加入
溶液,再加入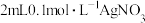 溶液
溶液 ,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为
,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为_______ (填化学式);静置后取上层清液,向其中滴加2滴淀粉溶液,溶液未变篮,说明 未氧化
未氧化 。
。
(6)资料显示,同浓度的 的氧化能力强于
的氧化能力强于 的。为进一步探究
的。为进一步探究 能否氧化
能否氧化 ,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。

①上述装置的盐桥中应选择_______ 作为电解质(填标号)。
A. B.
B. C.
C. D.
D.
②与(5)中实验相比,(6)中装置能够实现 氧化
氧化 的原因是
的原因是_______ 。
Ⅰ.模拟海带提碘实验
该小组同学按如下实验流程进行实验:

(1)“步骤①”中发生反应生成碘单质,其离子方程式为
(2)“步骤②”的操作名称是
Ⅱ.探究可用于海带提碘的氧化剂
ⅰ.实验准备
(3)配制
 溶液
溶液①需要称量
 固体的质量是
固体的质量是 (保留2位小数)。
(保留2位小数)。②在实验室配制上述溶液的过程中,需使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、
ⅱ.选用
 作氧化剂
作氧化剂(4)向试管中加入
 溶液,再加入
溶液,再加入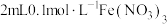 溶液(
溶液(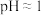 ),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。假设1:
 作氧化剂;
作氧化剂;假设2:酸性条件下
 作氧化剂;
作氧化剂;假设3:
 和酸性条件下的
和酸性条件下的 都作氧化剂。
都作氧化剂。限选试剂:
 溶液、
溶液、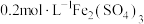 溶液、
溶液、 溶液、
溶液、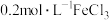 溶液
溶液| 实验操作 | 实验现象 | 实验结论 |
向试管中加入 溶液,再加入 溶液,再加入 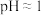 ),充分混合,再滴加2滴淀粉溶液 ),充分混合,再滴加2滴淀粉溶液 | 溶海变蓝 | 假设3成立 |
向试管中加入 溶液,再加入 溶液,再加入 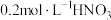 溶液和 溶液和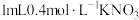 溶液,充分反应后,再滴加2滴淀粉溶液 溶液,充分反应后,再滴加2滴淀粉溶液 |
ⅲ.选用
 作氧化剂
作氧化剂(5)向试管中加入
 溶液,再加入
溶液,再加入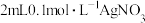 溶液
溶液 ,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为
,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为 未氧化
未氧化 。
。(6)资料显示,同浓度的
 的氧化能力强于
的氧化能力强于 的。为进一步探究
的。为进一步探究 能否氧化
能否氧化 ,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
①上述装置的盐桥中应选择
A.
 B.
B. C.
C. D.
D.
②与(5)中实验相比,(6)中装置能够实现
 氧化
氧化 的原因是
的原因是
您最近一年使用:0次
5 . 为证明AgCl溶于水存在溶解平衡,取1 mo/LKCl溶液10 mL,向其中加入0.2 mol/LAgNO3溶液1 mL,充分反应后将浊液过滤进行如下实验:
已知:①AgOH不稳定,立即分解为Ag2O (棕褐色或棕黑色),Ag粉为黑色;
②AgCl、Ag2O可溶于浓氨水生成 [Ag(NH3)2]+(银氨溶液),Mg、Ag不溶于浓氨水。
(1)实验A中的滤液所属分散系为___________ 。现象ii中无色气泡是___________ (填化学式)。
(2)现象iii中,导致产生气泡的速率下降的主要原因是___________ 。
(3)判断Mg条表面的棕褐色物质中含有Ag和Ag2O。
①设计实验检验Ag:取实验A中表面变为棕褐色的Mg条于试管中,向其中加入足量稀盐酸,反应结束后,继续加入浓硝酸,产生棕色气体和白色不溶物。用离子方程式表示棕褐色固体中产生Ag的原因:___________ 。实验中加入稀盐酸的目的:___________ 。
②设计检验棕褐色物质中有Ag2O,实验方案是:取实验A中表面变为棕褐色的Mg条用蒸馏水洗净后,加入___________ (填化学式)中浸泡,取上层清液于葡萄糖溶液中,水浴加热,若有___________ (填实验现象),则证明Ag2O存在。
(4)探究AgI转化为AgCl,设计实验如下:
已知:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①电压表读数a>b,其原因是___________ 。
②综合实验现象能说明AgI转化为AgCl,则a、b、c三者的大小关系为___________ 。
| 序号 | 实验装置 | 实验操作 | 实验现象 |
| A |  | 向滤液中放入Mg条 | ⅰ.滤液澄清透明,用激光照射有丁达尔现象。 ⅱ.放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊,ⅲ.一段时间后开始出现棕褐色浑浊物。Mg条表面也逐渐变为棕褐色。产生气泡的速率变缓慢 |
已知:①AgOH不稳定,立即分解为Ag2O (棕褐色或棕黑色),Ag粉为黑色;
②AgCl、Ag2O可溶于浓氨水生成 [Ag(NH3)2]+(银氨溶液),Mg、Ag不溶于浓氨水。
(1)实验A中的滤液所属分散系为
(2)现象iii中,导致产生气泡的速率下降的主要原因是
(3)判断Mg条表面的棕褐色物质中含有Ag和Ag2O。
①设计实验检验Ag:取实验A中表面变为棕褐色的Mg条于试管中,向其中加入足量稀盐酸,反应结束后,继续加入浓硝酸,产生棕色气体和白色不溶物。用离子方程式表示棕褐色固体中产生Ag的原因:
②设计检验棕褐色物质中有Ag2O,实验方案是:取实验A中表面变为棕褐色的Mg条用蒸馏水洗净后,加入
(4)探究AgI转化为AgCl,设计实验如下:
| 装置 | 步骤 | 电压表读数 |
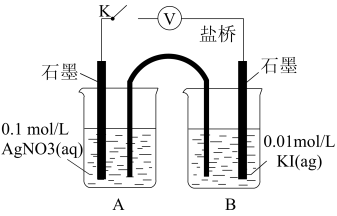 | ⅰ.如图连接装置并加入试剂,闭合K | a |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复ⅰ,再向B中加入与iii等量NaCl(s) | d |
已知:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①电压表读数a>b,其原因是
②综合实验现象能说明AgI转化为AgCl,则a、b、c三者的大小关系为
您最近一年使用:0次
解题方法
6 . 某化学活动小组进行如下探究:
查阅资料:影响气体扩散速率的因素有气体的分压、相对分子质量、温度、距离有关。
回答下列问题:
(1)NH4Cl的电子式为___ ,写出NH4Cl的一种用途是__ 。
(2)关于实验Ⅰ,下列叙述正确的是___ (填代号)。
A.试纸变蓝,说明NH4Cl发生了分解反应
B.若用消石灰和NH4Cl混合加热,湿润的pH试纸变蓝
C.实验Ⅰ说明不宜用加热NH4Cl的方法制备NH3
D.用(NH4)2SO4代替NH4Cl,实验现象相同
E.除去NaCl固体中少量NH4Cl可用直接加热方法
F.白色固体是NH4Cl,说明NH4Cl的分解反应是可逆反应
(3)设计实验Ⅱ的目的是___ 。
(4)从实验Ⅰ与Ⅱ可推断影响气体扩散速率的规律:在相同条件下,__ 。
(5)实验Ⅲ的目的是验证上述气体扩散速率的规律,写出直玻管内发生反应的化学方程式为___ ,甲中气体的化学式为___ 。
| 编号 | 实验步骤 | 实验现象 |
| Ⅰ | 将NH4Cl固体加入试管中,并将湿润的pH试纸置于试管口,试管口略向下倾斜,对试管底部进行加热 | 试纸颜色变化:黄色→蓝色(pH≈10)→黄色→红色(pH≈2);试管中部有白色固体附着 |
| Ⅱ | 将饱和NH4Cl溶液滴在pH试纸上 | 试纸颜色变化:黄色→橙色(pH≈5) |
| Ⅲ | 在常温同压下,用甲和乙两个注射器分别将体积均为10mL的两种气体,同时注入到真空的直玻管两端 | 一段时间后,直玻管内壁中间靠右的位置,附着一段环状的淡黄色粉末;如图所示 |
回答下列问题:
(1)NH4Cl的电子式为
(2)关于实验Ⅰ,下列叙述正确的是
A.试纸变蓝,说明NH4Cl发生了分解反应
B.若用消石灰和NH4Cl混合加热,湿润的pH试纸变蓝
C.实验Ⅰ说明不宜用加热NH4Cl的方法制备NH3
D.用(NH4)2SO4代替NH4Cl,实验现象相同
E.除去NaCl固体中少量NH4Cl可用直接加热方法
F.白色固体是NH4Cl,说明NH4Cl的分解反应是可逆反应
(3)设计实验Ⅱ的目的是
(4)从实验Ⅰ与Ⅱ可推断影响气体扩散速率的规律:在相同条件下,
(5)实验Ⅲ的目的是验证上述气体扩散速率的规律,写出直玻管内发生反应的化学方程式为
您最近一年使用:0次
名校
7 . 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”,根据图示回答下列问题:

(1)根据“价类二维图”,下列能与B反应的物质有_____ ,反应中使B表现还原性的物质是__ (填序号)。
①NaOH溶液 ②CaCl2溶液 ③酸性KMnO4溶液 ④H2S溶液
(2)C的钠盐放置在空气中极易变质,请设计实验方案证明其已被氧化___ 。
(3)请写出金属铜与D的浓溶液在一定条件下发生反应的化学方程式______ 。

(1)根据“价类二维图”,下列能与B反应的物质有
①NaOH溶液 ②CaCl2溶液 ③酸性KMnO4溶液 ④H2S溶液
(2)C的钠盐放置在空气中极易变质,请设计实验方案证明其已被氧化
(3)请写出金属铜与D的浓溶液在一定条件下发生反应的化学方程式
您最近一年使用:0次
2020-03-13更新
|
324次组卷
|
2卷引用:广东省揭阳市揭西县河婆中学2020-2021学年高一下学期第一次月考化学试题
8 . 某化学小组用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
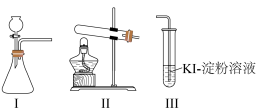
供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
(2)丙实验中O2与KI溶液反应的离子方程式为___________________________________ 。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________ 。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________________________ 。
(4)由甲、乙、丙三组实验推测,甲实验中可能是I中的白雾使溶液变蓝。为了验证推测,可将装置I中产生的气体通入_________ (填字母)溶液中,依据实验现象来证明白雾中含有H2O2。
A.酸性KMnO4B.FeCl2C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应___________________________________ (写离子方程式)造成的,请设计实验证明他们的猜想是否正确:___________________________________ 。

供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
| 操作 | 现象 | |
| 甲 | 向装置I的锥形瓶中加入MnO2固体,向装置I的 | 装置I中产生无色气体并伴随大量白雾;装置Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向装置Ⅱ中加入KMnO4固体,连接装置Ⅱ、Ⅲ,点燃酒精灯 | 装置Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向装置Ⅱ中加入 | 装置Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式为
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是
(4)由甲、乙、丙三组实验推测,甲实验中可能是I中的白雾使溶液变蓝。为了验证推测,可将装置I中产生的气体通入
A.酸性KMnO4B.FeCl2C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应
您最近一年使用:0次
2019-12-25更新
|
548次组卷
|
2卷引用:2021年广东省高考化学试卷变式题11-21
9 . 如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
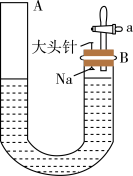
(1)钠与水反应的化学方程式为_____________ 。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_________ 。
②能证明钠的熔点低的现象是_________ 。
③能证明有氢氧化钠生成的现象是__________ 。
④能证明有气体产生的现象是A端液面________ (填“上升”“下降”或“不变”,下同),B端液面________ 。

(1)钠与水反应的化学方程式为
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是
②能证明钠的熔点低的现象是
③能证明有氢氧化钠生成的现象是
④能证明有气体产生的现象是A端液面
您最近一年使用:0次
2019-08-31更新
|
1844次组卷
|
15卷引用:广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题第二课时 研究物质性质的基本方法 练习内蒙古集宁一中(西校区)2019-2020学年高一上学期期末考试化学试题甘肃省古浪县第二中学2019-2020学年高一12月基础知识竞赛化学试题(已下线)1.2.1 研究物质性质的基本方法 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)3.2.1 钠的性质与制备练习(1)——《高中新教材同步备课》(苏教版 必修第一册)陕西省西安市第八十五中学2019-2020学年高一上学期期末考试化学试题安徽省肥东县高级中学2020-2021学年高一上学期第二次月考化学试题湖北省黄冈市2020-2021学年高一上学期期中联考化学试题甘肃省武威市民勤县第四中学2020-2021学年高一上学期期末考试(普通班)化学试题四川省自贡市田家炳中学2020-2021学年高一下学期开学考试化学试题安徽省亳州市第五完全中学2021-2022学年高一上学期期中考试化学试题甘肃省庄浪县阳川中学2021-2022学年高三上学期第二次月考化学试题重庆市万州纯阳中学校2021-2022学年高一10月月考化学(B卷)试题湖北省武汉海淀外国语实验学校2022-2023学年高一上学期10月月考化学试题
名校
10 . 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
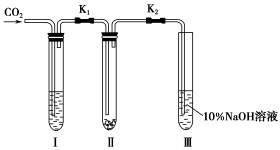
实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2。在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管Ⅰ内装入试剂Y,其他操作同实验甲。观察到木条复燃,且Ⅱ中的淡黄色变为白色。
试回答下列问题:
(1)Na2O2与水反应的离子方程式____________________________________ 。
(2)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是____________________ 。
(3)在实验甲中,试剂X是____________ ;在实验乙中,试剂Y是____________ (填化学式)。
(4)根据上述两个实验现象,得到的结论是____________________________________ 。
(5)试管Ⅲ中的NaOH溶液的作用是___________________________________ 。
(6)为了确保实验的准确性,制备CO2所用的反应物最好选用_______ (填编号)。
A.大理石 B.小苏打 C.盐酸 D.稀硫酸

实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2。在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管Ⅰ内装入试剂Y,其他操作同实验甲。观察到木条复燃,且Ⅱ中的淡黄色变为白色。
试回答下列问题:
(1)Na2O2与水反应的离子方程式
(2)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是
(3)在实验甲中,试剂X是
(4)根据上述两个实验现象,得到的结论是
(5)试管Ⅲ中的NaOH溶液的作用是
(6)为了确保实验的准确性,制备CO2所用的反应物最好选用
A.大理石 B.小苏打 C.盐酸 D.稀硫酸
您最近一年使用:0次
2019-01-15更新
|
478次组卷
|
2卷引用:2021年广东省高考化学试卷变式题11-21



