1 . 由下列实验操作得出的实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将充满 的试管倒置在水槽中 的试管倒置在水槽中 | 液面上升 | 证明 与 与 反应生成了 反应生成了 |
B | 将等质量的两块绿豆粒大小的钠和钾分别投入盛有足量水的烧杯中 | 钾与水反应更剧烈且产生的气体更多 | 钾比钠活泼 |
C | 向 溶液中通入足量 溶液中通入足量 气体 气体 | 溶液中产生白色沉淀 | 生成的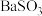 难溶于水 难溶于水 |
D | 镀锌钢板破损后,在空气中放置一段时间 | 钢板没有生锈 | 金属性:Zn>Fe |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 氨气催化氧化是高中化学教学中的一个重要实验,对于氨气性质和硝酸工业生产过程的教学有着非常重要的作用。某化学兴趣小组设计如下实验装置(部分装置省略)探究氨气的催化氧化。
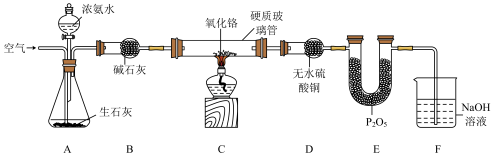
已知:氧化铬(Cr2O3)为催化剂;P2O5为酸性氧化物。
回答下列问题:
(1)在组装好装置,装入药品前,需要进行的操作是_______ ;氨气的电子式为_______ 。
(2)一段时间后无水硫酸铜变蓝,此时硬质玻璃管内氨气与氧气发生反应生成两种氧化物的化学方程式为_______ ,熄灭酒精灯,继续通入空气,此时可看到Cr2O3会持续红热,说明该反应为_______ (填“吸”或“放”)热反应。
(3)无水硫酸铜变蓝一段时间后,硬质玻璃管内会有红棕色气体产生。E装置的作用是_______ ;F装置用于吸收红棕色气体,吸收过程中生成等物质的量的两种可溶性盐,该反应的离子方程式为_______ ;若缺少F装置,排放的尾气可能造成的环境危害为_______ (填一种)。
(4)实验室也可以利用氯化铵和消石灰为原料制备氨气,该反应的化学方程式为_______ ,可以用_______ (填标号)检验有氨气生成。
a.无色酚酞溶液 b.湿润的蓝色石蕊试纸 c.浓盐酸 d.浓硫酸

已知:氧化铬(Cr2O3)为催化剂;P2O5为酸性氧化物。
回答下列问题:
(1)在组装好装置,装入药品前,需要进行的操作是
(2)一段时间后无水硫酸铜变蓝,此时硬质玻璃管内氨气与氧气发生反应生成两种氧化物的化学方程式为
(3)无水硫酸铜变蓝一段时间后,硬质玻璃管内会有红棕色气体产生。E装置的作用是
(4)实验室也可以利用氯化铵和消石灰为原料制备氨气,该反应的化学方程式为
a.无色酚酞溶液 b.湿润的蓝色石蕊试纸 c.浓盐酸 d.浓硫酸
您最近一年使用:0次
2023-08-31更新
|
244次组卷
|
2卷引用:河南省创新发展联盟2023-2024学年高二上学期开学考试化学试题
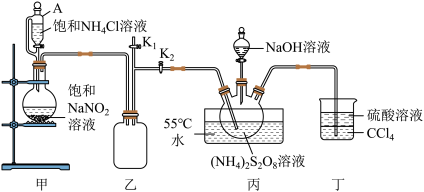
3 . 过硫酸钠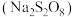 常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。
(一)制备
已知:①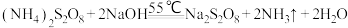 ;
;
② ;
;
③ 是白色晶状粉末,易溶于水,加热至
是白色晶状粉末,易溶于水,加热至 就会发生分解。
就会发生分解。
回答下列问题:
(1)装置丁的作用是_______ 。
(2)实验时需要将装置甲中反应产生的 持续通入装置丙中,目的是
持续通入装置丙中,目的是_______ 。
(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是_______ 。
(二)探究 的氧化性
的氧化性
(4)用 溶液与
溶液与 溶液反应,实验操作与现象如下表所示:
溶液反应,实验操作与现象如下表所示:
实验Ⅱ中 起催化作用,总反应分两步进行:
起催化作用,总反应分两步进行:
a. ;
;
b._______。
请你补充反应
_______ 。设计实验证明实验Ⅱ反应后的溶液中含有
_______ 。
(5)已知:酸性过硫酸钠溶液,在 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。在
溶液可以产生白色沉淀。在 催化作用下,用酸性
催化作用下,用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为_______ ,该反应的离子方程式为_______ 。
 常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。(一)制备


已知:①
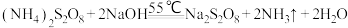 ;
;②
 ;
;③
 是白色晶状粉末,易溶于水,加热至
是白色晶状粉末,易溶于水,加热至 就会发生分解。
就会发生分解。回答下列问题:
(1)装置丁的作用是
(2)实验时需要将装置甲中反应产生的
 持续通入装置丙中,目的是
持续通入装置丙中,目的是(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是
(二)探究
 的氧化性
的氧化性(4)用
 溶液与
溶液与 溶液反应,实验操作与现象如下表所示:
溶液反应,实验操作与现象如下表所示:| 实验 | 操作 | 现象 |
| Ⅰ | 在 含淀粉的 含淀粉的 溶液中滴加 溶液中滴加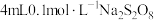 溶液 溶液 | 一段时间后,溶液缓慢变蓝色 |
| Ⅱ | 在 含淀粉的 含淀粉的 溶液中先滴几滴 溶液中先滴几滴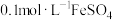 溶液,再滴加 溶液,再滴加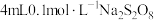 溶液 溶液 | 溶液迅速变蓝色 |
 起催化作用,总反应分两步进行:
起催化作用,总反应分两步进行:a.
 ;
;b._______。
请你补充反应


(5)已知:酸性过硫酸钠溶液,在
 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。在
溶液可以产生白色沉淀。在 催化作用下,用酸性
催化作用下,用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为
您最近一年使用:0次
4 . 进行乙醇的催化氧化及产物检验的实验装置如图所示,下列有关说法错误的是


A.乙醇能发生反应: |
| B.Ⅰ中左侧固体颜色按“红色→黑色→红色”变化 |
C.本实验可证明 能挥发 能挥发 |
| D.Ⅱ中很快有银镜生成 |
您最近一年使用:0次
2023-04-11更新
|
568次组卷
|
2卷引用:河南省南阳市南阳六校联考2022-2023学年高二下学期4月月考(期中)化学试题
名校
解题方法
5 .  的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 、
、 、
、 、
、 等形成配离子使溶液显色。如:显浅紫色的
等形成配离子使溶液显色。如:显浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:

已知 与
与 、
、 在溶液中存在以下平衡:
在溶液中存在以下平衡: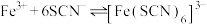 (红色);
(红色);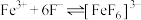 (无色)。
(无色)。
下列说法不正确的是
 的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 、
、 、
、 、
、 等形成配离子使溶液显色。如:显浅紫色的
等形成配离子使溶液显色。如:显浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:
已知
 与
与 、
、 在溶液中存在以下平衡:
在溶液中存在以下平衡: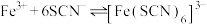 (红色);
(红色);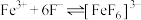 (无色)。
(无色)。下列说法不正确的是
A.Ⅰ中溶液呈黄色可能是由 水解产物的颜色引起的 水解产物的颜色引起的 |
B. 与 与 的配位能力强于 的配位能力强于 |
C.为了能观察到溶液Ⅰ中 的颜色,可向该溶液中加入稀盐酸 的颜色,可向该溶液中加入稀盐酸 |
| D.向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色 |
您最近一年使用:0次
2023-03-25更新
|
603次组卷
|
8卷引用:河南省焦作市博爱县第一中学2022-2023学年高二下学期5月月考化学试题
解题方法
6 . 铝片与Na2CO3溶液反应的探究实验如图所示。
下列说法不正确的是
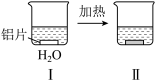 | 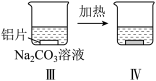 | |
| 无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.Na2CO3溶液中存在水解平衡:CO +H2O +H2O HCO HCO +OH- +OH- |
| B.对比I、III,说明Na2CO3溶液能破坏铝表面的保护膜 |
C.推测出现白色浑浊的原因[Al(OH)4]-+HCO =Al(OH)3↓+CO =Al(OH)3↓+CO +H2O +H2O |
| D.热后H2和CO2逸出时发生的反应均为氧化还原反应 |
您最近一年使用:0次
名校
解题方法
7 . 下列有关实验现象、结论与实验操作相互匹配的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向 溶液中滴加过量氯水,再加入淀粉 溶液中滴加过量氯水,再加入淀粉 溶液 溶液 | 溶液先变橙色,后变蓝色 | 氧化性: |
| B | 将铁锈溶于浓盐酸,再滴入 溶液 溶液 | 溶液紫色褪去 | 铁锈与浓盐酸反应生成亚铁离子 |
| C | 室温下,用pH试纸分别测定等物质的量浓度的 溶液和 溶液和 溶液的pH 溶液的pH |  溶液对应的pH更大 溶液对应的pH更大 | 酸性: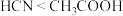 |
| D | 两支试管各盛  酸性高锰酸钾溶液,分别加入 酸性高锰酸钾溶液,分别加入  草酸溶液和 草酸溶液和 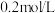 草酸溶液 草酸溶液 | 加入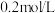 草酸溶液的试管中溶液褪色更快 草酸溶液的试管中溶液褪色更快 | 其他条件相同,反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-16更新
|
349次组卷
|
2卷引用:河南省鹤壁市高中2022-2023学年高二下学期第一次段考化学试题
8 . 金属腐蚀现象遍及国民经济和国防建设各个领域,危害十分严重。近几十年来,金属的腐蚀与防腐已成为一门独立的综合性边缘学科。某实验小组利用如图所示装置进行铁的电化学腐蚀原理及防护的探究实验:
(1)已知,Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
小组同学认为以下两种检验方法,均能证明铁发生了吸氧腐蚀。
①用电极反应式解释实验i中的现象:___________ 。
②查阅资料:K3[Fe(CN)6]具有氧化性。有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是___________ 。
③为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,进行下列实验,几分钟后的记录如下:
a. 以上实验表明:在Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是___________ 。
(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
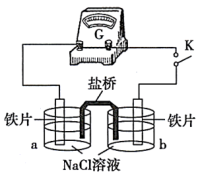
①分别取少量容器a、b中的溶液于试管中,滴加K3[Fe(CN)6]溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做___________ 极。
②加热后,电流计指针发生偏转的原因可能是___________ 。
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应式___________ 。
(1)已知,Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
小组同学认为以下两种检验方法,均能证明铁发生了吸氧腐蚀。
| 装置 | 分别进行的操作 | 现象 |
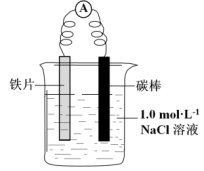 | i.连好装置一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 |
| ii.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
②查阅资料:K3[Fe(CN)6]具有氧化性。有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是
③为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,进行下列实验,几分钟后的记录如下:
| 实验 | 胶头滴管 | 试管 | 现象 |
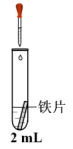 | 0.5 mol/L K3[Fe(CN)6]溶液 | iii.蒸馏水 | 无明显变化 |
iv. 溶液 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 溶液 溶液 | 无明显变化 |
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是
(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

①分别取少量容器a、b中的溶液于试管中,滴加K3[Fe(CN)6]溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做
②加热后,电流计指针发生偏转的原因可能是
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应式
您最近一年使用:0次
2021-10-11更新
|
313次组卷
|
2卷引用:河南省周口市太康县2022-2023学年高二上学期1月期末考试化学试题
名校
9 . 下图所示为某化学兴趣小组设计的乙醇氧化的实验装置并验证其产物(图中加热仪器、铁架台、铁夹等均未画出)。
(1)E处是一种纯净物,其发生反应的化学方程式为_____ 。
(2)为使A中乙醇平稳汽化成乙醇蒸气,常采用的方法是____ 。D处使用碱石灰的作用是_____ 。
(3)能证明乙醇反应后产物的实验现象是____ 。写出F处对应现象的化学方程式_____ 。
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同。推断B处发生反应的化学方程式____ 。
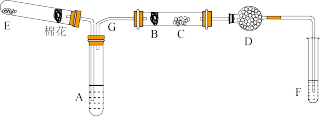
(1)E处是一种纯净物,其发生反应的化学方程式为
(2)为使A中乙醇平稳汽化成乙醇蒸气,常采用的方法是
(3)能证明乙醇反应后产物的实验现象是
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同。推断B处发生反应的化学方程式
您最近一年使用:0次
2021-04-29更新
|
549次组卷
|
7卷引用:河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题
10 . 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
【查阅资料】25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
【实验探究】向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
A、白色沉淀转化为红褐色沉淀 B、白色沉淀不发生改变
C、红褐色沉淀转化为白色沉淀 D、白色沉淀溶解,得无色溶液
(2)测得试管Ⅰ中所得混合液pH=6,则溶液中c(Fe3+)=______________ 。
(3)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1: 结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________ 。
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是__________ (填 “1”或“2”)。
【查阅资料】25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
【实验探究】向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/LFeCl3溶液 | ① |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ② |
C、红褐色沉淀转化为白色沉淀 D、白色沉淀溶解,得无色溶液
(2)测得试管Ⅰ中所得混合液pH=6,则溶液中c(Fe3+)=
(3)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:
 结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。猜想2:
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是
您最近一年使用:0次
2018-06-25更新
|
522次组卷
|
9卷引用:河南省南阳市第八中学校2022-2023学年高二上学期线上期末考试化学试题
河南省南阳市第八中学校2022-2023学年高二上学期线上期末考试化学试题河南省中原名校2021-2022学年高二上学期期末联考化学试题作业(二十一) 沉淀溶解平衡的应用【全国百强校】四川省绵阳市南山中学2017-2018学年高二下学期期末模拟考试(6月)化学试题【全国百强校】四川省绵阳市南山中学2017-2018学年高二下学期期末模拟考试(6月)化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第三单元 水溶液中的离子平衡单元测试A卷四川省棠湖中学2019-2020学年高二下学期期中考试化学试题安徽省太和第一中学2020-2021学年高二上学期期中考试化学(普通班)试题安徽省怀宁中学2020-2021学年高二上学期第二次质量检测(普通班)化学试题



