解题方法
1 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:
 +2H2O+H2SO4
+2H2O+H2SO4
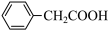 +NH4HSO4
+NH4HSO4
2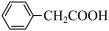 +Cu(OH)2→(
+Cu(OH)2→(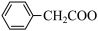 )2Cu+2H2O
)2Cu+2H2O
如图为制备苯乙酸的装置示意图(加热和夹持装置等略):已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
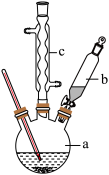
回答下列问题:
(1)在 三口瓶a中加入
三口瓶a中加入 硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是___________ 。
(2)将a中的溶液加热至 ,缓缓滴加
,缓缓滴加 苯乙腈到硫酸溶液中然后升温至
苯乙腈到硫酸溶液中然后升温至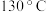 充分反应。在装置中,仪器b的作用是
充分反应。在装置中,仪器b的作用是___________ ;仪器c的名称是___________ ,其作用是___________ 。
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。下列仪器中可用于分离苯乙酸粗品的是___________ (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)提纯粗苯乙酸的具体操作步骤是___________ 、冷却结晶、过滤、洗涤、干燥。最终得到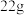 纯品,则苯乙酸的产率是
纯品,则苯乙酸的产率是___________ (保留三位有效数字)
(5)用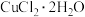 和
和 溶液制备适量
溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌
搅拌 ,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________ 。
 +2H2O+H2SO4
+2H2O+H2SO4
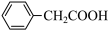 +NH4HSO4
+NH4HSO42
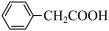 +Cu(OH)2→(
+Cu(OH)2→(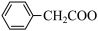 )2Cu+2H2O
)2Cu+2H2O如图为制备苯乙酸的装置示意图(加热和夹持装置等略):已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。

回答下列问题:
(1)在
 三口瓶a中加入
三口瓶a中加入 硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是(2)将a中的溶液加热至
 ,缓缓滴加
,缓缓滴加 苯乙腈到硫酸溶液中然后升温至
苯乙腈到硫酸溶液中然后升温至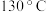 充分反应。在装置中,仪器b的作用是
充分反应。在装置中,仪器b的作用是(3)反应结束后加适量冷水,再分离出苯乙酸粗品。下列仪器中可用于分离苯乙酸粗品的是
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)提纯粗苯乙酸的具体操作步骤是
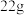 纯品,则苯乙酸的产率是
纯品,则苯乙酸的产率是(5)用
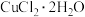 和
和 溶液制备适量
溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌
搅拌 ,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
名校
2 . 亚硫酰氯( )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解
I.亚硫酰氯( )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
(1)用硫磺、液氯和 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为_______ 。
(2) 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。
① 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是_______ (写出两点)。
②实验室常用NaOH溶液吸收 ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
II.硫酰氯( )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:

(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
(4)去除丙装置可能会发生的副反应是_______ (用化学方程式表示)。
(5)为了测定 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:
①根据上表中各种物质的 ,该实验应选择的指示剂为
,该实验应选择的指示剂为_______ (从下列选项中选择,填标号),滴定终点的现象是_______ 。
A. B.
B. C.
C. D.KBr
D.KBr
②该 产品的纯度为
产品的纯度为_______ %。
 )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解I.亚硫酰氯(
 )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。(1)用硫磺、液氯和
 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为(2)
 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。①
 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是②实验室常用NaOH溶液吸收
 ,该反应的离子方程式是
,该反应的离子方程式是II.硫酰氯(
 )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:
(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
| A.碱石灰、浓硫酸 | B.氯化钙、碱石灰 | C.碱石灰、五氧化二磷 | D.碱石灰、碱石灰 |
(5)为了测定
 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:| 物质 |  | AgCl |  |  | AgBr |
 | 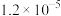 | 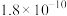 | 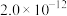 | 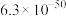 |  |
| 颜色 | 白色 | 白色 | 砖红色 | 黑色 | 浅黄色 |
 ,该实验应选择的指示剂为
,该实验应选择的指示剂为A.
 B.
B. C.
C. D.KBr
D.KBr②该
 产品的纯度为
产品的纯度为
您最近一年使用:0次
2022-11-08更新
|
493次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期中考试化学试题
3 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4
 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________ 。
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是_____________________ ;仪器c的名称是______________ ,其作用是___________________________________________ 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________ 。下列仪器中可用于分离苯乙酸粗品的是________________ (填标号)。
(3)提纯粗苯乙酸的方法是_____________ ,最终得到44 g纯品,则苯乙酸的产率是________ 。
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________ 。
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
| A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2019-01-30更新
|
3820次组卷
|
18卷引用:湖北省武汉中学2022-2023学年高二下学期5月月考化学试题
湖北省武汉中学2022-2023学年高二下学期5月月考化学试题2015-2016学年陕西西安铁一中学高二下开学考试化学试卷2015-2016学年山西省怀仁一中高二下第二次月考化学试卷2014-2015学年湖南省双峰一中高二下期中理科化学试卷广西南宁市第三中学2019-2020学年高二上学期期中考试化学(理)试题第三章 烃的含氧衍生物——B 拓展区 综合拓展(人教版选修5)重庆市主城区七校2019-2020学年高二下学期期末联考化学试题黑龙江省哈尔滨市哈师大附中2020-2021学年高二下学期期中考试化学试题(已下线)第一章 有机化合物的结构特点与研究方法 章末测试(A)-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)福建省莆田第一中学2021-2022学年高二上学期期中考试化学试题甘肃省永昌县第一高级中学2021-2022学年高二下学期期末考试化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(全国大纲卷)(已下线)2013-2014江西省临川一中高一下学期期末考试化学试卷(已下线)2013-2014学年江西省临川一中高一(下)期末考试化学试卷2016届黑龙江省哈尔滨三中高三上第三次检测理综化学试卷会做实验2020届高三化学实验复习——过滤、蒸馏、冷凝、洗气装置的创新应用【选择15+有机工艺10题突破】(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
4 . 苯酚是重要的化工原料,有关苯酚的实验如下:
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:
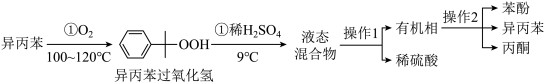
(1)异丙苯氧化过程①温度不能过高的原因是___________ 。
(2)检验有机相中是否含有水的试剂是___________ 。
(3)“操作1”的名称是___________ 。
(Ⅱ)苯酚的实验探究
探究铁盐种类和 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。
查阅资料:ⅰ.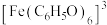 为紫色;
为紫色;
ⅱ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅲ.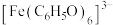 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与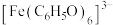 的浓度在一定范围内成正比
的浓度在一定范围内成正比
ⅳ.苯酚与 的显色原理:
的显色原理:
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
猜想3: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
进行实验:常温下,用盐酸调节配制得到 分别为a和b的
分别为a和b的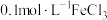 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的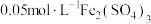 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为 。
。
(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是___________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂: 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体)
③小组同学得出实验结果为: ,
,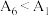 ,由此得出此结论是
,由此得出此结论是___________ 。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是___________ 。
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:

(1)异丙苯氧化过程①温度不能过高的原因是
(2)检验有机相中是否含有水的试剂是
(3)“操作1”的名称是
(Ⅱ)苯酚的实验探究
探究铁盐种类和
 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。查阅资料:ⅰ.
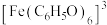 为紫色;
为紫色;ⅱ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅲ.
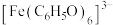 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与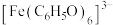 的浓度在一定范围内成正比
的浓度在一定范围内成正比ⅳ.苯酚与
 的显色原理:
的显色原理:
提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。猜想3:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。进行实验:常温下,用盐酸调节配制得到
 分别为a和b的
分别为a和b的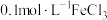 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的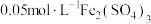 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。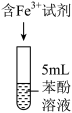 | 序号 | 含 的试剂 的试剂 | 吸光度 | |
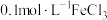 溶液 溶液 | 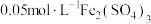 溶液 溶液 | |||
| 1 | 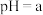 | / |  | |
| 2 |  | / |  | |
| 3 | / | 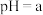 | 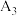 | |
| 4 | / |  | 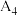 | |
 。
。(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂:
 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体) | 序号 | 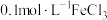 溶液 溶液 | 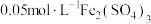 溶液 溶液 | 再加试剂 | 吸光度 |
| 5 | / | 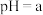 |  固体 固体 | 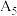 | |
| 6 | 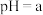 | / | 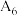 |
 ,
,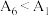 ,由此得出此结论是
,由此得出此结论是④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
您最近一年使用:0次
5 . 苯甲酸乙酯可用于配制香水及食用香精。实验室用苯甲酸与乙醇为原料制备苯甲酸乙酯,制备装置如图所示(部分装置已省略)。已知:

Ⅰ.合成苯甲酸乙酯粗产品按上图装置,在仪器C中加入2.44 g苯甲酸、15.0 mL乙醇、3.0 mL浓硫酸适量环己烷(与乙醇、水可形成共沸物),控制一定温度加热2 h后停止加热。
(1)本实验中制取苯甲酸乙酯的化学方程式为___________ 。
(2)结合数据分析,实验时使用过量乙醇的目的是___________ 。
(3)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧瓶,下层水层从分水器下口放出,反应结束的标志是___________ 。
Ⅱ.粗产品的精制将仪器C中的反应液倒入盛有水的烧杯中,滴加饱和Na2CO3溶液至溶液呈中性,用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,将二者合并转移至下图的仪器D中,加入沸石和无水氯化钙,加热蒸馏,制得产品2.4mL。
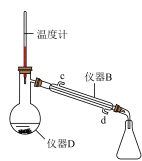
(4)仪器D的名称是___________ 。
(5)加入Na2CO3溶液的作用有___________ (填序号)。
a.除去硫酸和苯甲酸 b.降低苯甲酸乙酯的溶解度
(6)采用图乙装置进行蒸馏操作,收集___________ ℃的馏分。
(7)该实验中苯甲酸乙酯的产率是___________ (产率= ×100%)。
×100%)。

| 物质 | 乙醇 | 苯甲酸 | 乙醚 | 苯甲酸乙酯 |
| 密度/(g•cm﹣3) | 0.7893 | 1.2659 | 0.7318 | 1.0500 |
| 沸点/℃ | 78.5 | 249.0 | 34.5 | 212.0 |
| 相对分子质量 | 46 | 122 | 74 | 150 |
(1)本实验中制取苯甲酸乙酯的化学方程式为
(2)结合数据分析,实验时使用过量乙醇的目的是
(3)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧瓶,下层水层从分水器下口放出,反应结束的标志是
Ⅱ.粗产品的精制将仪器C中的反应液倒入盛有水的烧杯中,滴加饱和Na2CO3溶液至溶液呈中性,用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,将二者合并转移至下图的仪器D中,加入沸石和无水氯化钙,加热蒸馏,制得产品2.4mL。

(4)仪器D的名称是
(5)加入Na2CO3溶液的作用有
a.除去硫酸和苯甲酸 b.降低苯甲酸乙酯的溶解度
(6)采用图乙装置进行蒸馏操作,收集
(7)该实验中苯甲酸乙酯的产率是
 ×100%)。
×100%)。
您最近一年使用:0次
6 . 二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要含有CeFCO3)为原料制备二氧化铈的一种工艺流程如图所示。
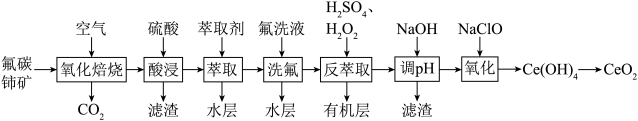
已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;
;
②Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物CeO2和CeF4,写出该反应的化学方程式___________ 。
(2)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是___________ 。
(3)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为___________ 。
(4)“反萃取”后的水层溶液中c(Ce3+)=1.0mol•L-1,c(Al3+)=0.01mol•L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则加入NaOH调节溶液pH的范围是___________ ,过滤后,再向滤液中加入NaOH使Ce3+沉淀完全。
已知:①室温下,当溶液中的离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全。
②Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21
(5)“氧化”时发生反应的离子方程式为___________ 。
(6)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得4.3吨CeO2,则CeO2的产率为___________ (保留3位有效数字,写出计算过程)。

已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物CeO2和CeF4,写出该反应的化学方程式
(2)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP
 CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是(3)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为
(4)“反萃取”后的水层溶液中c(Ce3+)=1.0mol•L-1,c(Al3+)=0.01mol•L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则加入NaOH调节溶液pH的范围是
已知:①室温下,当溶液中的离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全。
②Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21
(5)“氧化”时发生反应的离子方程式为
(6)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得4.3吨CeO2,则CeO2的产率为
您最近一年使用:0次



