解题方法
1 . 阿司匹林(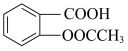 )是被广泛应用的解热镇痛和抗凝药。在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O] 为主要原料合成阿司匹林,设计如下实验步骤:
)是被广泛应用的解热镇痛和抗凝药。在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O] 为主要原料合成阿司匹林,设计如下实验步骤:
①取反应物:取适量水杨酸、醋酸酐、浓硫酸加入反应容器,混合摇匀;
②合成:控制温度为85°C ~90°C加热10分钟后,冷却反应液、过滤、洗涤得粗产品;
③提纯。
已知:
请根据以上信息回答下列问题:
(1)取反应物前应先向反应容器中加入_______ 。
(2)合成应在_______ (填“无水”或“有水”)条件下进行,最合适的加热方法是_______ 。
(3)冷却反应液后,发现无晶体析出,此时可采取的措施是_______ 。
(4)I.提纯时,先加入少量的NaHCO3溶液后过滤,再向固体中加盐酸酸化,冷却、过滤、洗涤、干燥后得到较纯的阿司匹林。判断洗涤干净的方法是_______ 。
II.另一种提纯方法是将粗产品与乙酸乙酯、沸石混合后加热回流,趁热过滤、冷却过滤、洗涤干燥。其中回流的装置如图所示:

①使用温度计的目的是_______ 。
②乙酸乙酯的作用是_______ ,该方法所得产品中有机杂质要比方案I少,原因是_______ 。
 )是被广泛应用的解热镇痛和抗凝药。在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O] 为主要原料合成阿司匹林,设计如下实验步骤:
)是被广泛应用的解热镇痛和抗凝药。在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O] 为主要原料合成阿司匹林,设计如下实验步骤:①取反应物:取适量水杨酸、醋酸酐、浓硫酸加入反应容器,混合摇匀;
②合成:控制温度为85°C ~90°C加热10分钟后,冷却反应液、过滤、洗涤得粗产品;
③提纯。
已知:
| 名称 | 相对分子质量 | 相关性质 |
| 水杨酸 | 138 | 熔点15°C,微溶于水 |
| 醋酸酐 | 102 | 沸点139.4°C,与水激烈反应生成醋酸 |
| 乙酰水杨酸 | 180 | 熔点135°C,128~ 135°C分解,微溶于水 |
(1)取反应物前应先向反应容器中加入
(2)合成应在
(3)冷却反应液后,发现无晶体析出,此时可采取的措施是
(4)I.提纯时,先加入少量的NaHCO3溶液后过滤,再向固体中加盐酸酸化,冷却、过滤、洗涤、干燥后得到较纯的阿司匹林。判断洗涤干净的方法是
II.另一种提纯方法是将粗产品与乙酸乙酯、沸石混合后加热回流,趁热过滤、冷却过滤、洗涤干燥。其中回流的装置如图所示:

①使用温度计的目的是
②乙酸乙酯的作用是
您最近一年使用:0次
2023-05-03更新
|
1004次组卷
|
5卷引用:第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)云南省“3+3+3”2023届高三下学期诊断性联考二模理综化学试题(已下线)考点巩固卷13 化学实验基础(二)(3个考点30题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)第33讲认识有机化合物(已下线)考点1 认识有机化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
解题方法
2 . 乙酰苯胺是合成磺胺类药物的重要原料,也可用作止痛剂,退热剂和防腐剂。某化学兴趣小组在实验室中制备并提纯乙酰苯胺的过程如下。
已知:①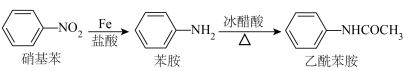
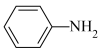 +CH3COOH
+CH3COOH
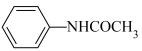 +H2O
+H2O
②有机物相关数据
I.制备并提纯苯胺
先还原硝基苯制备苯胺,所得苯胺粗产品中混有少量互溶的硝基苯杂质,提纯过程如下:

(1)苯胺与盐酸反应生成可溶于水的盐的化学方程式为___________ 。
(2)操作1与操作2相同,需要用到的主要玻璃仪器有___________ 、烧杯。
(3)无水硫酸钠固体的作用是___________ 。
Ⅱ.制备乙酰苯胺
在圆底烧瓶中加入9.3g苯胺,足量冰醋酸及少量锌粉,组装好仪器,维持圆底烧瓶中反应温度在100~110℃之间,反应一段时间后,在搅拌下趁热将圆底烧瓶中的混合物倒入冰水中,抽滤、洗涤、烘干得到乙酰苯胺粗产品。
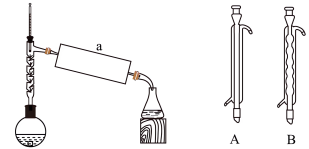
(4)a处应选择仪器___________ (填“A”或“B”),其名称为___________ 。
(5)结合反应原理,从化学平衡角度分析,使用蒸馏装置的原因是___________ 。
(6)加入少量锌粉的作用是___________ 。
Ⅲ.乙酰苯胺粗产品提纯
(7)将制得的乙酰苯胺粗产品放入烧杯中,加入适量蒸馏水,加热,搅拌,使粗产品完全溶解。加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,___________ (填操作名称)。待所得滤液完全冷却后滤出晶体,经洗涤、干燥、称量,得到产品8.7g。该实验中乙酰苯胺的产率为___________ (保留三位有效数字)。
已知:①

 +CH3COOH
+CH3COOH
 +H2O
+H2O②有机物相关数据
| 名称 | 相对分子质量 | 常温下性状 | 主要性质 |
| 硝基苯 | 123 | 无色或微黄色,具有苦杏仁味的油状液体 | 难溶于水,易溶于有机溶剂 |
| 苯胺 | 93 | 无色油状液体 | 有碱性和还原性,在空气中易被氧化,微溶于水,易溶于乙醇和乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 微溶于冷水,溶于沸水,溶于有机溶剂 |
先还原硝基苯制备苯胺,所得苯胺粗产品中混有少量互溶的硝基苯杂质,提纯过程如下:

(1)苯胺与盐酸反应生成可溶于水的盐的化学方程式为
(2)操作1与操作2相同,需要用到的主要玻璃仪器有
(3)无水硫酸钠固体的作用是
Ⅱ.制备乙酰苯胺
在圆底烧瓶中加入9.3g苯胺,足量冰醋酸及少量锌粉,组装好仪器,维持圆底烧瓶中反应温度在100~110℃之间,反应一段时间后,在搅拌下趁热将圆底烧瓶中的混合物倒入冰水中,抽滤、洗涤、烘干得到乙酰苯胺粗产品。

(4)a处应选择仪器
(5)结合反应原理,从化学平衡角度分析,使用蒸馏装置的原因是
(6)加入少量锌粉的作用是
Ⅲ.乙酰苯胺粗产品提纯
(7)将制得的乙酰苯胺粗产品放入烧杯中,加入适量蒸馏水,加热,搅拌,使粗产品完全溶解。加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,
您最近一年使用:0次
3 . 据公安部统计,截至2023年6月底,成都汽车保有量超过600万辆,仅次于北京,居全国第二、高密度的车辆行驶,容易引发交通事故,若车辆受到相对较大撞击,就会引起安全气囊弹出,从而保护车内乘客。叠氮化钠是汽车安全气囊内的重要填充物质。某化学兴趣小组根据工业制备叠氮化钠(NaN3)的方法在实验室设计出制备该物质的装置如下:
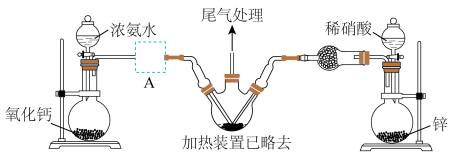
已知:ⅰ.工业上制备 的原理分两步进行:
的原理分两步进行:
①将 通入熔融状态的Na中先制得
通入熔融状态的Na中先制得 ,
,
②将 与
与 加热至
加热至 左右合成
左右合成 ,在合成过程中,易发生副反应:
,在合成过程中,易发生副反应: ;
;
ⅱ. 和
和 的性质如下表:
的性质如下表:
ⅲ. 属于危险化学药品,工业上一般用NaClO销毁剩余
属于危险化学药品,工业上一般用NaClO销毁剩余 ;
;
ⅳ. 与
与 离子反应产生鲜明的血红色,此反应非常灵敏。
离子反应产生鲜明的血红色,此反应非常灵敏。
回答下列问题:
(1)盛装浓氨水的仪器的名称是___________ 。
(2)连接好装置之后,应进行的操作是___________ 。
(3)实验室用 和稀硝酸反应制备
和稀硝酸反应制备 ,其离子方程式为
,其离子方程式为___________ 。
(4)图中虚线框处应选用的装置是___________ (填标号)。

(5)安全气囊中填充 的理由是
的理由是___________ 。
(6)在销毁多余 时会有
时会有 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为___________ ;如何检测销毁是否彻底,请提供一种检测方法:___________ 。

已知:ⅰ.工业上制备
 的原理分两步进行:
的原理分两步进行:①将
 通入熔融状态的Na中先制得
通入熔融状态的Na中先制得 ,
,②将
 与
与 加热至
加热至 左右合成
左右合成 ,在合成过程中,易发生副反应:
,在合成过程中,易发生副反应: ;
;ⅱ.
 和
和 的性质如下表:
的性质如下表:| 物质 |  |  |
| 性质 | 白色固体,易溶于水,有一定危险性,受撞击易快速分解出一种无色、无味、无毒的气体,且有固体Na生成。 | 无色、有甜味的气体,有轻微麻醉作用,常用于医疗,有一定氧化性。 |
 属于危险化学药品,工业上一般用NaClO销毁剩余
属于危险化学药品,工业上一般用NaClO销毁剩余 ;
;ⅳ.
 与
与 离子反应产生鲜明的血红色,此反应非常灵敏。
离子反应产生鲜明的血红色,此反应非常灵敏。回答下列问题:
(1)盛装浓氨水的仪器的名称是
(2)连接好装置之后,应进行的操作是
(3)实验室用
 和稀硝酸反应制备
和稀硝酸反应制备 ,其离子方程式为
,其离子方程式为(4)图中虚线框处应选用的装置是

(5)安全气囊中填充
 的理由是
的理由是(6)在销毁多余
 时会有
时会有 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为
您最近一年使用:0次
名校
4 . 氨基甲酸铵(NH2COONH4)是一种重要的医用氨化剂,有关该物质的信息如下表所示:
某实验小组在实验室中利用下列装置合成少量的氨基甲酸铵。回答下列问题:
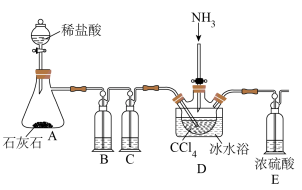
(1)盛放稀盐酸的仪器的名称是___________ 。
(2)装置B和C中试剂的名称分别是___________ 、___________ 。
(3)实验室制取氨气的化学方程式为___________ 。
(4)反应结束后,从三颈烧瓶中分离出产品,进行的实验操作是___________ 。
(5)装置E的作用有___________ (写出两点)。若观察到E中出现大量气泡(浓硫酸足量),则可能的原因是___________ 。
(6)设计实验:检验制得的产品中是否混有 ?
?___________ 。
| 制备原理 | 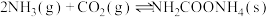 放热反应 放热反应 |
| 主要性质 | ①在潮湿的空气中转变为 ②温度较高时容易分解生成  、 、 ③不溶于  |

(1)盛放稀盐酸的仪器的名称是
(2)装置B和C中试剂的名称分别是
(3)实验室制取氨气的化学方程式为
(4)反应结束后,从三颈烧瓶中分离出产品,进行的实验操作是
(5)装置E的作用有
(6)设计实验:检验制得的产品中是否混有
 ?
?
您最近一年使用:0次
2023-07-14更新
|
78次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期开学化学试题
5 . 一种用硫铜矿(主要含CuS、 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
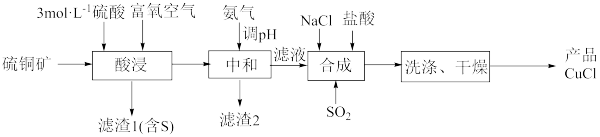
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成 ;
;
②CuCl在潮湿的空气中易被氧化,生成的碱式盐为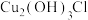 ;
;
③已知 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:
回答下列问题:
(1)“酸浸”时,富氧空气的作用_______ 。
(2)“酸浸”时,CuS反应的化学方程式为_______ 。
(3)用氨水调pH时,应将溶液的范围调整为_______ 。
(4)“合成”时, 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为_______ 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为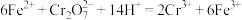
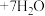 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为_______ (杂质不参与反应,列出计算式即可)。
(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。
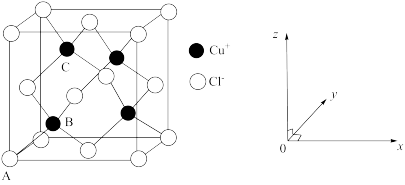
①图中原子的坐标参数:A为 ,B为
,B为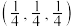 ,则C的坐标参数为
,则C的坐标参数为_______ 。
② 与
与 最短的距离是
最短的距离是_______ nm。
 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成
 ;
;②CuCl在潮湿的空气中易被氧化,生成的碱式盐为
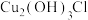 ;
;③已知
 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:| 金属离子 |  |  |  |
| 开始沉淀pH | 4.7 | 8.1 | 1.2 |
| 完全沉淀pH | 6.7 | 9.6 | 3.2 |
(1)“酸浸”时,富氧空气的作用
(2)“酸浸”时,CuS反应的化学方程式为
(3)用氨水调pH时,应将溶液的范围调整为
(4)“合成”时,
 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为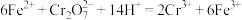
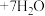 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。

①图中原子的坐标参数:A为
 ,B为
,B为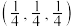 ,则C的坐标参数为
,则C的坐标参数为②
 与
与 最短的距离是
最短的距离是
您最近一年使用:0次
2023-04-11更新
|
515次组卷
|
4卷引用:河南省驻马店高级中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
6 . 亚硝酰氯(NOCl)可用做有机合成试剂。某研究小组用NO和Cl2制备NOCl,并分离回收未反应的原料,装置如图(夹持及加热装置已略去)。
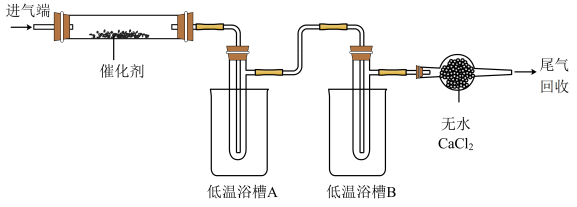
已知:① ;
;
②沸点: NOCl为-6℃,Cl2为-34℃,NO为-152℃ ;
③NOCl易水解,能与O2反应。下列说法错误的是

已知:①
 ;
;②沸点: NOCl为-6℃,Cl2为-34℃,NO为-152℃ ;
③NOCl易水解,能与O2反应。下列说法错误的是
| A.实验前先通入氩气,目的是排尽装置内的空气 |
| B.低温浴槽B的温度区间应控制在-34℃~-6℃ |
| C.将催化剂负载在玻璃棉上,以增大接触面积,提高反应速率 |
| D.尾气回收的物质为NO |
您最近一年使用:0次
2023-02-10更新
|
398次组卷
|
3卷引用:四川省成都外国语学校2022-2023学年高二下学期3月月考化学试题
名校
解题方法
7 . 三氯化六氨合钴([Co(NH3)6]Cl3(Mr=267.5g∙mol-1,橙黄色晶体)是合成其它含钴配合物的重要原料,它难溶于乙醇,微溶于盐酸,稍溶于水,常温下较稳定,强热时部分分解,实验室制备三氯化六氨合钴的反应原理为:2CoCl2∙6H2O+10NH3∙H2O+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+24H2O
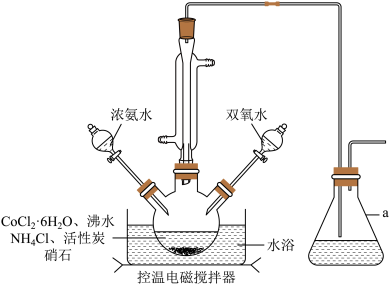
实验装置如图,具体流程如下:
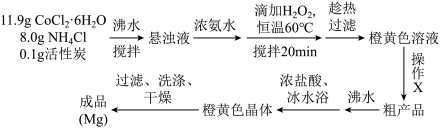
请回答下列问题:
(1)仪器a的名称为___________ 。加入双氧水的操作方法是___________ 。
(2)操作X为___________ 。
(3)活性炭在本实验中的作用主要是___________ 。
(4)提纯粗产品时,加入浓盐酸并用冰水浴冷却的目的是___________ 。
(5)洗涤橙黄色晶体,下列方法中最合适的是___________ 。
A. 先用盐酸洗,后用乙醇洗
B. 先用盐酸洗,后用冷水洗
C. 先用冷水洗,后用乙醇洗
D. 先用乙醇洗,后用冷水洗
(6)本实验在干燥成品时,一般采用沸水浴干燥的方式,可能的原因是___________ 。
(7)称取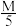 g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为
g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为___________ 。(2Co3++2I﹣=2Co2++I2,I2+2S2O =2I﹣+S4O
=2I﹣+S4O )
)

实验装置如图,具体流程如下:

请回答下列问题:
(1)仪器a的名称为
(2)操作X为
(3)活性炭在本实验中的作用主要是
(4)提纯粗产品时,加入浓盐酸并用冰水浴冷却的目的是
(5)洗涤橙黄色晶体,下列方法中最合适的是
A. 先用盐酸洗,后用乙醇洗
B. 先用盐酸洗,后用冷水洗
C. 先用冷水洗,后用乙醇洗
D. 先用乙醇洗,后用冷水洗
(6)本实验在干燥成品时,一般采用沸水浴干燥的方式,可能的原因是
(7)称取
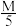 g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为
g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为 =2I﹣+S4O
=2I﹣+S4O )
)
您最近一年使用:0次
解题方法
8 . 磷酸铁 是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备
是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备 。
。
步骤i:洗涤——分别用X、水洗涤;
步骤ii:酸浸——用稀硫酸溶解;
步骤iii:氧化——用双氧水氧化;
步骤iv:沉铁——用 溶液沉淀
溶液沉淀 ;
;
步骤v:分离——过滤、洗涤、干燥,最后得到 。
。
(1)洗涤是为了除去废铁屑表面的油污,则X通常是热的___________ 溶液(填化学式)。
(2)酸浸时发生的反应除了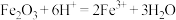 、
、 外,还可能有
外,还可能有___________ (写离子方程式)。
(3)检验 全部被氧化的实验方法是
全部被氧化的实验方法是___________ 。
(4)沉铁时有 沉淀和
沉淀和 生成,则该反应的离子方程式为
生成,则该反应的离子方程式为___________ 。
(5)研究发现,不同 对
对 沉淀的影响如表所示:
沉淀的影响如表所示:
当 时随
时随 的增加,
的增加, 的沉淀率开始下降,而
的沉淀率开始下降,而 沉淀率未下降,其原因可能为
沉淀率未下降,其原因可能为____ 。
 是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备
是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备 。
。步骤i:洗涤——分别用X、水洗涤;
步骤ii:酸浸——用稀硫酸溶解;
步骤iii:氧化——用双氧水氧化;
步骤iv:沉铁——用
 溶液沉淀
溶液沉淀 ;
;步骤v:分离——过滤、洗涤、干燥,最后得到
 。
。(1)洗涤是为了除去废铁屑表面的油污,则X通常是热的
(2)酸浸时发生的反应除了
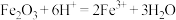 、
、 外,还可能有
外,还可能有(3)检验
 全部被氧化的实验方法是
全部被氧化的实验方法是(4)沉铁时有
 沉淀和
沉淀和 生成,则该反应的离子方程式为
生成,则该反应的离子方程式为(5)研究发现,不同
 对
对 沉淀的影响如表所示:
沉淀的影响如表所示: | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | |
| 沉降率/% |  | 90.0 | 94.6 | 97.9 | 99.2 | 95.3 |
 | 88.1 | 95.4 | 97.2 | 98.5 | 99.8 | |
当
 时随
时随 的增加,
的增加, 的沉淀率开始下降,而
的沉淀率开始下降,而 沉淀率未下降,其原因可能为
沉淀率未下降,其原因可能为
您最近一年使用:0次
名校
解题方法
9 . 周期表中ⅡA族镁、铍及其及其化合物应用广泛。
I.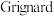 试剂(
试剂(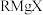 )是有机合成中的重要试剂之一,一种合成应用机理为:
)是有机合成中的重要试剂之一,一种合成应用机理为: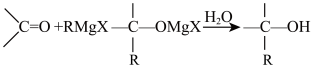 ,回答以下问题:
,回答以下问题:
(1)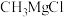 中镁元素的化合价为
中镁元素的化合价为___________ ,丙酮(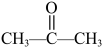 )与
)与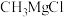 发生上述反应所得醇的结构简式为
发生上述反应所得醇的结构简式为___________ 。
(2)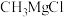 易发生水解反应,生成甲烷、一种碱和一种镁盐。试写出该反应的化学方程式:
易发生水解反应,生成甲烷、一种碱和一种镁盐。试写出该反应的化学方程式:___________ 。
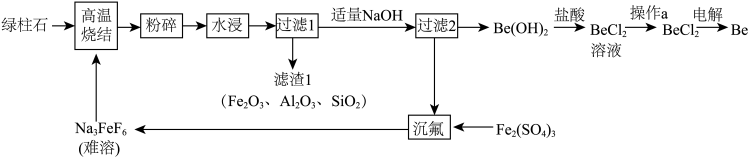
Ⅱ.铍是比热容最高的结构材料,常用来制作航天航空部件。以绿柱石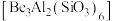 为原料制备金属铍的工艺如下:
为原料制备金属铍的工艺如下:
已知: 与
与 性质相似,强碱溶液中会转化为
性质相似,强碱溶液中会转化为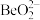 。
。
回答下列问题:
(3)烧结冷却后,粉碎的目的是___________ 。
(4)流程中沉铍加 不能过量,用化学方程式表示原因
不能过量,用化学方程式表示原因___________ 。往滤渣1中加强碱,分离回收铝元素的离子方程式为___________ 。
(5)操作 是
是___________ 。
(6)“水浸”后铍元素以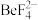 形式存在。“过滤2”得滤液“沉氟”的离子方程式为
形式存在。“过滤2”得滤液“沉氟”的离子方程式为___________ 。
I.
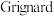 试剂(
试剂(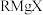 )是有机合成中的重要试剂之一,一种合成应用机理为:
)是有机合成中的重要试剂之一,一种合成应用机理为: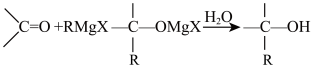 ,回答以下问题:
,回答以下问题:(1)
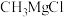 中镁元素的化合价为
中镁元素的化合价为 )与
)与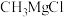 发生上述反应所得醇的结构简式为
发生上述反应所得醇的结构简式为(2)
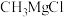 易发生水解反应,生成甲烷、一种碱和一种镁盐。试写出该反应的化学方程式:
易发生水解反应,生成甲烷、一种碱和一种镁盐。试写出该反应的化学方程式:Ⅱ.铍是比热容最高的结构材料,常用来制作航天航空部件。以绿柱石
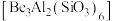 为原料制备金属铍的工艺如下:
为原料制备金属铍的工艺如下:已知:
 与
与 性质相似,强碱溶液中会转化为
性质相似,强碱溶液中会转化为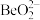 。
。
回答下列问题:
(3)烧结冷却后,粉碎的目的是
(4)流程中沉铍加
 不能过量,用化学方程式表示原因
不能过量,用化学方程式表示原因(5)操作
 是
是(6)“水浸”后铍元素以
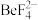 形式存在。“过滤2”得滤液“沉氟”的离子方程式为
形式存在。“过滤2”得滤液“沉氟”的离子方程式为
您最近一年使用:0次
2021-07-09更新
|
198次组卷
|
3卷引用:江西省永丰县永丰中学2022-2023学年高二上学期1月期末期末化学(A班)试题



