名校
1 . 海带提碘过程中以 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。

下列说法错误的是
 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。
下列说法错误的是
| A.反应1的目的为将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中 |
| B.操作1需要用到的玻璃仪器有普通漏斗、烧杯和玻璃棒 |
C.反应2的离子方程式为 |
| D.操作2的名称为过滤 |
您最近一年使用:0次
2023-08-21更新
|
215次组卷
|
2卷引用:江西省宜春市丰城拖船中学2023-2024学年高二上学期开学化学试题
名校
解题方法
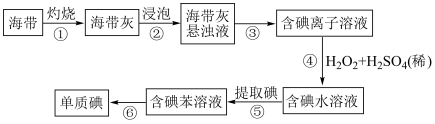
2 . (一)海带中含有丰富的碘.为从海带中提取碘,某研究性学习小组设计并进行以下实验:
提示:苯是有机萃取剂,其密度小于水。
(1)步骤③⑤和的实验操作名称分别是______ ,______ 。
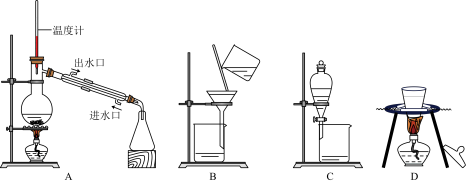
(2)①需用到以下装置是______ 。
(3)步骤④中反应的离子方程式是______ 。
(4)步骤⑤中,______ (填“能”或“不能”)用酒精来萃取碘的理由______ 。
(二)海水提碘实验中,得到碘的苯溶液后也可用“反萃取法”萃取、富集碘单质,实验步骤如下:
(5)上述过程②中,发生的离子方程式______ 。
(6)请设计一种检验过程③提取碘后的水溶液中是否还含有单质碘的简单方法:______ 。
提示:苯是有机萃取剂,其密度小于水。
(1)步骤③⑤和的实验操作名称分别是
(2)①需用到以下装置是
(3)步骤④中反应的离子方程式是
(4)步骤⑤中,
(二)海水提碘实验中,得到碘的苯溶液后也可用“反萃取法”萃取、富集碘单质,实验步骤如下:

(5)上述过程②中,发生的离子方程式
(6)请设计一种检验过程③提取碘后的水溶液中是否还含有单质碘的简单方法:
您最近一年使用:0次
2023-08-14更新
|
214次组卷
|
4卷引用:江西省宜春市丰城拖船中学2023-2024学年高二上学期开学化学试题
名校
3 . 实验室模拟工业海带提砷的流程如图。下列说法错误的是
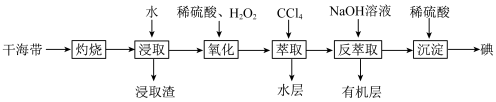
| A.“灼烧”用到的硅酸盐仪器有坩埚、泥三角、玻璃棒、酒精灯 |
B.“氧化”时发生反应的离子方程式为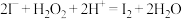 |
| C.“反萃取”所得有机层经处理后可循环再利用 |
D.“沉淀”时每生成 碘,理论上转移 碘,理论上转移 电子 电子 |
您最近一年使用:0次
2023-08-03更新
|
315次组卷
|
3卷引用:江西省抚州市黎川县第二中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
4 . 海藻中食含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图所示:
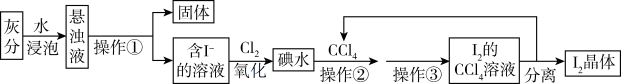
(1)操作①的名称_____ ,操作③的名称_____ 。实验室进行操作①使用的仪器有铁架台(带铁圈)、漏斗和_____ 。
(2)操作②选用CCl4的理由是_____(填写序号)。
(3)用NaOH溶液反萃取后再加稀硫酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件: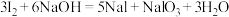 ;
;
酸性条件: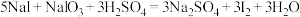 。
。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的_____ (填仪器名称)中加入少量1mol/LNaOH溶液;
②振荡至溶液的_____ 色消失,静置,分层,则_____ (填“上”。“下”)层为CCl4;
③将含碘的碱溶液从仪器的_____ (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1mol⋅L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)本实验中可以循环利用的物质是_____ 。

(1)操作①的名称
(2)操作②选用CCl4的理由是_____(填写序号)。
| A.CCl4不溶于水 | B.CCl4的密度比水大 |
| C.碘在CCl4中比在水中溶解度更大 | D.CCl4与碘水不反应 |
碱性条件:
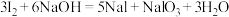 ;
;酸性条件:
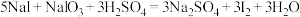 。
。以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的
②振荡至溶液的
③将含碘的碱溶液从仪器的
④边搅拌边加入几滴1mol⋅L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)本实验中可以循环利用的物质是
您最近一年使用:0次
2023-07-19更新
|
131次组卷
|
2卷引用:江西省抚州市黎川县第二中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
5 . 某学习小组按如下实验流程从海带浸取液中提取碘。

| A.NaOH的作用是将I2转化成离子进入水层,应控制NaOH溶液的浓度和体积 |
| B.加NaOH溶液后分液时,先将下层液体放出后,再从下口将上层液体放出 |
C.加入H2SO4溶液,反应的离子方程式为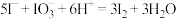 |
| D.坩埚中灼烧干海带可制得海带灰 |
您最近一年使用:0次
2023-07-08更新
|
317次组卷
|
3卷引用:江西省井冈山大学附属中学2022-2023学年高一下学期期末考试化学试题
解题方法
6 . 海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图,下列有关说法正确的是
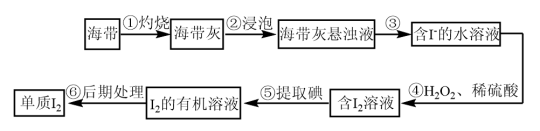

| A.实验室在蒸发皿中灼烧干海带,并用玻璃棒搅拌 |
| B.海带灰的悬浊液中加入几滴淀粉溶液,溶液变蓝色 |
| C.操作③与操作⑤方法相同 |
| D.操作④发生的离子反应:2I-+2H++H2O2=I2+2H2O |
您最近一年使用:0次
7 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___________(填序号)。
(2)海带中含有碘元素。实验室提取碘的步骤如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是___________ 。海带灰中含有硫酸镁、碳酸钠等,在实验步骤___________ (填序号)中实现与碘分离。
②写出步骤④反应的离子方程式___________ 。提取碘的过程中,不能选择乙醇代替 提取碘单质的原因
提取碘单质的原因___________ 。
(3)已知: ,氯气既可以氧化
,氯气既可以氧化 ,也可以氧化
,也可以氧化 。往200mL
。往200mL 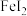 溶液中通入8.96L(标准状况)
溶液中通入8.96L(标准状况) ,反应完成后,溶液中有
,反应完成后,溶液中有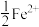 被氧化,则原
被氧化,则原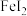 溶液的物质的量浓度为
溶液的物质的量浓度为___________ 。
(1)无需经过化学变化就能从海水中获得的物质是___________(填序号)。
| A.食盐 | B.溴 | C.烧碱 | D.纯碱 |

①灼烧海带至灰烬时所用的主要仪器名称是
②写出步骤④反应的离子方程式
 提取碘单质的原因
提取碘单质的原因(3)已知:
 ,氯气既可以氧化
,氯气既可以氧化 ,也可以氧化
,也可以氧化 。往200mL
。往200mL 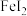 溶液中通入8.96L(标准状况)
溶液中通入8.96L(标准状况) ,反应完成后,溶液中有
,反应完成后,溶液中有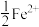 被氧化,则原
被氧化,则原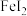 溶液的物质的量浓度为
溶液的物质的量浓度为
您最近一年使用:0次
8 . 海水是自然赐给人类的宝藏,开发和利用海水资源是当前科学研究的一项重要任务。请按要求完成下列问题:
I.从海水提取的粗盐中除了含有泥沙之外,还含有 、
、 、
、 等杂质,由粗盐获得精盐的一般步骤如下图:
等杂质,由粗盐获得精盐的一般步骤如下图:

(1)操作II的名称为___________ ,加入的试剂①、②分别是___________ 溶液、___________ 溶液(填化学式);
II.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:
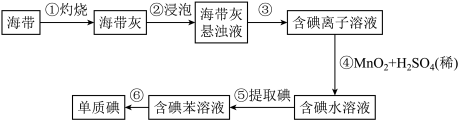
(2)步骤①中不会用到下列仪器中的___________;
(3)步骤④发生的离子反应方程式为___________ ;
(4)检验提取碘后水溶液是否仍含有碘单质的方法___________ ;
(5)实验室常用碘量法测定溶液中 的含量。取
的含量。取 样品,加入
样品,加入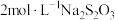 溶液,发生反应
溶液,发生反应 ,充分反应后,消耗
,充分反应后,消耗 溶液
溶液 。则该样品中
。则该样品中 的含量是
的含量是___________ 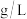 。
。
I.从海水提取的粗盐中除了含有泥沙之外,还含有
 、
、 、
、 等杂质,由粗盐获得精盐的一般步骤如下图:
等杂质,由粗盐获得精盐的一般步骤如下图:
(1)操作II的名称为
II.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:

(2)步骤①中不会用到下列仪器中的___________;
| A.酒精灯 | B.漏斗 | C.坩埚 | D.泥三角 |
(4)检验提取碘后水溶液是否仍含有碘单质的方法
(5)实验室常用碘量法测定溶液中
 的含量。取
的含量。取 样品,加入
样品,加入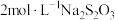 溶液,发生反应
溶液,发生反应 ,充分反应后,消耗
,充分反应后,消耗 溶液
溶液 。则该样品中
。则该样品中 的含量是
的含量是 。
。
您最近一年使用:0次
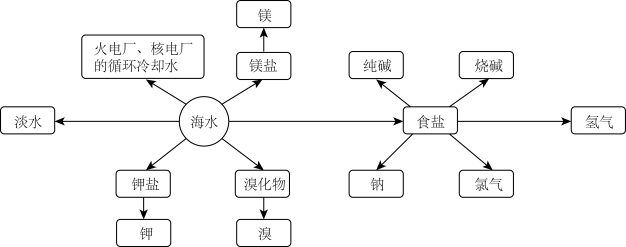
9 . 海洋资源的利用具有非常广阔的前景。
回答下列问题:
Ⅰ.海水制盐
(1)粗盐中可溶性杂质离子包含 、
、 、
、 ,要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________(填字母)。
,要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________(填字母)。
①NaOH溶液 ② 溶液 ③
溶液 ③ 溶液 ④盐酸
溶液 ④盐酸
Ⅱ.海水提溴
(2)工业上常用“吹出法”提溴,请写出用 吸收
吸收 的离子反应方程式
的离子反应方程式___________ 。
(3)含 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是___________ 。
Ⅲ.从海带中提取碘的实验过程如下图所示:
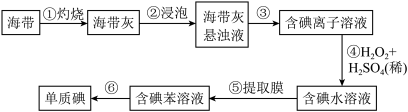
(4)步骤①中灼烧海带时,应将海带放入___________中灼烧。
(5)请写出步骤④反应的离子方程式___________ 。
Ⅳ.海水淡化
(6)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是___________ 。

回答下列问题:
Ⅰ.海水制盐
(1)粗盐中可溶性杂质离子包含
 、
、 、
、 ,要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________(填字母)。
,要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________(填字母)。①NaOH溶液 ②
 溶液 ③
溶液 ③ 溶液 ④盐酸
溶液 ④盐酸| A.①③②④ | B.②①③④ | C.②③①④ | D.③①②④ |
Ⅱ.海水提溴
(2)工业上常用“吹出法”提溴,请写出用
 吸收
吸收 的离子反应方程式
的离子反应方程式(3)含
 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是Ⅲ.从海带中提取碘的实验过程如下图所示:

(4)步骤①中灼烧海带时,应将海带放入___________中灼烧。
A. | B. | C. | D. |
Ⅳ.海水淡化
(6)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是
您最近一年使用:0次
名校
解题方法
10 . 浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:
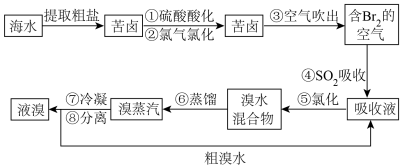
(1)用热空气能将溴单质吹出的原因是___________ 。
(2)写出④发生反应的化学方程式___________ 。
(3)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的___________ 。
Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
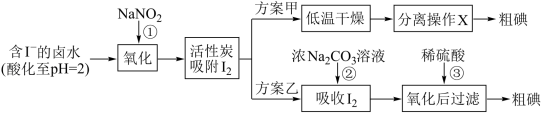
资料显示:
ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NO
ⅱ.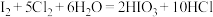 ;氧化性:
;氧化性: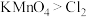
ⅲ.
(4)请列举除蒸馏法外海水淡化的一种方法:___________ 。
(5)写出反应①的离子方程式___________ 。
(6)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 、冷凝结晶。
(7) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
a.将滤液用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,___________ 。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:

(1)用热空气能将溴单质吹出的原因是
(2)写出④发生反应的化学方程式
(3)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NOⅱ.
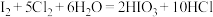 ;氧化性:
;氧化性: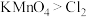
ⅲ.

(4)请列举除蒸馏法外海水淡化的一种方法:
(5)写出反应①的离子方程式
(6)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(7)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。实验中可供选择的试剂:稀
 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。a.将滤液用
 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,b.从水层取少量溶液于试管中,
您最近一年使用:0次
2023-05-25更新
|
368次组卷
|
2卷引用:江西省宜春市上高中学2022-2023学年高一下学期7月期末考试化学试题



