名校
解题方法
1 . 浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:
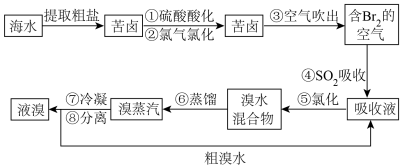
(1)用热空气能将溴单质吹出的原因是___________ 。
(2)写出④发生反应的化学方程式___________ 。
(3)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的___________ 。
Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
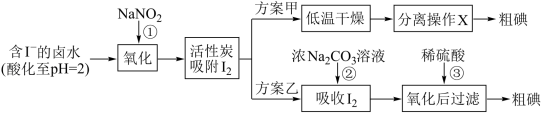
资料显示:
ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NO
ⅱ.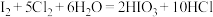 ;氧化性:
;氧化性: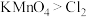
ⅲ.
(4)请列举除蒸馏法外海水淡化的一种方法:___________ 。
(5)写出反应①的离子方程式___________ 。
(6)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 、冷凝结晶。
(7) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
a.将滤液用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,___________ 。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:

(1)用热空气能将溴单质吹出的原因是
(2)写出④发生反应的化学方程式
(3)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NOⅱ.
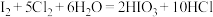 ;氧化性:
;氧化性: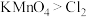
ⅲ.

(4)请列举除蒸馏法外海水淡化的一种方法:
(5)写出反应①的离子方程式
(6)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(7)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。实验中可供选择的试剂:稀
 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。a.将滤液用
 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,b.从水层取少量溶液于试管中,
您最近半年使用:0次
2023-05-25更新
|
336次组卷
|
2卷引用:天津市第一中学2022—2023学年高一下学期第二次月考化学试题
解题方法
2 . 我国资源丰富,合理开发利用资源,才能实现可持续发展。
Ⅰ.以原油为原科生产有机高分子材料聚乙烯、聚丙烯的流程如下:

(1)流程中②表示的加工方法是____(填序号)。
(2)写出聚乙烯的结构简式_______ 。
Ⅱ.浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
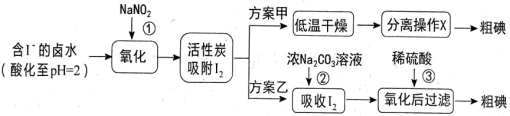
资料显示:
ⅰ. pH=2 时, NaNO2溶液只能将I-氧化为I2,同时生成 NO
ⅱ. I2+5Cl2+6H2O=2HIO3+10HCl; 氧化性:KMnO4>Cl2
ⅲ. 2Fe3++2I-=2Fe2++I2
(3)写出反应①的离子方程式_______ 。
(4)方案甲中,根据 I2的特性,分离操作 X 应为___________ 、冷凝结晶。
(5)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是_______ 。
(6)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 为了检验滤液中的 I-,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、CCl4。
a.将滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,_______ 。
Ⅰ.以原油为原科生产有机高分子材料聚乙烯、聚丙烯的流程如下:

(1)流程中②表示的加工方法是____(填序号)。
| A.分馏 | B.聚合 | C.裂解 | D.干馏 |
Ⅱ.浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ. pH=2 时, NaNO2溶液只能将I-氧化为I2,同时生成 NO
ⅱ. I2+5Cl2+6H2O=2HIO3+10HCl; 氧化性:KMnO4>Cl2
ⅲ. 2Fe3++2I-=2Fe2++I2
(3)写出反应①的离子方程式
(4)方案甲中,根据 I2的特性,分离操作 X 应为
(5)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是
(6)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 为了检验滤液中的 I-,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、CCl4。
a.将滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,
您最近半年使用:0次
3 . 海带中含有丰富的碘元素,某化学兴趣小组设计如下所示的流程图提取碘:
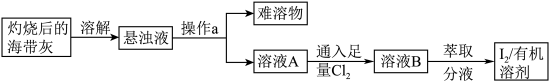
请回答下列问题:
(1)加水溶解海带灰,应采用的装置是_______ (填字母序号)
A.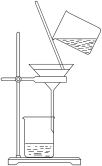 B.
B. C.
C.
(2)操作a的名称是_______ (填“过滤”或“蒸发”);
(3)溶液A中通入足量 发生的反应为:
发生的反应为: ,反应物
,反应物 表现
表现_______ (填“氧化性”或“还原性”);
(4)工业上合成氨的反应为: 。一定条件下,将2 mol
。一定条件下,将2 mol  和6 mol
和6 mol  置于1 L的密闭容器中,10 min后测得
置于1 L的密闭容器中,10 min后测得 为0.4 mol。
为0.4 mol。
①用 的浓度变化表示该反应0~10 min的平均速率为
的浓度变化表示该反应0~10 min的平均速率为_______ mol/(L·min);
②其他条件不变时,压缩容器体积,增大压强,该反应的速率将_______ (填“增大”或“减小”)。

请回答下列问题:
(1)加水溶解海带灰,应采用的装置是
A.
 B.
B. C.
C.
(2)操作a的名称是
(3)溶液A中通入足量
 发生的反应为:
发生的反应为: ,反应物
,反应物 表现
表现(4)工业上合成氨的反应为:
 。一定条件下,将2 mol
。一定条件下,将2 mol  和6 mol
和6 mol  置于1 L的密闭容器中,10 min后测得
置于1 L的密闭容器中,10 min后测得 为0.4 mol。
为0.4 mol。①用
 的浓度变化表示该反应0~10 min的平均速率为
的浓度变化表示该反应0~10 min的平均速率为②其他条件不变时,压缩容器体积,增大压强,该反应的速率将
您最近半年使用:0次
名校
解题方法
4 . 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
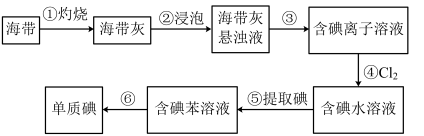
请填写下列空白:
(1)步骤③⑥的实验操作名称分别是_______ 和_______ 。步骤④反应的离子方程式是_______ 。除了氯水,从绿色化学角度考虑,最合适的试剂为_______ 。
A.浓硫酸 B.浓硝酸 C.KMnO4溶液 D.H2O2
(2)步骤⑤中,某学生选择用苯来提取碘的理由有:碘与苯不反应;苯与水不互溶:还有_______ 。从含碘水溶液中获得含碘苯溶液,该操作名称为_______ ,用到最主要仪器为_______ ,不能用酒精代替苯的理由是:_______
(3)向一容积为15 mL的试管中先加入3 mL碘水,再加入1 mL苯,充分振荡、静置后,下列图示现象正确的是_______

关于卤素氯、溴、碘的叙述,错误的是_______
a.单质易溶于有机溶剂中 b. X-的颜色逐渐加深
c.单质氧化性性逐渐减弱 d.X-的还原性逐渐增强

请填写下列空白:
(1)步骤③⑥的实验操作名称分别是
A.浓硫酸 B.浓硝酸 C.KMnO4溶液 D.H2O2
(2)步骤⑤中,某学生选择用苯来提取碘的理由有:碘与苯不反应;苯与水不互溶:还有
(3)向一容积为15 mL的试管中先加入3 mL碘水,再加入1 mL苯,充分振荡、静置后,下列图示现象正确的是

关于卤素氯、溴、碘的叙述,错误的是
a.单质易溶于有机溶剂中 b. X-的颜色逐渐加深
c.单质氧化性性逐渐减弱 d.X-的还原性逐渐增强
您最近半年使用:0次
名校
5 . Ⅰ.海带中含有丰富的碘,某学习小组设计并进行以下实验:
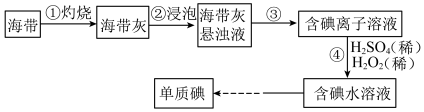
(1)步骤③的实验操作为___________ (填实验名称),此过程使用玻璃棒,玻璃棒的作用是___________ 。
(2)步骤④的离子反应方程式为: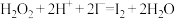 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是___________ ,还原剂是___________ 。步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现蓝色,说明有碘单质产生。
Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失, 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。
(3)写出潮湿环境下 与氧气反应的化学方程式:
与氧气反应的化学方程式:___________ 。
Ⅲ.现在的食盐里改添加性质稳定的 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
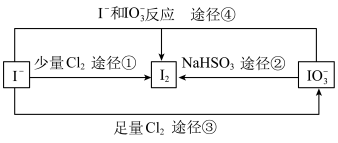
(4)四个途径中属于氧化还原反应的是___________ (填序号)。
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(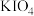 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(6)比较 、
、 和
和 的氧化性强弱:
的氧化性强弱:___________ 。

(1)步骤③的实验操作为
(2)步骤④的离子反应方程式为:
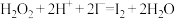 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,
 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。(3)写出潮湿环境下
 与氧气反应的化学方程式:
与氧气反应的化学方程式:Ⅲ.现在的食盐里改添加性质稳定的
 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
(4)四个途径中属于氧化还原反应的是
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(
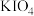 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:(6)比较
 、
、 和
和 的氧化性强弱:
的氧化性强弱:
您最近半年使用:0次
6 . 某学习小组做了如下实验探究海带中碘元素的存在形式,探究过程如图:
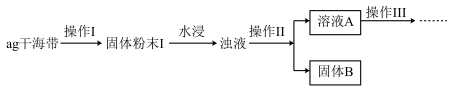
(1)操作I为灼烧,则灼烧时应该用___ (仪器名称)盛装海带,操作II为___ ;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是___ 。
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO 形式存在②以I-形式存在
形式存在②以I-形式存在
查阅资料:IO 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO 的还原产物为Mn2+,写出离子方程式
的还原产物为Mn2+,写出离子方程式___ 。

(1)操作I为灼烧,则灼烧时应该用
(2)水浸时通常要将悬浊液煮沸2-3min,目的是
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO
 形式存在②以I-形式存在
形式存在②以I-形式存在查阅资料:IO
 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再 用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入FeC12溶液,然后加入2滴KSCN溶液并振荡; | 证明不是以IO 形式存在 形式存在 | |
| ③ | 往试管II中加入 | 证明以I-形式存在 |
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO
 的还原产物为Mn2+,写出离子方程式
的还原产物为Mn2+,写出离子方程式
您最近半年使用:0次
名校
解题方法
7 . 碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海草(如海带)、海水和盐矿中。某小组同学设计如下实验流程模拟从海草中提取碘。
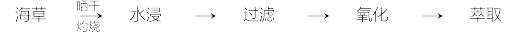
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有_____ (填标号字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
①实验Ⅰ中溶液变为浅黄色所发生反应的离子方程式是:_________________ 。
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因:__________ (用离子方程式表示)。
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是___________ ,实验现象是______________ 。

③小组同学又设计了如下实验:
(a)分析实验Ⅳ、Ⅴ和Ⅵ,得出影响氧气氧化 KI 溶液的反应速率的因素有 ____ 、_____ 。
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因_____________ 。
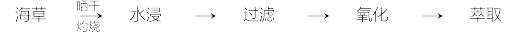
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
| 序号 | 实验 | 操作 | 现象 |
| Ⅰ |  | 先加 0.5 mL 0.5 mol/L NaClO 溶液,后滴几滴淀粉溶液 | 溶液先变为浅黄色后溶液变蓝 |
| Ⅱ |  | 先加 0.5 mL 0.5 mol/L KI 溶液后滴几滴淀粉溶液 | 先溶液保持无色后溶液也不变蓝,且 pH=10 |
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因:
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是

③小组同学又设计了如下实验:
| 序号 | 实验 | 操作 | 现象 |
| Ⅳ |  | 敞口试管 | 2 小时后滴加淀粉溶液才出现蓝色 |
| Ⅴ | 敞口试管 水浴 70℃ | 20 min 溶液保持无色,冷却至室温后滴加淀粉溶液出现蓝色 | |
| Ⅵ | 密闭试管 水浴 70℃ | 溶液迅速出现黄色,且黄色逐渐加,冷却至室温后滴加淀粉溶液出现蓝色 |
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因
您最近半年使用:0次
8 . 海洋资源的利用具有非常广阔的前景。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为_______ 。
(2)热空气吹出Br2,利用了溴的_______。
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为_______ 。
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
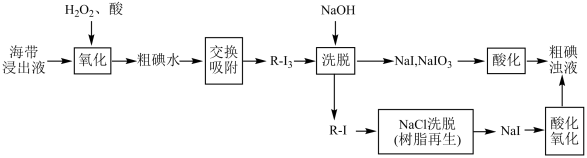
已知:①I2+I- I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I )有很强的交换吸附能力。
)有很强的交换吸附能力。
③步骤“交换吸附”发生的反应:R-Cl+I =R-I3+Cl-。
=R-I3+Cl-。
试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①_______ ;
②I2+I- I
I 。
。
依据整个生产流程分析是否可以加过量H2O2;_______ (填“是”或“否”)。并说明理由:_______ 。
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于_______ 。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为
(2)热空气吹出Br2,利用了溴的_______。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2+I-
 I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I
 )有很强的交换吸附能力。
)有很强的交换吸附能力。③步骤“交换吸附”发生的反应:R-Cl+I
 =R-I3+Cl-。
=R-I3+Cl-。试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
| A.交换吸附 | B.洗脱 | C.酸化 | D.NaCl洗脱 |
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①
②I2+I-
 I
I 。
。依据整个生产流程分析是否可以加过量H2O2;
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于
您最近半年使用:0次
2022-04-24更新
|
1118次组卷
|
4卷引用:福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题
福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题(已下线)8.1.1 金属矿物和海水资源的开发利用-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省广州市第六中学2021-2022学年高一下学期综合考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期开学验收考试化学试题
名校
解题方法
9 . 碘是人体的必需微量元素之一,海带提取碘的部分实验流程如下:
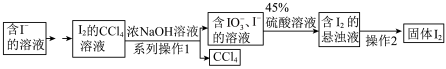
(1)由海带得到含 的溶液,所用的陶瓷仪器为
的溶液,所用的陶瓷仪器为___________ ;系列操作1中需用到的玻璃仪器有烧杯、玻璃棒和___________ ;操作2的实验方法是___________ 。
(2)某实验小组研究 与
与 的反应,将
的反应,将 进入KI溶液中,出现黄色。查阅资料表明。发生了以下反应:
进入KI溶液中,出现黄色。查阅资料表明。发生了以下反应: 。设计实验探究该反应的影响因素。
。设计实验探究该反应的影响因素。
已知:i. 可以溶于KI溶液,溶解后溶液显黄色。
可以溶于KI溶液,溶解后溶液显黄色。
ii. 对该反应无影响。
对该反应无影响。
①在表格中将实验1和2加入蒸馏水的体积补充完整_____ 、______ (用表中字母或字母的表达式作答)。
②实验_______ 和_______ 探究溶液酸碱性对实验的影响;实验3的结果表明提高 浓度对反应有促进作用,相应的实验现象为
浓度对反应有促进作用,相应的实验现象为_______ 。
③添加药品的合理顺序为: 水溶液、
水溶液、_______ 、稀盐酸、_______ (填“KI溶液”或“蒸馏水”)。
④往三组实验中滴加淀粉溶液,均没有出现蓝色,你认为原因是___________ (用化学方程式解释)。检验该反应发生的实验操作和现象是___________ 。

(1)由海带得到含
 的溶液,所用的陶瓷仪器为
的溶液,所用的陶瓷仪器为(2)某实验小组研究
 与
与 的反应,将
的反应,将 进入KI溶液中,出现黄色。查阅资料表明。发生了以下反应:
进入KI溶液中,出现黄色。查阅资料表明。发生了以下反应: 。设计实验探究该反应的影响因素。
。设计实验探究该反应的影响因素。已知:i.
 可以溶于KI溶液,溶解后溶液显黄色。
可以溶于KI溶液,溶解后溶液显黄色。ii.
 对该反应无影响。
对该反应无影响。| 实验序号 |  水溶液(mL) 水溶液(mL) | 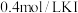 溶液(mL) 溶液(mL) | 稀盐酸(mL) | 蒸馏水(mL) | 实验现象 |
| 1 | a(过量) | b | 0 | ____ | 溶液逐渐变为浅黄色 |
| 2 | a(过量) | b | c | ____ | 溶液变黄且有浑浊 |
| 3 | a(过量) | 2b | c | 0 | _________ |
②实验
 浓度对反应有促进作用,相应的实验现象为
浓度对反应有促进作用,相应的实验现象为③添加药品的合理顺序为:
 水溶液、
水溶液、④往三组实验中滴加淀粉溶液,均没有出现蓝色,你认为原因是
您最近半年使用:0次
名校
10 . 化学兴趣小组在实验室进行“海带提碘”的实验过程如图:

(1)操作①的名称是_____ ,操作②的主要仪器是_____ ;氧化步骤的离子方程式是_____ 。
(2)探究异常:取样检验时,部分同学没有观察到溶液变蓝色。他们假设原因可能是加入的氯水过量,氧化了①I2;②淀粉;③I2和淀粉。他们在没有变蓝色的溶液中,滴加_____ (选填“四氯化碳”“碘水”“淀粉溶液”)后,若出现_____ 现象,即可证明假设①正确,同时排除假设②③.能同时排除假设②③的原因是_____ 。
(3)查阅资料:Cl2 可氧化 I2,反应的化学方程式为_____ Cl2+_____ I2+_____ H2O→_____ HIO3+_____ HCl.配平上述方程式,并标出电子转移的方向和数目_______ 。
(4)探究氧化性:在盛有 FeCl3 溶液的试管中,滴入几滴 KI 溶液,将反应后的溶液均匀倒入两支试管,试管 a 中加入 1 mL 苯振荡静置,出现______ (填实验现象),证明有 I2存在;试管b 中滴入 KSCN 溶液,溶液显血红色,证明有_____ 存在。
(5)比较氧化性:综合上述实验,可以得出的结论是氧化性:Cl2>FeCl3,理由是_____ 。

(1)操作①的名称是
(2)探究异常:取样检验时,部分同学没有观察到溶液变蓝色。他们假设原因可能是加入的氯水过量,氧化了①I2;②淀粉;③I2和淀粉。他们在没有变蓝色的溶液中,滴加
(3)查阅资料:Cl2 可氧化 I2,反应的化学方程式为
(4)探究氧化性:在盛有 FeCl3 溶液的试管中,滴入几滴 KI 溶液,将反应后的溶液均匀倒入两支试管,试管 a 中加入 1 mL 苯振荡静置,出现
(5)比较氧化性:综合上述实验,可以得出的结论是氧化性:Cl2>FeCl3,理由是
您最近半年使用:0次



