名校
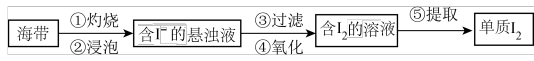
1 . 海带中含有碘元素,从海带中提取碘的实验过程如下图:
(2)步骤④选用的试剂为氯水,则该反应的离子方程式为_____ ;检验该步骤中有I2生成的方法是_____ 。
(3)步骤⑤包含以下四个过程:
_____ (填“能”或“不能”)用乙醇代替。
②过程Ⅱ中 与浓
与浓 溶液反应的离子方程式为
溶液反应的离子方程式为_____ 。
③过程Ⅲ中化合价发生变化的元素为_____ (填元素符号)。
④过程Ⅳ的操作名称为_____ 。
| A.泥三角 | B.漏斗 | C.坩埚 | D.酒精灯 |
(2)步骤④选用的试剂为氯水,则该反应的离子方程式为
(3)步骤⑤包含以下四个过程:


②过程Ⅱ中
 与浓
与浓 溶液反应的离子方程式为
溶液反应的离子方程式为③过程Ⅲ中化合价发生变化的元素为
④过程Ⅳ的操作名称为
您最近一年使用:0次
名校
解题方法
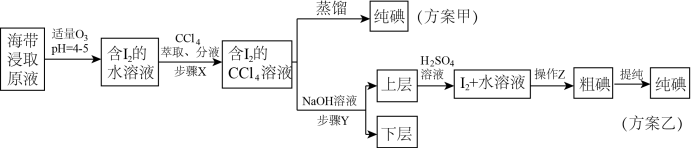
2 . 某学习小组按如下实验流程从海带中提取碘单质。 的沸点高于
的沸点高于 ,根据以上流程,判断下列说法错误的是
,根据以上流程,判断下列说法错误的是
 的沸点高于
的沸点高于 ,根据以上流程,判断下列说法错误的是
,根据以上流程,判断下列说法错误的是| A.“萃取、分液”时,获得下层溶液进行下一步操作 |
B.加入 溶液后发生反应的离子方程式为 溶液后发生反应的离子方程式为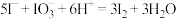 |
C.方案甲采用蒸馏法的缺点在于 易与 易与 一同被蒸出,分离效果差 一同被蒸出,分离效果差 |
| D.步骤Y应加入过量氢氧化钠溶液,确保反萃取充分,下层液体可循环利用 |
您最近一年使用:0次
2024-04-24更新
|
142次组卷
|
2卷引用:福建省南平市福建省武夷山第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
3 . 海洋资源的利用具有非常广阔的前景。
Ⅰ.从海水中提取溴的过程如下: ,步骤“吸收”中又将
,步骤“吸收”中又将 反应为
反应为 ,其目的是
,其目的是_______ 。
(2)热空气吹出 ,利用了溴的_______。
,利用了溴的_______。
(3)步骤“吸收”用纯碱溶液吸收Br₂,反应生成了 、NaBr、
、NaBr、 ,则该反应的化学方程式为
,则该反应的化学方程式为_______ 。
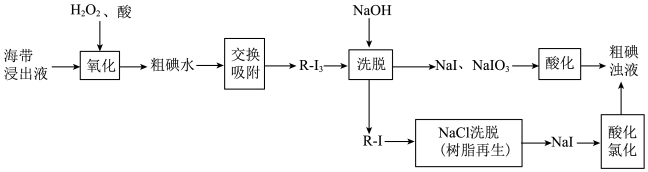
Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。 。
。
②强碱性阴离子树脂(用 表示,
表示, 可被其它更易被吸附的阴离子替代)对多碘离子(
可被其它更易被吸附的阴离子替代)对多碘离子( )有很强的交换吸附能力。
)有很强的交换吸附能力。
③步骤“交换吸附”发生的反应: 。
。
(4)下列各步反应中,属于氧化还原反应的有:_______。
(5)酸性条件下,原料被 氧化时发生的反应有:①
氧化时发生的反应有:①_______ (离子方程式);② 。依据整个生产流程分析是否可以加过量
。依据整个生产流程分析是否可以加过量 ,
,_______ (填“是”或“否”),并说明理由:_______ 。
Ⅰ.从海水中提取溴的过程如下:

 ,步骤“吸收”中又将
,步骤“吸收”中又将 反应为
反应为 ,其目的是
,其目的是(2)热空气吹出
 ,利用了溴的_______。
,利用了溴的_______。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(3)步骤“吸收”用纯碱溶液吸收Br₂,反应生成了
 、NaBr、
、NaBr、 ,则该反应的化学方程式为
,则该反应的化学方程式为Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
 。
。②强碱性阴离子树脂(用
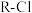 表示,
表示, 可被其它更易被吸附的阴离子替代)对多碘离子(
可被其它更易被吸附的阴离子替代)对多碘离子( )有很强的交换吸附能力。
)有很强的交换吸附能力。③步骤“交换吸附”发生的反应:
 。
。(4)下列各步反应中,属于氧化还原反应的有:_______。
| A.交换吸附 | B.洗脱 | C.酸化 | D.NaCl洗脱 |
(5)酸性条件下,原料被
 氧化时发生的反应有:①
氧化时发生的反应有:① 。依据整个生产流程分析是否可以加过量
。依据整个生产流程分析是否可以加过量 ,
,
您最近一年使用:0次
2024-04-24更新
|
171次组卷
|
2卷引用:福建省南平市福建省武夷山第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
4 . 实验室从干海带中提取碘的流程如图所示.下列各操作所使用的装置正确的是
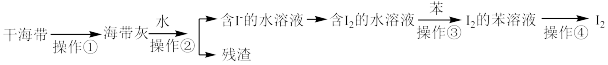
A.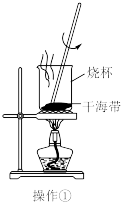 | B. | C. | D. |
您最近一年使用:0次
2024-03-17更新
|
198次组卷
|
2卷引用:广东省深圳市高级中学高中部2020-2021学年高一下学期期中考试化学试卷
名校
5 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
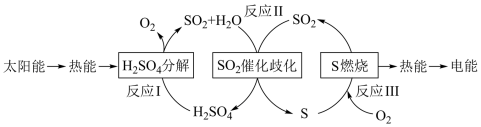
(1)已知反应 I:2H2SO4(l) 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
反应 III:S(s) + O2 (g) SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol
所以反应 II 的热化学方程式为___________ 。
(2)试从绿色化学的角度列举该过程的优势与不足:___________ 。
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 = + 4H+ + 2I-
+ 4H+ + 2I-
某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
(3)第 2 组是第 1 组实验的对比组,则 a=___________ 。
(4)通过比较第 1、2、3 组实验,可得出的结论是___________ 。
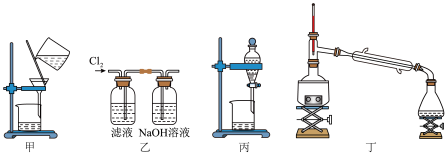
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

(1)已知反应 I:2H2SO4(l)
 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol反应 III:S(s) + O2 (g)
 SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol所以反应 II 的热化学方程式为
(2)试从绿色化学的角度列举该过程的优势与不足:
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 =
 + 4H+ + 2I-
+ 4H+ + 2I-某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
| 序号 | 1 | 2 | 3 | 4 |
| 试剂组成 | 0.4 mol/L KI | amol/L KI、0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 、0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较组 1 快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较组 1 快 |
(3)第 2 组是第 1 组实验的对比组,则 a=
(4)通过比较第 1、2、3 组实验,可得出的结论是
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

| A.图甲是过滤海带浸泡液 | B.图乙是向浸泡液中通入 Cl2 氧化 |
| C.图丙是含 I2 的 CCl4 溶液从下口放出 | D.图丁是提取 I2 的同时回收溶剂 |
您最近一年使用:0次
6 . 围绕海水的综合利用,化学课外兴趣小组进行下列研究。

(1)应用电渗析法制得 的同时可进行海水淡化,是解决淡水资源匮乏的有效途径之一,该方法是利用电解原理通过多组电渗析膜实现,工作原理如图所示,以NaCl溶液代替海水,其中p膜只允许阴离子透过,s膜只允许阳离子透过。直流电源a极为
的同时可进行海水淡化,是解决淡水资源匮乏的有效途径之一,该方法是利用电解原理通过多组电渗析膜实现,工作原理如图所示,以NaCl溶液代替海水,其中p膜只允许阴离子透过,s膜只允许阳离子透过。直流电源a极为___________ (选填“正极”或“负极”),接收淡水的出口是___________ (用字母A、B、C作答),电解总反应方程式为___________ 。
(2)模拟反萃取法提取碘实验流程如下图:
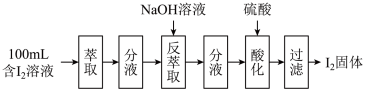
① NaOH的pH=
NaOH的pH=___________ ,由水电离产生的 浓度为
浓度为___________ 。
②“反萃取”操作时溶液中有 、
、 生成。“酸化”步骤发生反应生成碘单质,该反应离子方程式为
生成。“酸化”步骤发生反应生成碘单质,该反应离子方程式为___________ 。

(1)应用电渗析法制得
 的同时可进行海水淡化,是解决淡水资源匮乏的有效途径之一,该方法是利用电解原理通过多组电渗析膜实现,工作原理如图所示,以NaCl溶液代替海水,其中p膜只允许阴离子透过,s膜只允许阳离子透过。直流电源a极为
的同时可进行海水淡化,是解决淡水资源匮乏的有效途径之一,该方法是利用电解原理通过多组电渗析膜实现,工作原理如图所示,以NaCl溶液代替海水,其中p膜只允许阴离子透过,s膜只允许阳离子透过。直流电源a极为(2)模拟反萃取法提取碘实验流程如下图:

①
 NaOH的pH=
NaOH的pH= 浓度为
浓度为②“反萃取”操作时溶液中有
 、
、 生成。“酸化”步骤发生反应生成碘单质,该反应离子方程式为
生成。“酸化”步骤发生反应生成碘单质,该反应离子方程式为
您最近一年使用:0次
7 . 反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:①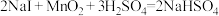
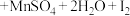 ;②
;② 。下列说法正确的是
。下列说法正确的是
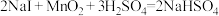
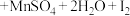 ;②
;② 。下列说法正确的是
。下列说法正确的是| A.两个反应中硫元素均被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
C.氧化性: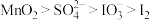 |
D.酸性条件下,I-和 有可能反应生成I2 有可能反应生成I2 |
您最近一年使用:0次
名校
8 . 海带提碘过程中以 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。

下列说法错误的是
 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。
下列说法错误的是
| A.反应1的目的为将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中 |
| B.操作1需要用到的玻璃仪器有普通漏斗、烧杯和玻璃棒 |
C.反应2的离子方程式为 |
| D.操作2的名称为过滤 |
您最近一年使用:0次
2023-08-21更新
|
226次组卷
|
2卷引用:河南省郑州市十校2022-2023学年高一下学期期中联考化学试题
解题方法
9 . 海洋中蕴藏着各种油气及矿物资源,海洋的开发利用潜力巨大。下列关于实验室从海带中提取碘的过程说法正确的是
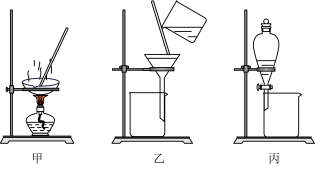

| A.用装置甲灼烧海带成海带灰 |
| B.用装置乙可以过滤海带灰悬浊液 |
| C.用装置甲直接加热含I2溶液可以得到I2 |
| D.装置丙使用时先放出下层液体,接着从下口放出上层液体 |
您最近一年使用:0次
名校
10 . 海洋资源的利用具有非常广阔的前景。
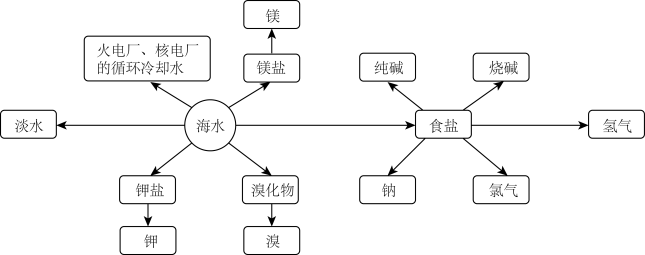
回答下列问题:
Ⅰ.海水制盐
(1)精盐水可用于氯碱工业,请写出氯碱工业总反应的离子方程式___________ 。
Ⅱ.海水提溴
(2)工业上常用“吹出法”提溴,请写出用 吸收
吸收 的化学反应方程式
的化学反应方程式___________ 。
(3)含 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是___________ 。
Ⅲ.从海带中提取碘的实验过程如下图所示:
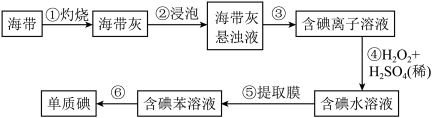
(4)步骤①中灼烧海带时,应将海带放入___________ (填仪器名称)中灼烧。
(5)请写出步骤④反应的离子方程式___________ 。
Ⅳ.海水淡化
(6)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是___________ 。

回答下列问题:
Ⅰ.海水制盐
(1)精盐水可用于氯碱工业,请写出氯碱工业总反应的离子方程式
Ⅱ.海水提溴
(2)工业上常用“吹出法”提溴,请写出用
 吸收
吸收 的化学反应方程式
的化学反应方程式(3)含
 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是Ⅲ.从海带中提取碘的实验过程如下图所示:

(4)步骤①中灼烧海带时,应将海带放入
(5)请写出步骤④反应的离子方程式
Ⅳ.海水淡化
(6)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是
您最近一年使用:0次



