1 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
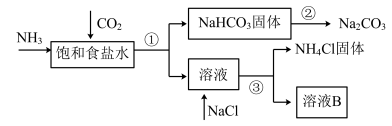
(1)根据上图,将化学方程式补充完整:________
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(2)过程①对应的分离操作名称是___________ 。
(3)下列说法中,正确的是___________ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、 、Cl-
、Cl-

(1)根据上图,将化学方程式补充完整:
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(2)过程①对应的分离操作名称是
(3)下列说法中,正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、
 、Cl-
、Cl-
您最近一年使用:0次
名校
2 . 我国化学家侯德榜发明的侯氏制碱法对世界制碱工业作出巨大贡献。侯氏制碱法的主要过程如图所示(部分物质已略去)。下列说法不正确的是


A.向饱和食盐水中先通 再通 再通 | B.①③所涉及的操作方法均为过滤 |
C.步骤②产生的 能循环使用 能循环使用 | D.相同温度下,溶液A、B中离子种类相同,且pH相同 |
您最近一年使用:0次
名校
3 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如下(部分物质已略去):
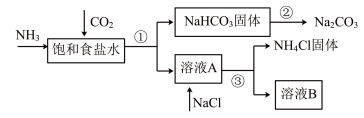
(1)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)根据上述流程图,将化学方程式补充完整:________
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(3)煅烧NaHCO3固体的化学方程式是___________ 。
(4)下列联合制碱法流程说法正确的是___________ (填字母)。
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH 、Cl-
、Cl-
d.①中NaHCO3析出是因为一定条件下NaHCO3的溶解度最小
(5)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为___________ 。(列出表达式即可)

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上述流程图,将化学方程式补充完整:
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(3)煅烧NaHCO3固体的化学方程式是
(4)下列联合制碱法流程说法正确的是
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH
 、Cl-
、Cl-d.①中NaHCO3析出是因为一定条件下NaHCO3的溶解度最小
(5)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献.下图为联合制碱法的主要过程(部分物质已略去).下列说法不正确的是


A.沉淀池中有 析出,因为一定条件下 析出,因为一定条件下 的溶解度最小 的溶解度最小 |
B.滤液中主要含有 、 、 和 和 |
| C.设计循环的目的是提高原料的利用率 |
D.某纯碱样品中含杂质 ,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中 ,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中 的质量分数为106(b-a)/a 的质量分数为106(b-a)/a |
您最近一年使用:0次
5 . 我国化学家侯德榜发明了联合制碱法。对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。

(1)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)根据上图,将化学方程式补充完整:________ 。NH3+CO2+___+___=NaHCO3↓+NH4Cl
(3)煅烧NaHCO3固体的化学方程式是___________ 。
(4)下列说法中正确的是___________ (填字母)。
a.CO2可循环使用 b.溶液B中一定含有Na+、 、Cl-
、Cl-

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整:
(3)煅烧NaHCO3固体的化学方程式是
(4)下列说法中正确的是
a.CO2可循环使用 b.溶液B中一定含有Na+、
 、Cl-
、Cl-
您最近一年使用:0次
6 . 我国化学家侯德榜发明了联合制碱法(纯碱),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如下(部分物质已略去):

(1)① ③所涉及的操作方法中,包含过滤的是
③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)根据上述流程图,补充方程式:___________
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(3)下列联合制碱法流程说法正确的是___________ (填字母)。
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH 、Cl-
、Cl-
(4)上述制得纯碱样品可能还有的杂质是___________ 。
某同学测定上述纯碱样品的纯度:
方法一:取a克纯碱样品,向其中加入足量AgNO3溶液,将产生的沉淀经过滤、洗涤、干燥,称量,测得纯度为X。
方法二:取a克纯碱样品,向其中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称量,测得纯度为Y。
比较:X___________ Y(填“>”、“<”、“=”),结合离子方程式解释原因___________ 。

(1)①
 ③所涉及的操作方法中,包含过滤的是
③所涉及的操作方法中,包含过滤的是(2)根据上述流程图,补充方程式:
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(3)下列联合制碱法流程说法正确的是
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH
 、Cl-
、Cl-(4)上述制得纯碱样品可能还有的杂质是
某同学测定上述纯碱样品的纯度:
方法一:取a克纯碱样品,向其中加入足量AgNO3溶液,将产生的沉淀经过滤、洗涤、干燥,称量,测得纯度为X。
方法二:取a克纯碱样品,向其中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称量,测得纯度为Y。
比较:X
您最近一年使用:0次
名校
7 . 下列实验方案能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 制备 | 向饱和食盐水中通入 后,再通 后,再通 |
| B | 配制1 L 1.0 mol/L NaCl溶液 | 将58.5 g NaCl固体直接溶于1 L水中 |
| C | 鉴别 和 和 | 取样,加入澄清石灰水,若有白色沉淀生成,则为 |
| D | 检验NaOH中的阳离子 | 用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 1941年,我国科学家侯德榜结合地域条件改进索尔维制碱法,提出纯碱与铵肥(NH4Cl)的联合生产工艺,后被命名为“侯氏制碱法”。主要工艺流程如下图。下列说法正确的是
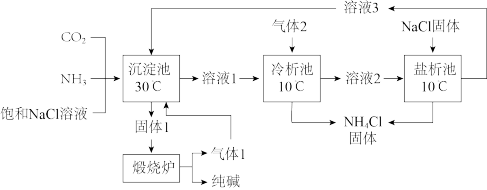
已知:侯氏制碱法总反应:
索尔维制碱法总反应: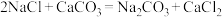 (CaCl2作为废液排放)
(CaCl2作为废液排放)

已知:侯氏制碱法总反应:

索尔维制碱法总反应:
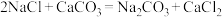 (CaCl2作为废液排放)
(CaCl2作为废液排放)| A.气体1、气体2均为CO2 |
B.溶液2中,含碳微粒主要是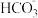 |
| C.侯氏制碱法和索尔维制碱法中原料NaCl的原子利用率相同 |
D.盐析池中加入NaCl,c(Cl-)增大,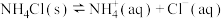 的平衡逆向移动,NH4Cl析出 的平衡逆向移动,NH4Cl析出 |
您最近一年使用:0次
2022-05-30更新
|
790次组卷
|
6卷引用:北京市海淀区中关村中学2022届高三下学期三模化学试题
北京市海淀区中关村中学2022届高三下学期三模化学试题(已下线)专题10 物质的反应及转化(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖南省永州市第一中学2022-2023学年高三下学期3月月考化学试题吉林省长春市第二中学2023-2024学年高三上学期10月月考化学试题福建省三明第一中学2023-2024学年高二上学期12月月考化学试题
解题方法
9 . “侯氏制碱法”是我国化学家侯德榜为世界制纯碱工业做出的突出贡献。某实验小组模拟制纯碱的工艺流程及实验装置(部分夹持装置省略)如图所示,下列叙述正确的是


| A.装置①中的试管中应盛放氯化铵固体 |
| B.装置②的球形干燥管中应盛放碱石灰 |
| C.装置②和装置③之间应该增加盛有饱和碳酸钠溶液的洗气瓶 |
| D.装置①可以用装置③代替,但不可用装置④代替 |
您最近一年使用:0次
2022-04-20更新
|
2508次组卷
|
11卷引用:化学-2022年高考考前押题密卷(北京卷)
(已下线)化学-2022年高考考前押题密卷(北京卷)甘肃省兰州市2022届高三一诊理综化学试题(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)(已下线)专题12化学实验方案的设计与评价-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题12化学实验方案的设计与评价-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题14物质的反应和转化-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题02 化学与STSE-备战2023年高考化学一轮复习考点微专题(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题广东省佛山市禅城区2022-2023学年高三统一调研测试(二) 化学试题超重点8 碳酸盐、草酸盐的创新考查
10 . 关注物质的宏观组成和微观构成,是研究物质性质及其转化的基本出发点。
(1)从物质分类看,Na2CO3和NaHCO3均属于_______ (选填序号),因此具有某些相似的化学性质。
a.氧化物 b. 酸 c. 碱 d. 盐
(2)探究Na2CO3和NaHCO3的相互转化。
【实验1】 加热碳酸氢钠固体,装置如下图所示。

①利用上述装置可实现NaHCO3向 Na2CO3发生转化,试管中发生反应的化学方程式为_______ 。
【实验2】 分别向滴有2滴酚酞的NaHCO3和Na2CO3溶液中滴加稀盐酸,实验记录如下:
②实验2-1中,反应的离子方程式是_______
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是_______ 。
④通过上述实验,从物质组成上分析Na2CO3转化为NaHCO3,加入盐酸的作用是_______ ;碳酸也可实现上述转化,写出将CO2通入Na2CO3溶液中发生反应的化学方程式:_______ 。
(3)探究NaCl转化为NaHCO3。
资料i:
资料ii:氨气(NH3)可与水发生反应,生成一水合氨(NH3∙H2O),一水合氨属于一种碱。
①向饱和NaCl溶液中通入足量CO2,无NaHCO3生成,原因是_______ 。
②向饱和NaCl溶液中先通入NH3,再通入CO2,在溶液中可析出NaHCO3晶体,该反应的化学方程式_______ ,通入NH3的作用是_______ 。
(1)从物质分类看,Na2CO3和NaHCO3均属于
a.氧化物 b. 酸 c. 碱 d. 盐
(2)探究Na2CO3和NaHCO3的相互转化。
【实验1】 加热碳酸氢钠固体,装置如下图所示。

①利用上述装置可实现NaHCO3向 Na2CO3发生转化,试管中发生反应的化学方程式为
【实验2】 分别向滴有2滴酚酞的NaHCO3和Na2CO3溶液中滴加稀盐酸,实验记录如下:
| 实验内容 | 实验现象 |
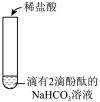 实验2-1 | 溶液浅红色褪去,立即产生大量气泡。 |
 实验2-2 | 开始时,溶液的红色没有明显变化,也没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量也逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。 |
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是
④通过上述实验,从物质组成上分析Na2CO3转化为NaHCO3,加入盐酸的作用是
(3)探究NaCl转化为NaHCO3。
资料i:
| 物质 | NaCl | NaHCO3 | NH4HCO3 | NH4Cl |
| 20℃时的溶解度(g/100gH 2O) | 36.0 | 9.6 | 21.7 | 37.2 |
资料ii:氨气(NH3)可与水发生反应,生成一水合氨(NH3∙H2O),一水合氨属于一种碱。
①向饱和NaCl溶液中通入足量CO2,无NaHCO3生成,原因是
②向饱和NaCl溶液中先通入NH3,再通入CO2,在溶液中可析出NaHCO3晶体,该反应的化学方程式
您最近一年使用:0次



