名校
1 . 海洋蕴藏着极为丰富的化学资源,如海水中有80多种元素,所含的盐大部分是氯化钠。十九世纪末工业上开始通过电解饱和食盐水的方法制备氯气、氢气和烧碱,并以它们为原料生产一系列含氯、含钠产品。回答下列问题:
(1)写出电解饱和食盐水的化学方程式:___________ 。
(2)工业上用氯气与石灰乳制成漂白粉,漂白粉的有效成分为___________ (填化学式)。
(3)1861年,比利时人索尔维利用氯化钠制取纯碱(被称为索尔维法),___________(填字母)改进了索尔维法,提出了联合制碱法。
(4)制取纯碱时,常伴随有NaHCO3生成。常温下,用如图1所示装置,分别向25mL0.3mol·L-1Na2CO3溶液和25mL0.3mol·L-1 NaHCO3溶液中逐滴滴加0.3mol·L-1的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。
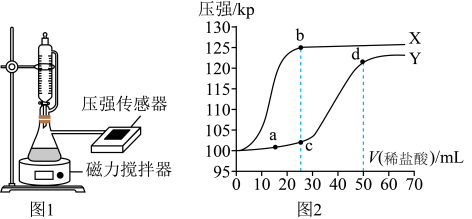
①表示向NaHCO3溶液中滴加盐酸的是曲线___________ (填“X”或“Y”)。
②写出ac段主要反应的实质:___________ (用离子方程式表示)。
③鉴别相同物质的量浓度的Na2CO3溶液和NaHCO3溶液,可使用的方法为___________ (任写一种)。
(5)向250mL1mol·L-1NaOH溶液中通入4.48L(标准状况下)CO2,此时溶液中的溶质为___________ (填化学式)。
(1)写出电解饱和食盐水的化学方程式:
(2)工业上用氯气与石灰乳制成漂白粉,漂白粉的有效成分为
(3)1861年,比利时人索尔维利用氯化钠制取纯碱(被称为索尔维法),___________(填字母)改进了索尔维法,提出了联合制碱法。
| A.侯德榜 | B.吴蕴初 | C.荣毅仁 | D.戴安邦 |
(4)制取纯碱时,常伴随有NaHCO3生成。常温下,用如图1所示装置,分别向25mL0.3mol·L-1Na2CO3溶液和25mL0.3mol·L-1 NaHCO3溶液中逐滴滴加0.3mol·L-1的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。

①表示向NaHCO3溶液中滴加盐酸的是曲线
②写出ac段主要反应的实质:
③鉴别相同物质的量浓度的Na2CO3溶液和NaHCO3溶液,可使用的方法为
(5)向250mL1mol·L-1NaOH溶液中通入4.48L(标准状况下)CO2,此时溶液中的溶质为
您最近一年使用:0次
2023-12-05更新
|
50次组卷
|
2卷引用:山西省朔州市怀仁市第一中学校2023-2024学年高一上学期12月期中理综试题
2 . 侯德榜为我国化工事业的发展做出了卓越贡献,是我国近代化学工业的奠基人之一,他结合中国国情对氨碱法进行改进,确定了新的工艺流程——侯氏制碱法:将氨碱法和合成氨法两种工艺联合起来,方法流程如图所示。
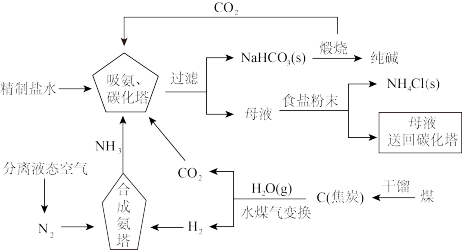
回答下列问题:
(1)向精制盐水中通入 、
、 的顺序及理由为
的顺序及理由为___________ (提示:从两种气体的溶解度进行分析)。
(2)写出 煅烧时发生反应的化学方程式:
煅烧时发生反应的化学方程式:___________ 。
(3)该流程中循环利用的物质为___________ 。
(4)侯氏制碱法除了制取得到纯碱,还生成了一种副产品___________ (填名称),可以用来___________ 。
(5)所得纯碱中可能含有少量 杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:
杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:
ⅰ.称取ag样品,溶于水中;
ⅱ.加入足量氯化钙溶液;
ⅲ.过滤、洗涤、干燥、称量,所得沉淀质量为bg。
①证明所加氯化钙溶液已经足量的方法是___________ 。
②该样品中碳酸钠的质量分数为___________ %(用含a、b的代数式表示)。

回答下列问题:
(1)向精制盐水中通入
 、
、 的顺序及理由为
的顺序及理由为(2)写出
 煅烧时发生反应的化学方程式:
煅烧时发生反应的化学方程式:(3)该流程中循环利用的物质为
(4)侯氏制碱法除了制取得到纯碱,还生成了一种副产品
(5)所得纯碱中可能含有少量
 杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:
杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:ⅰ.称取ag样品,溶于水中;
ⅱ.加入足量氯化钙溶液;
ⅲ.过滤、洗涤、干燥、称量,所得沉淀质量为bg。
①证明所加氯化钙溶液已经足量的方法是
②该样品中碳酸钠的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 下列所示装置正确且能完成相关实验的是
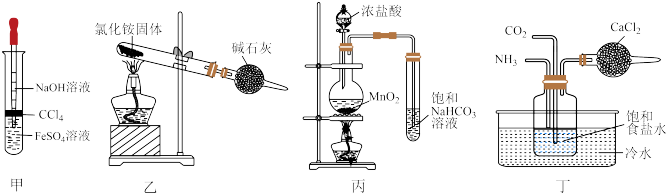

| A.用甲所示装置制Fe(OH)2 |
| B.用乙所示装置制氨气 |
| C.用丙所示装置制氯气并验证氯气与水反应有盐酸生成 |
| D.用丁所示装置模拟侯氏制碱法获得NaHCO3 |
您最近一年使用:0次
2023-09-10更新
|
320次组卷
|
2卷引用:山西省晋城市第一中学校2023-2024学年高三上学期10月月考化学试题
名校
解题方法
4 . 工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5,能溶于水,微溶于乙醇。受潮易分解,露置于空气中易氧化成硫酸钠)流程如下:

下列说法错误的是

下列说法错误的是
A.反应I为: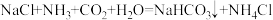 |
| B.Y溶液经处理后可用作氮肥 |
| C.流程中CO2可以循环利用 |
| D.反应Ⅲ发生了氧化还原反应 |
您最近一年使用:0次
2023-04-14更新
|
212次组卷
|
2卷引用:山西省大同市2022-2023学年高一下学期4月期中考试化学试题
名校
解题方法
5 . 下列说法正确的是
| A.侯氏制碱法中为获得更多产品应向饱和食盐水中先通足量CO2再通NH3 |
| B.等浓度的Na2CO3与NaHCO3溶液,后者碱性更强 |
| C.氯水久置后,溶液的氧化性减弱 |
| D.工业上将氯气通入石灰水中制取漂白粉 |
您最近一年使用:0次
2022-11-02更新
|
229次组卷
|
5卷引用:山西省大同市第一中学2022-2023学年高一下学期3月考试化学试题
6 . 某工厂以工业粗盐(含 、
、 、
、 等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥
等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥 ,其工艺流程如下图所示(部分物质已省略)。
,其工艺流程如下图所示(部分物质已省略)。

(1)工业粗盐溶解后,为将其中所含杂质全部沉淀,所用除杂试剂的顺序依次是___________ 。
(2)向饱和食盐水中通入 和
和 得到悬浊液,发生反应的化学方程式是
得到悬浊液,发生反应的化学方程式是___________ 。
(3)从下图可知,对溶液A进行的“系列操作”包括:蒸发浓缩、______ 和________ 。

(4)母液中所含阳离子主要有__ 。欲证明母液中仍然含有 ,进行的操作和现象是
,进行的操作和现象是____ 。
 、
、 、
、 等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥
等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥 ,其工艺流程如下图所示(部分物质已省略)。
,其工艺流程如下图所示(部分物质已省略)。
(1)工业粗盐溶解后,为将其中所含杂质全部沉淀,所用除杂试剂的顺序依次是
(2)向饱和食盐水中通入
 和
和 得到悬浊液,发生反应的化学方程式是
得到悬浊液,发生反应的化学方程式是(3)从下图可知,对溶液A进行的“系列操作”包括:蒸发浓缩、

(4)母液中所含阳离子主要有
 ,进行的操作和现象是
,进行的操作和现象是
您最近一年使用:0次
名校
解题方法
7 . I.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应I的化学方程式为_____________________________________________ 。
(2)反应II的化学方程式为________________ 。
II.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_________________________ ,说明装置不漏气。
(4)装置A中的试剂为_______________ ,装置C中的试剂为______________ 。
(5)实验结束后通入空气的目的:______________________________________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_________ (保留小数点后一位);若缺少E装置,会使测定结果____________ (填“偏高”或“偏低”)。

已知NaHCO3在低温下溶解度较小。
(1)反应I的化学方程式为
(2)反应II的化学方程式为
II.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(4)装置A中的试剂为
(5)实验结束后通入空气的目的:
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2021-11-26更新
|
568次组卷
|
3卷引用:山西省运城市2021-2022学年高一上学期11月期中检测化学试题
8 . 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼(
)、钼( )、镍(
)、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下:
)等元素的氧化物,一种回收利用工艺的部分流程如下: 的
的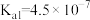 ,
, ;
;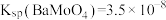 ;
;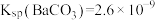 ;该工艺中,
;该工艺中,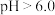 时,溶液中
时,溶液中 元素以
元素以 的形态存在。
的形态存在。
(1)“焙烧”中,有 生成,其中
生成,其中 元素的化合价为
元素的化合价为_______ 。
(2)“沉铝”中,生成的沉淀 为
为_______ 。
(3)“沉钼”中, 为7.0。
为7.0。
①生成 的离子方程式为
的离子方程式为_______ 。
②若条件控制不当, 也会沉淀。为避免
也会沉淀。为避免 中混入
中混入 沉淀,溶液中
沉淀,溶液中
_______ (列出算式)时,应停止加入 溶液。
溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有 和
和 ,
, 为
为_______ 。
②往滤液Ⅲ中添加适量 固体后,通入足量
固体后,通入足量_______ (填化学式)气体,再通入足量 ,可析出
,可析出 。
。
(5)高纯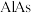 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止
(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层
刻蚀液与下层 (砷化镓)反应。
(砷化镓)反应。_______ 。
②已知: 和
和 同族,
同族, 和
和 同族。在
同族。在 与上层
与上层 的反应中,
的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为_______ 。
 )、钼(
)、钼( )、镍(
)、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下:
)等元素的氧化物,一种回收利用工艺的部分流程如下:
 的
的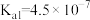 ,
, ;
;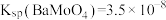 ;
;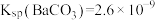 ;该工艺中,
;该工艺中,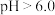 时,溶液中
时,溶液中 元素以
元素以 的形态存在。
的形态存在。(1)“焙烧”中,有
 生成,其中
生成,其中 元素的化合价为
元素的化合价为(2)“沉铝”中,生成的沉淀
 为
为(3)“沉钼”中,
 为7.0。
为7.0。①生成
 的离子方程式为
的离子方程式为②若条件控制不当,
 也会沉淀。为避免
也会沉淀。为避免 中混入
中混入 沉淀,溶液中
沉淀,溶液中
 溶液。
溶液。(4)①滤液Ⅲ中,主要存在的钠盐有
 和
和 ,
, 为
为②往滤液Ⅲ中添加适量
 固体后,通入足量
固体后,通入足量 ,可析出
,可析出 。
。(5)高纯
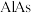 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止
(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层
刻蚀液与下层 (砷化镓)反应。
(砷化镓)反应。
②已知:
 和
和 同族,
同族, 和
和 同族。在
同族。在 与上层
与上层 的反应中,
的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
您最近一年使用:0次
2021-06-11更新
|
14271次组卷
|
27卷引用:山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题
山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题2021年新高考广东化学高考真题(已下线)微专题31 化学工艺流程题——原料的预处理-备战2022年高考化学考点微专题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题重庆市缙云教育联盟2021-2022学年高三9月月度质量检测化学试题2021年广东省高考化学试卷变式题11-21(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题16 热点金属及其化合物制备流程(Li、Sr、Pb、Zn、Ti、Mo)-备战2023年高考化学一轮复习考点微专题(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题内蒙古呼伦贝尔市海拉尔第二中学2022届高三第四次模拟考试理科综合化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)易错点08 金属材料-备战2023年高考化学考试易错题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 无机化工流程题的解题策略2024届黑龙江省齐齐哈尔市高三下学期联合考试模拟预测化学试题
名校
解题方法
9 . 实验室欲利用如图所示装置模拟“侯氏制碱法”制取纯碱(部分夹持装置省略),下列叙述正确的是
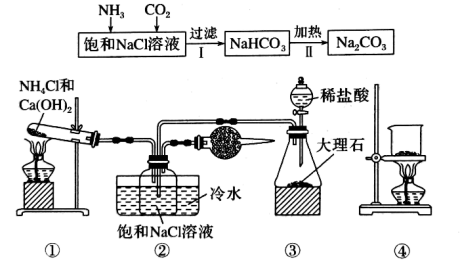

| A.实验时应先打开装置③中分液漏斗的旋塞,过一段时间后再点燃装置①的酒精灯 |
| B.装置②的干燥管中可盛放碱石灰,作用是吸收多余的NH3 |
| C.向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温可析出NH4Cl |
| D.用装置④可实现步骤Ⅱ转化,所得CO2可循环使用 |
您最近一年使用:0次
2021-05-13更新
|
196次组卷
|
7卷引用:山西省大同市2020届高三第一次联合考试(市直)化学试题
山西省大同市2020届高三第一次联合考试(市直)化学试题【全国百强校】安徽省六安市第一中学2020届高三下学期自测卷(三)线下考试化学试题河北省石家庄实验中学2019-2020学年高一3月月考化学试题山东省济钢高级中学2021届高三10月质量检测化学试题湖南省娄底市娄星区2020-2021学年高二下学期期中考试化学试题(已下线)易错专题14 侯氏制碱法生产纯碱-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)押江苏卷第11题 化学实验综合选择题 -备战2022年高考化学临考题号押题(江苏卷)
名校
10 . 下列实验装置能实现对应目的的是
A. 关闭a打开活塞b,通过观察水能否顺利流下来验证装置的气密性 关闭a打开活塞b,通过观察水能否顺利流下来验证装置的气密性 |
B. 实验室制备并收集氨气 实验室制备并收集氨气 |
C. c管先通 c管先通 ,d管再通过量 ,d管再通过量 ,可制取少量小苏打 ,可制取少量小苏打 |
D. 验证酸性强弱:盐酸>碳酸>硅酸 验证酸性强弱:盐酸>碳酸>硅酸 |
您最近一年使用:0次
2020-11-16更新
|
266次组卷
|
3卷引用:山西省吕梁市2021届高三上学期期中化学试题



