沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题3
上海
高二
单元测试
2019-10-31
271次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
 和
和 外,还有
外,还有 、
、 、
、 和
和 ,下列对该反应的分析不正确的是( )
,下列对该反应的分析不正确的是( )A.氧化剂为 和 和 |
| B.反应后溶液的pH降低 |
C.每转移2 mol电子消耗3 mol  |
D.被氧化的 只占总量的30% 只占总量的30% |
①
 ;
;②
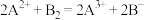 ;
;③
 ,
,根据上述反应,判断下列结论中正确的是
A.要除去含有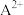 、 、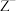 和 和 混合溶液中的 混合溶液中的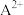 ,而不氧化 ,而不氧化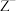 和 和 ,应加入 ,应加入 |
B.氧化性强弱顺序为: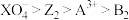 |
C. 是 是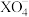 的氧化产物, 的氧化产物, 是B-的还原产物 是B-的还原产物 |
D.在溶液中不可能发生反应: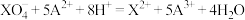 |
| A.无色溶液中:NH4+、Cu2+、CO32-、Cl- |
| B.中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3- |
| C.pH值为1的溶液:Na+、Al3+、CH3COO-、SO42- |
| D.由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br- |
【知识点】 离子共存 限定条件下的离子共存解读
| A.在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ |
| B.在含有Al3+、Cl﹣的溶液中:HCO3﹣、I﹣、NH4+、Mg2+ |
| C.在c(H+)=1×10﹣13 mol·L﹣1的溶液中:Na+、S2﹣、SO32﹣、NO3﹣ |
| D.在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl﹣ |
【知识点】 离子反应的发生条件解读 离子共存 限定条件下的离子共存解读
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 = 2NaNO2 + CO2;2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3
 N2 + H2O
N2 + H2O现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO
 )∶n(NO
)∶n(NO ) = 4∶1,下列说法正确的是
) = 4∶1,下列说法正确的是| A.混合气体中V(N2O4) = 0.336 L |
| B.混合气体中n(NO)∶n(NO2) = 1∶5 |
| C.NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5 |
D.如采用氨的催化氧化法处理,理论消耗n(NH3) = 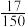 mol mol |
【知识点】 基于氧化还原反应守恒规律的计算解读 氨的还原性解读
| A.Na2CO3溶液中加入醋酸:2H++CO32-=CO2↑+H2O |
| B.MgO与稀盐酸反应:MgO+2H+=Mg2++H2O |
| C.AlCl3溶液与过量的氢氧化钠溶液反应:AlCl3+3OH-=Al (OH)3↓+3Cl- |
| D.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag |
【知识点】 离子方程式的正误判断解读
反应I:CuS+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
下列有关说法正确的是
| A.反应I和Ⅱ中各有2种元素的化合价发生变化 |
| B.处理1molCr2O72-时反应I、Ⅱ中消耗H+的物质的量相等 |
| C.反应Ⅱ中还原剂与氧化剂的物质的量之比为3:5 |
| D.质量相同时,Cu2S能去除更多的Cr2O72- |
| A.AgNO3+NaCl===AgCl↓+NaNO3 | B.3CO+Fe2O3 2Fe+3CO2 2Fe+3CO2 |
| C.2F2+2H2O===4HF+O2 | D.MgCl2(熔融)  Mg+Cl2↑ Mg+Cl2↑ |
【知识点】 氧化还原反应的定义及实质
| A.0.1 mol·L-1的氨水:Cu2+、Na+、SO42-、NO3- |
| B.0.1 mol·L-1的CaCl2溶液:Na+、K+、Cl-、NO3- |
| C.0.1 mol·L-1的Na2SO3溶液:K+、H+、SO42-、NO3- |
| D.0.1 mol·L-1的NaHCO3溶液:K+、Na+、NO3-、OH- |
【知识点】 离子反应的发生条件解读 离子共存 限定条件下的离子共存解读
| A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO +4OH-===Mg(OH)2↓+2H2O+2 +4OH-===Mg(OH)2↓+2H2O+2 |
| B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
| C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
| D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
| A.A | B.B | C.C | D.D |
| A.Na+、NH4+、Cl-、OH- |
| B.K+、Mg2+、NH4+、SO42- |
| C.Ba2+、Fe2+、NO3-、CO32- |
| D.H+、K+、CO32-、NO3- |
【知识点】 离子共存 无附加条件的离子共存解读
| A.Li2NH中N的化合价是-3 |
| B.1 mol H2参与反应,还原产物比氧化产物多15 g |
| C.该反应中H2既是氧化剂又是还原剂 |
| D.1 mol H2参与反应时有1 mol电子发生转移 |
【知识点】 氧化还原反应的几组概念解读 氧化还原反应的应用 氧化还原反应有关计算


| A.向含2molFeBr2的溶液中通入2molCl2:2Fe2++Cl2═2Cl-+2Fe3+ |
| B.向2molNaAlO2溶液中滴加5molHCl溶于水中:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ H2O |
| C.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| D.往氢氧化钠溶液中通入少量SO2与水反应OH- + SO2 = HSO3- |
实验① 向
 晶体中滴加浓盐酸,产生黄绿色气体
晶体中滴加浓盐酸,产生黄绿色气体 ;
;实验② 向
 溶液中通入少量实验①中产生的
溶液中通入少量实验①中产生的 ,溶液变为黄色;
,溶液变为黄色;实验③ 取实验②中生成的溶液滴在淀粉KI试纸上,试纸变为蓝色。
下列判断正确的是
A.上述实验证明氧化性: |
| B.上述实验中,共有两个氧化还原反应 |
C. 不能使湿润的淀粉KI试纸变蓝 不能使湿润的淀粉KI试纸变蓝 |
D.实验②证明 既有氧化性又有还原性 既有氧化性又有还原性 |
二、解答题 添加题型下试题
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为
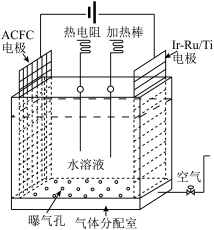
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
| 试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
| 质量 分数 | 体积/mL | |||||
| Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
| Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
| Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
| Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
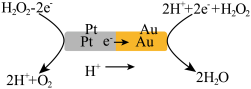
则:Au一侧为电池的

请回答以下问题:
(1)B是
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:
(3)A中元素的原子结构示意图为
(4)上述反应中属于氧化还原反应的是
(1)E 元素在周期表中的位置
(2)写出A2W2的电子式为
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
(4)元素D的单质在一定条件下,能与 A 单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE 单质混合加入足量的水,充分反应后成气体的体积是
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为
(1)B为
(2)向一定量的Ba(HCO3)2溶液中逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为
(3)向C溶液中加入Zn粒,发生反应的化学方程式为
三、计算题 添加题型下试题
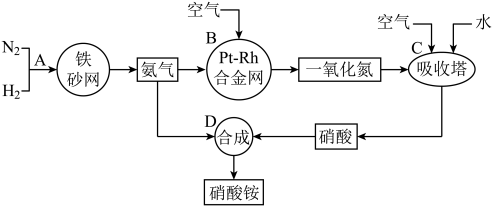
(1)写出反应容器B中发生反应的化学方程式:
(2)吸收塔C中通入空气的目的是
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:
(4)碳与浓硝酸反应的化学方程式是
(5)将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
①写出上述过程中,有关反应的离子方程式:
②完成该反应至少需要量取10mol·L-1的浓硝酸
③混合气体中NO2的体积为
④将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为
【知识点】 基于氧化还原反应守恒规律的计算解读 硝酸的强氧化性解读
(1)当产生碘单质的量最多时,反应的n(IO3-)=
(2)若1<a<1.2时,则溶液中SO42-与I-的物质的量之比为
【知识点】 氧化还原反应有关计算
试卷分析
试卷题型(共 20题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 氧化还原反应方程式的配平 氧化还原反应在生活、生产中的应用 | |
| 2 | 0.65 | 氧化还原反应的几组概念 氧化性、还原性强弱的比较 氧化还原反应的规律 | |
| 3 | 0.85 | 离子共存 限定条件下的离子共存 | |
| 4 | 0.85 | 离子反应的发生条件 离子共存 限定条件下的离子共存 | |
| 5 | 0.4 | 基于氧化还原反应守恒规律的计算 氨的还原性 | |
| 6 | 0.65 | 离子方程式的正误判断 | |
| 7 | 0.4 | 氧化还原反应有关计算 氧化还原反应方程式的配平 氧化还原反应在生活、生产中的应用 | |
| 8 | 0.85 | 氧化还原反应的定义及实质 | |
| 9 | 0.85 | 离子反应的发生条件 离子共存 限定条件下的离子共存 | |
| 10 | 0.65 | 离子反应的发生及书写 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 | |
| 11 | 0.85 | 离子共存 无附加条件的离子共存 | |
| 12 | 0.65 | 氧化还原反应的几组概念 氧化还原反应的应用 氧化还原反应有关计算 | |
| 13 | 0.65 | 离子方程式的正误判断 氯气与还原性化合物的反应 酸性氧化物的通性 偏铝酸钠与盐酸的反应 | |
| 14 | 0.65 | 氧化还原反应定义、本质及特征 氧化性、还原性强弱的比较 氧化还原反应的应用 | |
| 二、解答题 | |||
| 15 | 0.65 | 氧化还原反应的应用 影响化学反应速率的外因 通过实验探究原电池原理 综合实验设计与评价 | 实验探究题 |
| 16 | 0.65 | 无机综合推断 次氯酸及其性质 漂白粉和漂粉精 | 无机推断题 |
| 17 | 0.65 | 共价型分子结构式、电子式 根据物质性质进行元素种类推断 “位构性”关系理解及应用 分子间作用力 氢键 | 无机推断题 |
| 18 | 0.65 | 离子方程式的书写 离子反应在化合物组成的分析、鉴定的应用 无机综合推断 | 无机推断题 |
| 三、计算题 | |||
| 19 | 0.65 | 基于氧化还原反应守恒规律的计算 硝酸的强氧化性 | |
| 20 | 0.65 | 氧化还原反应有关计算 | |



