湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题
湖南
高一
期中
2021-05-31
261次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、化学实验基础、有机化学基础
湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题
湖南
高一
期中
2021-05-31
261次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、化学实验基础、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 化学与生活息息相关,下列有关说法不正确的是
| A.国产飞机C919用到的氮化硅陶瓷是新型有机非金属材料 |
| B.硫酸钡不溶于水、不溶于酸且不能被X射线透过,可用作X射线检测的“钡餐” |
| C.彩色玻璃是制玻璃过程中会加入一些金属氧化物或盐制得的,可用于建筑物和装饰 |
| D.熟石膏与水混合成糊状物会很快凝固,医疗上可用来制作石膏 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
2. 下列有关化学用语表示不正确的是
A.S2-的结构示意图: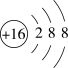 | B.丙烷的球棍模型: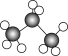 |
C.N2的电子式: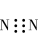 | D.甲烷的比例模型: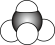 |
您最近一年使用:0次
2020-08-04更新
|
181次组卷
|
5卷引用:辽宁省辽阳市2019-2020学年高一下学期期末考试化学试题
单选题
|
较易(0.85)
名校
解题方法
您最近一年使用:0次
2021-05-15更新
|
296次组卷
|
5卷引用:河南省长葛市第一高级中学2021届高三上学期10月阶段性测试化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 下列为除去物质中的少量杂质所选试剂不正确的是
| 选项 | 物质(杂质) | 试剂 |
| A | CO2(NH3) | 浓硫酸 |
| B | H2(SO2) | 氢氧化钾溶液 |
| C | NO(NO2) | 水 |
| D | NH3(SO2) | 品红溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-03-25更新
|
470次组卷
|
6卷引用:山西省2020-2021学年高一下学期3月联合考试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 下列说法不正确的是
| A.燃料的燃烧都是放热反应 |
| B.化学变化中的能量变化主要是由化学键的变化引起的 |
| C.吸热反应发生时一定要加热,放热反应发生时不需要加热 |
| D.煤、石油、天然气是当今世界重要的化石能源 |
您最近一年使用:0次
2021-05-12更新
|
188次组卷
|
4卷引用:湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题
湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题(已下线)专题04 化学能与热能【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)江西省九江市2020-2021学年高一下学期期末考试化学试题吉林省长春市九台区第四中学2021-2022学年高二上学期9月月考化学试卷题
单选题
|
较易(0.85)
名校
6. 分别按如图甲、乙所示装置进行试验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中 为电流表。下列叙述正确的是
为电流表。下列叙述正确的是
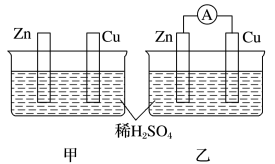
 为电流表。下列叙述正确的是
为电流表。下列叙述正确的是 
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.乙的外电路中电子方向为Zn→Cu |
| D.两烧杯中锌片均被还原,生成Zn2+ |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 下列说法不正确的是
| A.催化剂是通过改变反应所需的活化能来改变反应速率的 |
| B.固体参与的反应中,固体的用量及颗粒大小均不会影响反应速率 |
| C.控制变量是研究反应条件对实验产生影响的重要方法 |
| D.对于有气体参与的反应来说,在不改变体积的情况下通入惰性气体,不影响化学反应速率 |
您最近一年使用:0次
2021-05-12更新
|
606次组卷
|
5卷引用:湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题
湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题河南省2020-2021年度高一下学期第三次联考化学试题(已下线)作业03 化学反应速率-2021年高二化学暑假作业(人教版2019)(已下线)第二章 第二节 影响化学反应速率的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)《新教材变化解读及考法剖析 》—第六章 化学反应与能量(人教版2019必修第二册)
单选题
|
较易(0.85)
名校
8. 某链状有机物分子中含有m个—Br,n个—CH2—,a个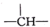 ,b个
,b个 ,其余为—CH3,则—CH3的数目可能是
,其余为—CH3,则—CH3的数目可能是
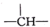 ,b个
,b个 ,其余为—CH3,则—CH3的数目可能是
,其余为—CH3,则—CH3的数目可能是| A.2n+3a-m | B.a+2b-m | C.n+m+a | D.a+2b+2-m |
【知识点】 有机物结构式的确定
您最近一年使用:0次
2021-05-06更新
|
130次组卷
|
3卷引用:河北省邢台市2020-2021学年高一下学期第二次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 在反应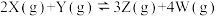 中,下列表示该反应的反应速率最快的是
中,下列表示该反应的反应速率最快的是
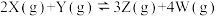 中,下列表示该反应的反应速率最快的是
中,下列表示该反应的反应速率最快的是A. | B. |
C. | D.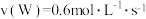 |
【知识点】 化学反应速率与化学计量数之间的关系解读
您最近一年使用:0次
2021-04-28更新
|
256次组卷
|
4卷引用:湖北省2020-2021学年高一下学期期中联考化学试题
单选题
|
适中(0.65)
名校
您最近一年使用:0次
2021-05-06更新
|
316次组卷
|
6卷引用:河北省邢台市2020-2021学年高一下学期第二次月考化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
11. 由丙烯(CH2=CH—CH3)合成的聚丙烯可用于生产口罩滤芯材料。下列有关说法不正确的是
| A.丙烯和聚丙烯都能使酸性高锰酸钾溶液褪色 |
| B.丙烯合成聚丙烯属于加聚反应 |
| C.丙烯与溴发生加成反应生成CH2Br—CH2—CH2Br |
| D.聚丙烯属于难降解的物质,随意丢弃会造成白色污染 |
【知识点】 聚乙烯结构及应用解读 含碳碳双键物质的性质的推断解读 加聚反应
您最近一年使用:0次
2021-05-06更新
|
688次组卷
|
3卷引用:河北省邢台市2020-2021学年高一下学期第二次月考化学试题
多选题
|
较易(0.85)
名校
解题方法
12. 下列有关实验装置进行的相应实验,能达到实验目的的是
 | 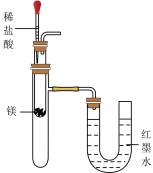 |  |  |
| 加热装置中的烧杯分离SiO2和NH4Cl | 验证镁和稀盐酸反应的热效应 | 制取并收集干燥、纯净的NH3 | 配制一定物质的量浓度的稀硫酸 |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
【知识点】 氨的物理性质解读 化学实验方案的设计与评价
您最近一年使用:0次
2021-04-07更新
|
172次组卷
|
3卷引用:河北省邢台市2020-2021学年高一下学期第一次月考化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
13. 下列反应方程式书写不正确的是
A.铝遇NaOH溶液产生气泡:2Al+2OH-+2H2O=2 +3H2↑ +3H2↑ |
| B.用浓氨水检验氯气泄漏:8NH3+3Cl2=6NH4Cl+N2 |
C.实验室法制备氨气:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O CaCl2+2NH3↑+2H2O |
D.向酸性KMnO4溶液中加入足量NaHSO3溶液:2 +5 +5 +6H+=2Mn2++5 +6H+=2Mn2++5 +3H2O +3H2O |
【知识点】 离子方程式的书写解读 离子方程式的正误判断解读
您最近一年使用:0次
2021-05-12更新
|
114次组卷
|
2卷引用:湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
名校
14. 交通警察进行酒精抽查时,会利用一种以酸性燃料电池为电源的酒精检测仪进行现场检测。该仪器的工作原理如图所示。下列说法不正确的是
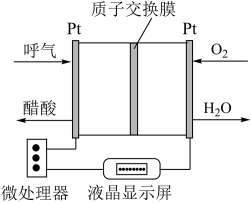

| A.H+从图中Pt(左)的极室穿过质子交换膜进入Pt(右)的极室中 |
| B.该电池的负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+ |
| C.电子由Pt(左)电极经过电解质溶液流向Pt(右)极 |
| D.不同大小的电流通过微处理器时,液晶显示屏会显示不同的变化 |
您最近一年使用:0次
2021-05-12更新
|
162次组卷
|
2卷引用:湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题
四、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
15. 化学反应的本质是旧化学键断裂新化学键形成的过程。根据所学知识回答下列有关化学反应中能量的变化的问题。
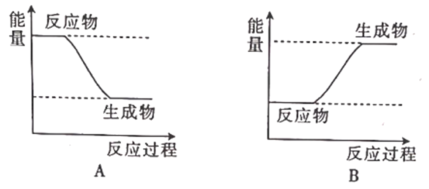
(1)H2与Cl2、Br2均能发生反应,H2与Br2发生反应生成HBr过程中的能量变化示意图如图。

①完成转化Ⅰ、Ⅱ需___ (填“吸收”或“放出”下同)能量,完成转化Ⅲ需___ 能量。
②H2和Br2反应的能量变化图可用___ (填“A”或“B”)表示。
(2)H2在Cl2中燃烧的过程主要是___ 能转化为__ 能的过程。
(3)理论上讲,任何自发的氧化还原反应都可以设计成原电池.燃料电池的工作原理是将燃料和氧化剂反应所产生的化学能直接转化为电能。
①现将氢气和氯气的反应设计成酸性(盐酸为电解质溶液)燃料电池,则正极应通入的气体为__ (填化学式)。
②实际应用中,设计了一款通过NO传感器监测汽车尾气中NO的含量的燃料电池,其工作原理如图所示。已知:O2-可在固体电解质中自由移动。
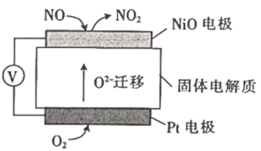
a.NiO电极上发生的是填___ (“氧化”或“还原”)反应。
b.外电路中,电子是从__ (填“NiO”或“Pt”)电极流出。
c.Pt电极上的电极反应式为__ 。
(1)H2与Cl2、Br2均能发生反应,H2与Br2发生反应生成HBr过程中的能量变化示意图如图。

①完成转化Ⅰ、Ⅱ需
②H2和Br2反应的能量变化图可用

(2)H2在Cl2中燃烧的过程主要是
(3)理论上讲,任何自发的氧化还原反应都可以设计成原电池.燃料电池的工作原理是将燃料和氧化剂反应所产生的化学能直接转化为电能。
①现将氢气和氯气的反应设计成酸性(盐酸为电解质溶液)燃料电池,则正极应通入的气体为
②实际应用中,设计了一款通过NO传感器监测汽车尾气中NO的含量的燃料电池,其工作原理如图所示。已知:O2-可在固体电解质中自由移动。

a.NiO电极上发生的是填
b.外电路中,电子是从
c.Pt电极上的电极反应式为
您最近一年使用:0次
2021-04-07更新
|
231次组卷
|
6卷引用:河北省邢台市2020-2021学年高一下学期第一次月考化学试题
五、填空题 添加题型下试题
16. NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)K. F. Greene的研究发现:硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸。研究发现金属在不同浓度的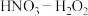 混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:
混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:

①最佳溶解金属的混合溶液中HNO3的质量分数为_______ ,理由是_______ 。
②过氧化氢与亚硝酸反应的化学方程式为_______ 。
③酸性高锰酸钾溶液是一种强氧化剂,它也可将亚硝酸氧化,因而也可消除氮氧化物。写出该反应的离子方程式:_______ 。
(2)氧化-还原法消除氮氧化物的转化如下:

①反应I为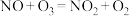 ,生成11.2 L(标准状况)O2时,转移电子的物质的量是
,生成11.2 L(标准状况)O2时,转移电子的物质的量是_______ mol。
②反应II中,当 时,反应的化学方程式为
时,反应的化学方程式为_______ 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应如下:
① ;②
;② 。反应①中SO2
。反应①中SO2_______ (填“作还原剂”、“作氧化剂”或“既不作还原剂,也不作氧化剂”)。
(1)K. F. Greene的研究发现:硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸。研究发现金属在不同浓度的
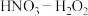 混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:
混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:
①最佳溶解金属的混合溶液中HNO3的质量分数为
②过氧化氢与亚硝酸反应的化学方程式为
③酸性高锰酸钾溶液是一种强氧化剂,它也可将亚硝酸氧化,因而也可消除氮氧化物。写出该反应的离子方程式:
(2)氧化-还原法消除氮氧化物的转化如下:

①反应I为
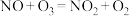 ,生成11.2 L(标准状况)O2时,转移电子的物质的量是
,生成11.2 L(标准状况)O2时,转移电子的物质的量是②反应II中,当
 时,反应的化学方程式为
时,反应的化学方程式为(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应如下:
①
 ;②
;② 。反应①中SO2
。反应①中SO2
您最近一年使用:0次
2021-03-27更新
|
110次组卷
|
3卷引用:山西省2020-2021学年高一下学期3月联合考试化学试题
填空题
|
较易(0.85)
名校
17. 乙烯是石油化工的重要基本原料。通过一系列化学反应,可以由乙烯得到有机高分子材料、药物等成千上万种有用的物质。
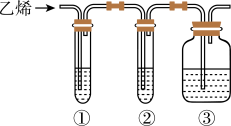
根据上述装置,回答下列问题:
(1)已知:1,2—二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
预测:试管①中装有溴的四氯化碳溶液,试管①可能出现的实验现象是___ 。
试管②中装有溴水,则试管②可能出现的实验现象为____ 。
(2)试管③中装有的是酸性高锰酸钾溶液,则试管③发生反应的类型为____ 。
(3)写出试管①中发生反应的化学方程式:____ ,反应类型为____ 。
(4)做乙烯燃烧实验之前必须进行的操作是____ ,乙烯燃烧可能观察到的现象是____ 。
(5)下列属于有机高分子化合物的是____ (填标号)。
①聚乙烯(PE) ②光导纤维 ③聚四氟乙烯(PTFE) ④聚丙烯(PP) ⑤聚氯乙烯(PVC) ⑥石墨纤维

根据上述装置,回答下列问题:
(1)已知:1,2—二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
预测:试管①中装有溴的四氯化碳溶液,试管①可能出现的实验现象是
试管②中装有溴水,则试管②可能出现的实验现象为
(2)试管③中装有的是酸性高锰酸钾溶液,则试管③发生反应的类型为
(3)写出试管①中发生反应的化学方程式:
(4)做乙烯燃烧实验之前必须进行的操作是
(5)下列属于有机高分子化合物的是
①聚乙烯(PE) ②光导纤维 ③聚四氟乙烯(PTFE) ④聚丙烯(PP) ⑤聚氯乙烯(PVC) ⑥石墨纤维
| A.①②③④ | B.②③④⑥ | C.③④⑤⑥ | D.①③④⑤ |
您最近一年使用:0次
2022-04-28更新
|
609次组卷
|
8卷引用:湖北省2020-2021学年高一下学期期中联考化学试题
湖北省2020-2021学年高一下学期期中联考化学试题河北省邢台市2020-2021学年高一下学期第二次月考化学试题湖南省常德市芷兰实验中学2020-2021学年高一下学期期中考试化学试题(已下线)期末检测卷1 -2020-2021学年高一化学必修2章末集训必刷卷(人教版)(已下线)第3章 有机化合物(基础过关卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)安徽省亳州市第二中学2020-2021学年高一下学期期末考试化学试题河南省原阳县第三高级中学2021-2022学年高二上学期第一次月考化学试题 湖南省百所学校2021-2022学年高一下学期期中考试化学试题
六、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
18. 将CO2转化成有机物可有效实现确循环。在容积为2L的恒温恒容密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应CO2(g)+ 3H2(g) CH3OH(g) +H2O(g),测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
CH3OH(g) +H2O(g),测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
(1)a=___________ ;3~9 min内,v(CO2)=___________ mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是___________ (填标号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)上述反应6 min末时,已消耗掉的CO2的物质的量分数为___________
(4)上述反应12 min末时,混合气体中CO2(g)和H2(g)的质量之比是___________
(5)第3 min时v正(CH3OH)___________ (填“>”、“<”、“=”或“无法比较”)第9 min时v逆(CH3OH)
(6)在恒温条件下,若将一定量X和Y的混合气体通入容积为2 L的恒容密闭容器中,发生反应mX(g) nY(g),X和Y的物质的量浓度随时间的变化情况如下表。
nY(g),X和Y的物质的量浓度随时间的变化情况如下表。
①m:n=___________ 。
②c=___________ (保留两位有效数字)
 CH3OH(g) +H2O(g),测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
CH3OH(g) +H2O(g),测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
| n(CH3OH)/mol | 0 | 0.50 | 0.65 | 0.74 | 0.74 |
| n(CO2)/mol | 1 | 0.50 | 0.35 | a | 0.26 |
(1)a=
(2)能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)上述反应6 min末时,已消耗掉的CO2的物质的量分数为
(4)上述反应12 min末时,混合气体中CO2(g)和H2(g)的质量之比是
(5)第3 min时v正(CH3OH)
(6)在恒温条件下,若将一定量X和Y的混合气体通入容积为2 L的恒容密闭容器中,发生反应mX(g)
 nY(g),X和Y的物质的量浓度随时间的变化情况如下表。
nY(g),X和Y的物质的量浓度随时间的变化情况如下表。| 时间/min | 0 | 5 | 10 | 15 | 20 |
| c(X )/mol·L-1 | 0.2 | c | 0.6 | 0.6 | 0.6 |
| c(Y)/mol·L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 |
①m:n=
②c=
您最近一年使用:0次
2021-05-12更新
|
251次组卷
|
5卷引用:广东省湛江市2020-2021学年高一下学期期中考试化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、化学实验基础、有机化学基础
试卷题型(共 18题)
题型
数量
单选题
12
多选题
2
解答题
2
填空题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 常见硫酸盐的性质 新型无机非金属材料 | |
| 2 | 0.65 | 有关粒子结构的化学用语 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 | |
| 3 | 0.85 | 能量的相互转化 常见能量转化形式 吸热反应和放热反应 | |
| 4 | 0.85 | 酸性氧化物的通性 物质的分离、提纯 物质分离、提纯的常见化学方法 | |
| 5 | 0.65 | 化学反应中能量变化的原因 化学键与化学反应中的能量关系 吸热反应和放热反应 | |
| 6 | 0.85 | 原电池 原电池原理理解 原电池正负极判断 | |
| 7 | 0.65 | 影响化学反应速率的因素 影响化学反应速率的外因 催化剂对化学反应速率的影响 | |
| 8 | 0.85 | 有机物结构式的确定 | |
| 9 | 0.65 | 化学反应速率与化学计量数之间的关系 | |
| 10 | 0.65 | 单烯烃的加成反应 | |
| 13 | 0.65 | 离子方程式的书写 离子方程式的正误判断 | |
| 14 | 0.65 | 燃料电池 新型电池 | |
| 二、多选题 | |||
| 11 | 0.65 | 聚乙烯结构及应用 含碳碳双键物质的性质的推断 加聚反应 | |
| 12 | 0.85 | 氨的物理性质 化学实验方案的设计与评价 | |
| 三、解答题 | |||
| 15 | 0.65 | 化学反应中能量变化的原因 根据△H=反应物的键能之和-生成物的键能之和进行计算 原电池 | 原理综合题 |
| 18 | 0.65 | 化学反应速率计算 化学平衡状态的判断方法 转化率的相关计算及判断 化学平衡题中基于图表数据的相关计算 | 原理综合题 |
| 四、填空题 | |||
| 16 | 0.65 | 氧化还原反应方程式的配平 氧化还原反应的规律 基于氧化还原反应守恒规律的计算 电子转移计算 | |
| 17 | 0.85 | 乙烯的加成反应 乙烯的聚合反应 乙烯燃烧 乙烯与强氧化性物质的反应 | |

 晶体与
晶体与 晶体反应
晶体反应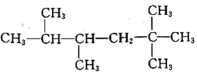 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有

