2015届浙江省浙江大学附属中学高三高考全真模拟理综化学试卷
浙江
高三
一模
2017-07-27
1065次
整体难度:
适中
考查范围:
化学反应原理、化学与STSE、化学实验基础、认识化学科学、物质结构与性质、有机化学基础、常见无机物及其应用
2015届浙江省浙江大学附属中学高三高考全真模拟理综化学试卷
浙江
高三
一模
2017-07-27
1065次
整体难度:
适中
考查范围:
化学反应原理、化学与STSE、化学实验基础、认识化学科学、物质结构与性质、有机化学基础、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 下列说法不正确的是
| A.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” |
| B.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
| C.pH计也可用于酸碱中和滴定终点的判断 |
| D.海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t。由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
解题方法
2. 下列说法不正确的是
| A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无 “0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 |
| D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
您最近一年使用:0次
2016-12-09更新
|
1209次组卷
|
4卷引用:2015届浙江省浙江大学附属中学高三高考全真模拟理综化学试卷
单选题
|
适中(0.65)
3. X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲 + 乙 = 丁 + 己,甲 + 丙 = 戊 + 己;0.1 mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
| A.1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B.Y元素在周期表中的位置为第三周期第ⅣA族 |
| C.原子半径:W>Z>Y>X |
| D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol |
您最近一年使用:0次
2016-12-09更新
|
183次组卷
|
2卷引用:2015届浙江省浙江大学附属中学高三高考全真模拟理综化学试卷
单选题
|
适中(0.65)
4. 下列说法不正确的是
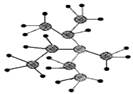

| A.按系统命名法,上图有机物的命名为2,3-二甲基-3-乙基戊烷 |
| B.结构为…-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单元链节是乙炔 |
| C.总物质的量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 |
D.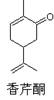 化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 |
您最近一年使用:0次
2016-12-09更新
|
261次组卷
|
2卷引用:2015届浙江省浙江大学附属中学高三高考全真模拟理综化学试卷
单选题
|
较难(0.4)
名校
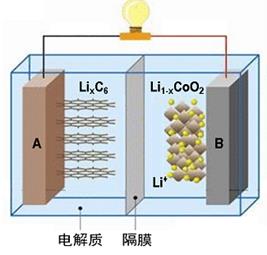
5. 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
| A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
【知识点】 原电池原理的应用 原电池电极反应式书写解读 原电池原理的综合应用解读
您最近一年使用:0次
2017-11-30更新
|
876次组卷
|
5卷引用:2015届浙江省浙江大学附属中学高三高考全真模拟理综化学试卷
单选题
|
较难(0.4)
6. 亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
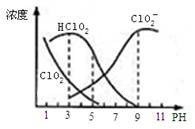

| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.使用该漂白剂的最佳pH为3 |
| D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有则c(HClO2)+ 2c(H+)=c(ClO2-)+ 2c(OH-) |
您最近一年使用:0次
2016-07-25更新
|
1627次组卷
|
4卷引用:2015届浙江省台州市路桥区高三高考模拟(二)理综化学试卷
单选题
|
较难(0.4)
名校
7. 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是

①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是

| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
| D.实验所加的NaOH的浓度为2mol·L-1 |
您最近一年使用:0次
2017-10-12更新
|
872次组卷
|
17卷引用:2014届浙江省温州市十校联合体高三上学期期末考试理综化学试卷
(已下线)2014届浙江省温州市十校联合体高三上学期期末考试理综化学试卷(已下线)2014届吉林省九校联合体高三第二次摸底考试理综化学试卷(已下线)2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷2015届浙江省杭州地区7校高三上学期期末模拟联考化学试卷2015届浙江省浙江大学附属中学高三高考全真模拟理综化学试卷2016届河南省信阳高级中学高三第四次大考化学试卷2017届湖北省襄阳五中高三上8月开学考化学试卷贵州省思南中学2016-2017学年高二下学期期末考试化学试题2018届高三一轮复习化学:微考点7-与离子反应有关的推断黑龙江省齐齐哈尔市第八中学2018届高三第二次月考化学试题甘肃省兰州第一中学2018届高三上学期第二次月考(9月)化学试题2019届高三化学一轮练习卷:离子的检验与推断【全国百强校】福建省师范大学附属中学2019届高三上学期期中考试化学试题(已下线)考点04 离子反应——备战2019年浙江新高考化学考点山西省晋中市和诚高中有限公司2018-2019学年高一下学期3月月考试化学试题湖南省茶陵县第三中学2020届高三第三次月考化学试题广西南宁市第三中学2019-2020学年高一上学期期末考试化学试题
二、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
解题方法
8. 溴水中存在化学平衡:Br2+H2O  HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)
HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)
已知:R-CH2Cl + NaOH (水溶液)→ R-CH2OH + NaCl
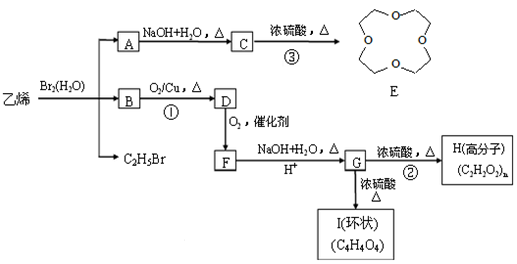
回答下列问题:
(1)写出B中所含官能团名称_________
(2)指出③的反应类型_________ ,写出I(环状)的结构简式__________ 。
(3)写出反应 ① 的化学方程式_____________________________________ 。
写出反应 ② 的化学方程式_____________________________________ 。
 HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)
HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)已知:R-CH2Cl + NaOH (水溶液)→ R-CH2OH + NaCl

回答下列问题:
(1)写出B中所含官能团名称
(2)指出③的反应类型
(3)写出反应 ① 的化学方程式
写出反应 ② 的化学方程式
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
9. Ⅰ.次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为____ ;
(2)NaH2PO2为____ (填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为___________ 。
(3)H3PO2可将溶液中的银离子还原为银单质,若该反应的氧化产物的化学式为H3PO4 , 则氧化剂与还原剂的物质的量之比为_______ 。
Ⅱ.无机化合物A主要用于有机合成和药物制造,是具有良好前景的储氢材料。A中含有金属Li元素,遇水强烈水解,对化合物A加强热则其会发生分解反应(非氧化还原反应),生成化合物E和气体C。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。请回答下列问题:
(1)A的化学式是____ ,C的电子式是____ 。
(2)写出化合物A与足量盐酸反应的化学方程式:____________ 。
(3)物质A在加强热分解的化学方程式为:________________________ 。
(1)P的原子结构示意图为
(2)NaH2PO2为
(3)H3PO2可将溶液中的银离子还原为银单质,若该反应的氧化产物的化学式为H3PO4 , 则氧化剂与还原剂的物质的量之比为
Ⅱ.无机化合物A主要用于有机合成和药物制造,是具有良好前景的储氢材料。A中含有金属Li元素,遇水强烈水解,对化合物A加强热则其会发生分解反应(非氧化还原反应),生成化合物E和气体C。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。请回答下列问题:
(1)A的化学式是
(2)写出化合物A与足量盐酸反应的化学方程式:
(3)物质A在加强热分解的化学方程式为:
【知识点】 氧化还原反应有关计算 弱电解质的电离方程式解读 盐类水解规律
您最近一年使用:0次
填空题
|
适中(0.65)
10. 甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
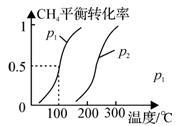
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) =___ 。
②图中p1___ p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为___ 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
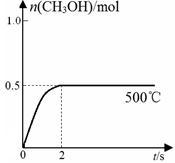
①应(ii)需在____ (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是____ (用化学方程式表示)。
③在500℃恒压条件下,请在______ 上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
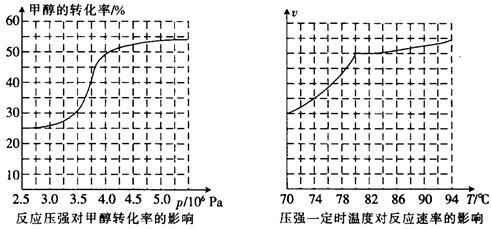
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是____ 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是______ 。
(i)制备合成气:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol(ii)合成甲醇:CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。

①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) =
②图中p1
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g)
 CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。

①应(ii)需在
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是
③在500℃恒压条件下,请在
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g)
 HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
您最近一年使用:0次
2016-12-09更新
|
322次组卷
|
3卷引用:2015届浙江省严州中学高三3月阶段测试理综化学试卷
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
11. 氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是_______________________ 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。
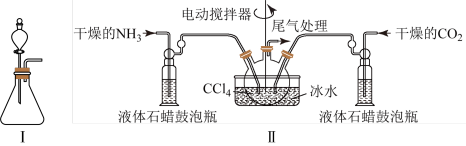
注:CCl4与液体石蜡均为惰性介质。
① 发生器用冰水冷却的原因是__________________________________________ ,液体石蜡鼓泡瓶的作用是__________________________________________ 。
②从反应后的混合物中分离出产品的实验方法是____________ (填写操作名称)。为了得到干燥产品,应采取的方法是_________ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为_________ 。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197]
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0(1)如用下图I装置制取氨气,可选择的试剂是
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。

注:CCl4与液体石蜡均为惰性介质。
① 发生器用冰水冷却的原因是
②从反应后的混合物中分离出产品的实验方法是
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 |
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学反应原理、化学与STSE、化学实验基础、认识化学科学、物质结构与性质、有机化学基础、常见无机物及其应用
试卷题型(共 11题)
题型
数量
单选题
7
解答题
2
填空题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 酸碱中和滴定 固体废弃物的处理 化学对材料制造和应用的作用 海水资源综合利用 | |
| 2 | 0.4 | 勒夏特列原理的应用 常用仪器及使用 化学实验基础操作 实验安全 | |
| 3 | 0.65 | 氧化还原反应有关计算 盐类水解的应用 元素周期律、元素周期表的推断 微粒半径大小的比较方法 | |
| 4 | 0.65 | 有机反应类型 烷烃的命名 加聚物的单体、链节及聚合度的确定 利用烃完全燃烧耗氧量的规律进行的计算 | |
| 5 | 0.4 | 原电池原理的应用 原电池电极反应式书写 原电池原理的综合应用 | |
| 6 | 0.4 | 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 7 | 0.4 | 离子反应在化合物组成的分析、鉴定的应用 铝盐与强碱溶液反应 离子的检验 | |
| 二、解答题 | |||
| 8 | 0.65 | 常见官能团名称、组成及结构 乙醇催化氧化 羧酸酯化反应 有机物的推断 | 有机推断题 |
| 11 | 0.65 | 氨的碱性 常见无机物的制备 探究物质组成或测量物质的含量 综合实验设计与评价 | 实验探究题 |
| 三、填空题 | |||
| 9 | 0.65 | 氧化还原反应有关计算 弱电解质的电离方程式 盐类水解规律 | |
| 10 | 0.65 | 化学反应速率计算 化学平衡状态 化学平衡的移动及其影响因素 化学平衡图像分析 | |



