亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
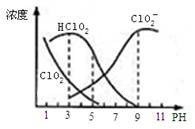

| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.使用该漂白剂的最佳pH为3 |
| D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有则c(HClO2)+ 2c(H+)=c(ClO2-)+ 2c(OH-) |
更新时间:2016-07-25 19:14:39
|
相似题推荐
单选题
|
较难
(0.4)
名校
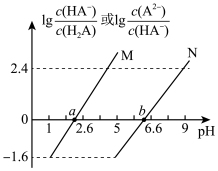
【推荐1】常温下将NaOH溶液滴加到 溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为
溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为 或
或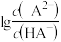 ]下列叙述错误的是
]下列叙述错误的是
 溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为
溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为 或
或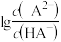 ]下列叙述错误的是
]下列叙述错误的是
A.曲线M表示pH与 的关系 的关系 |
B.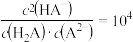 |
C.b点对应溶液中: |
| D.溶液pH从2.6到6.6的过程中,水的电离程度先增大后减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,将1.0Lx mol ·L-1 CH3COOH溶液与0. 1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述正确的是


| A.水的电离程度:①>②>③ |
| B.点②对应的混合溶液中:c(CH3COOH)+c(CH3COO-)=x mol·L-1 |
| C.点③对应的混合溶液中:c(Na+)> c(CH3COO-) |
D.该温度下,CH3COOH的电离平衡常数Ka=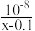 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】硼酸( )在水溶液中存在电离平衡:
)在水溶液中存在电离平衡: 。用
。用
 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 、混合溶液的
、混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。
 )在水溶液中存在电离平衡:
)在水溶液中存在电离平衡: 。用
。用
 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 、混合溶液的
、混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。已知: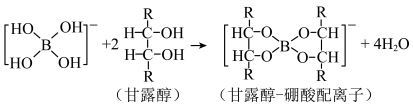
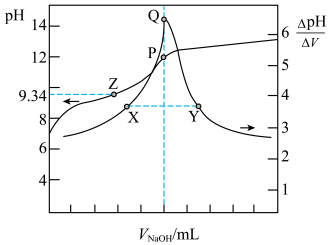
| A.滴定硼酸时加入甘露醇可获得更显著的滴定突跃 | B.溶液 :X点<Y点 :X点<Y点 |
C.Z点: | D.P点和Q点均代表反应终点 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,体积和浓度一定的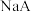 溶液中各微粒浓度的负对数(
溶液中各微粒浓度的负对数(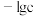 )随溶液pH的变化关系如图所示。下列叙述正确的是
)随溶液pH的变化关系如图所示。下列叙述正确的是
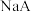 溶液中各微粒浓度的负对数(
溶液中各微粒浓度的负对数(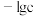 )随溶液pH的变化关系如图所示。下列叙述正确的是
)随溶液pH的变化关系如图所示。下列叙述正确的是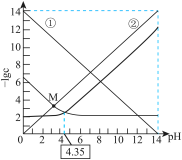
A.曲线②表示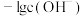 随溶液pH的变化情况 随溶液pH的变化情况 |
B.等物质的量浓度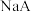 和 和 混合溶液: 混合溶液: |
C. 的 的 的数量级为 的数量级为 |
D.常温下,将M点对应溶液加水稀释,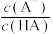 不变 不变 |
您最近一年使用:0次

 是常见的二元弱酸(电离常数
是常见的二元弱酸(电离常数 ,
,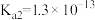 )。氢氧化铁[
)。氢氧化铁[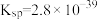 ]、氢氧化锌[
]、氢氧化锌[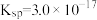 ]均为难溶多元弱碱,硫化锌[
]均为难溶多元弱碱,硫化锌[ ]为难溶盐。所有数据均为25℃的值。下列有关说法不正确的是
]为难溶盐。所有数据均为25℃的值。下列有关说法不正确的是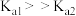 ,所以
,所以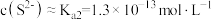
 饱和溶液中的
饱和溶液中的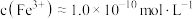
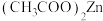 、
、 溶液中通入等物质的量的
溶液中通入等物质的量的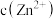 更小
更小 的
的 溶液与相同物质的量的
溶液与相同物质的量的


