【校级联考】福建省长汀、连城一中等六校2018-2019学年高一上学期期中联考化学试题
福建
高一
期中
2018-12-09
206次
整体难度:
容易
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、化学实验基础
一、单选题 添加题型下试题
| A.用食盐水易清洗热水瓶中的水垢 |
| B.利用丁达尔现象区别溶液和胶体 |
| C.生铁炼钢的过程并没有发生化学变化 |
| D.漂白粉在空气中容易变质的原因是 Ca(ClO)2 见光分解 |
【知识点】 胶体的性质和应用解读 漂白粉和漂粉精 金属材料的冶炼及保护
| A.化学是近代人类新发现的一门科学 |
| B.假说是研究物质性质的基本方法之一 |
| C.在研究氯气的性质时,发现有刺激性气味,该过程使用了观察法 |
| D.化学家可以操纵分子和原子,制造出自然界中不存在的物质 |
| A.将钠放入水中,钠将沉入水底 |
| B.金属钠着火时,可以用泡沫灭火器或用干燥的沙土灭火 |
| C.将一小块钠放入 CuSO4 溶液中发生反应:2Na+CuSO4 = Na2SO4+Cu |
| D.钠块放置于空气中,表面变暗;加热时,钠燃烧,发出黄色火焰 |
【知识点】 钠 钠的化学性质 钠与氧气等非金属的反应解读 过氧化钠
| A.物质的摩尔质量等于其相对分子(原子)质量 |
| B.摩尔是七个基本物理量之一 |
| C.非标准状况下,1 mol 气体体积也可能为 22.4 L |
| D.1mol 任何物质中都含有阿伏伽德罗常数个原子 |
【知识点】 物质的量及单位——摩尔 阿伏加德罗常数 气体摩尔体积
| A.配制 1L 0.1mol/L 的 CuSO4 溶液需称取 1.6g CuSO4 固体 |
| B.常温常压下,1mol O3 气体体积约为 22.4L |
| C.浓度为 1mol·L−1 的盐酸所含氯化氢分子的数目为 NA |
| D.5.6 g Fe 与足量 Cl2 反应,转移的电子数为 0.3NA |
现象或事实 | 解释 | |
A | CO2 气体缓缓通入包裹有 Na2O2 粉末的棉花,棉花很快燃烧起来 | Na2O2 与 CO2 反应放出热量 |
B | 将 Na2O2、Na2O 分别溶于水,再往其中滴入酚酞,最终溶液均变红色 | Na2O2、Na2O 都是碱性氧化物 |
C | Na 投入水中会熔成光亮的小球 | Na 与水反应放热且钠的熔点低 |
D | 工业上常用钠冶炼金属钛: | Na 具有强还原性 |
| A.A | B.B | C.C | D.D |
| A.新制氯水的颜色是因为氯水中含有氯气分子导致 |
| B.氢气在氯气中安静燃烧,发出黄色火焰 |
| C.储存氯气的钢瓶,为防止腐蚀,装氯气前必须先充分干燥 |
| D.根据氯气能与碱反应,可用氢氧化钠溶液进行氯气的尾气吸收处理 |
| A.次氯酸中氯元素呈 -1 价 |
| B.次氯酸既不是电解质,也不是非电解质 |
| C.新制氯水长期放置后仍可用于自来水的消毒 |
| D.往氯水中加入 AgNO3 溶液产生白色沉淀,说明氯水中有 Cl-存在 |
| A.NH4+、Mg2+、SO42﹣、Cl﹣ |
| B.Ba2+、K+、OH﹣、CO32- |
| C.Al3+、Cu2+、SO42﹣、Cl﹣ |
| D.H+、Ca2+、Cl﹣、HCO3﹣ |
【知识点】 离子共存 限定条件下的离子共存解读
A.NaHCO3 Na+ + HCO3- Na+ + HCO3- |
| B.CaCO3 = Ca2+ + CO32- |
| C.Cu(NO3)2 = Cu2+ + (NO3-)2 |
| D.HClO = H+ + ClO- |
| A.Al(OH)3 胶体和 AlCl3 溶液都能通过滤纸 |
| B.“卤水点豆腐,一物降一物”这句俗语利用了胶体的性质 |
| C.溶液是电中性的,胶体是带电的 |
| D.在沸水中逐滴加入 FeCl3 溶液可制备 Fe(OH)3 胶体 |
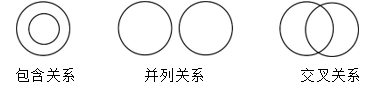
| A.电解质与酸、碱、盐属于包含关系 |
| B.化合物与氧化物属于包含关系 |
| C.碱性氧化物与酸性氧化物属于并列关系 |
| D.复分解反应与氧化还原反应属于交叉关系 |
| A.⑥⑧⑩ | B.②④⑩ | C.④⑦⑧ | D.②③⑥ |
【知识点】 电解质与非电解质 非电解质、电解质物质类别判断解读
| A.氯化亚铁溶液中通入氯气:Fe2+ + Cl2 = Fe3+ + 2Cl- |
| B.碳酸钙溶液与盐酸溶液反应:CO32-+2H+ = CO2↑+H2O |
| C.氢氧化钡溶液与硫酸溶液反应:Ba2+ + SO42- = BaSO4↓ |
| D.铜片插入硝酸银溶液中:Cu + 2Ag+ = Cu2+ + 2Ag |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读
| A.Cl2 发生氧化反应 |
| B.氯气为氧化剂,氮气为还原产物 |
| C.未被氧化的 NH3 与被氧化的 NH3 物质的量之比为 3:1 |
| D.氯气的氧化性比氮气的氧化性弱 |
【知识点】 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律解读
| A.氧化性强弱:Cl2 > Fe3+ > Br2 | B.还原性强弱:Br- >Fe2+ >Cl- |
| C.反应后溶液中 c(Fe3+):c(Br- ) =1:1 | D.反应后溶液中 c(Fe2+):c(Cl-) =1:2 |
【知识点】 物质的量有关计算 氧化性、还原性强弱的比较解读 氧化还原反应的应用
二、解答题 添加题型下试题
(1)除烧杯、玻璃棒外,一定还需要用到的玻璃仪器有
(2)计算:需要称取纯碱固体的质量为
(3)配制时,正确的操作顺序是(每个序号只用一次)
A.用少量水洗涤烧杯 2 次~3 次,洗涤液均注入容量瓶,振荡
B.在盛有纯碱固体的烧杯中加入适量水溶解
C.将恢复到室温的溶液沿玻璃棒注入容量瓶中
D.将容量瓶塞紧,上下颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相平
F.继续往容量瓶内小心加水,直到液面接近刻度 1 cm~2 cm 处
(4)下列会导致所配溶液实际浓度偏高的是
a.在 C 步骤中未恢复到室温即注入容量瓶
b.在 D 步骤完成后发现液面低于刻度线
c.在 E 步骤中俯视凹液面
(5)若欲用上述溶液另外配制 100 mL 0.2 mol/L 的纯碱溶液,则需取用上述溶液的体积为

根据上述转化关系,回答问题:
(1)写出下列物质的化学式:A
(2)反应①的化学方程式为:
(3)沉淀 G 转化为沉淀 H 的现象:
(4)写出物质 E 的一种用途
(5)一定条件下,将一定量的 A 与足量的 C 充分反应,最终得到 39.0g 固体 E,则反应中转移的电子数为
三、填空题 添加题型下试题
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代半导体工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,请回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O
②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为
A. 酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)
【知识点】 氧化还原反应方程式的配平解读 铁的氧化物 亚铁盐 铁盐
四、解答题 添加题型下试题
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
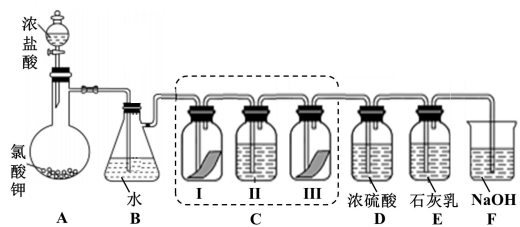
(1)写出 B 装置中反应的化学方程式
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)F 装置的作用是(用离子方程式表示)
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为
试卷分析
试卷题型(共 20题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 胶体的性质和应用 漂白粉和漂粉精 金属材料的冶炼及保护 | |
| 2 | 0.94 | 化学科学特点 化学研究基本方法 | |
| 3 | 0.85 | 钠 钠的化学性质 钠与氧气等非金属的反应 过氧化钠 | |
| 4 | 0.85 | 物质的量及单位——摩尔 阿伏加德罗常数 气体摩尔体积 | |
| 5 | 0.85 | 阿伏加德罗常数的求算 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 化学方程式计算中物质的量的运用 | |
| 6 | 0.65 | 钠 钠的化学性质 过氧化钠 | |
| 7 | 0.85 | 氯气 氯气的化学性质 氯气与金属单质的反应 氯气与碱溶液反应 | |
| 8 | 0.65 | 氯水 次氯酸及其性质 氯水的成分及检验 | |
| 9 | 0.85 | 离子共存 限定条件下的离子共存 | |
| 10 | 0.94 | 电离方程式 | |
| 11 | 0.85 | 分散系概念及其分类 胶体的定义及分类 胶体的性质和应用 胶体的制备 | |
| 12 | 0.94 | 分类方法的应用 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系 四种基本反应类型 | |
| 13 | 0.65 | 电解质与非电解质 非电解质、电解质物质类别判断 | |
| 14 | 0.65 | 离子反应的发生及书写 离子方程式的正误判断 | |
| 15 | 0.85 | 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律 | |
| 16 | 0.85 | 物质的量有关计算 氧化性、还原性强弱的比较 氧化还原反应的应用 | |
| 二、解答题 | |||
| 17 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 18 | 0.65 | 无机综合推断 钠 过氧化钠 氢氧化亚铁的还原性 | 无机推断题 |
| 20 | 0.65 | 氯气的制法 物质含量的测定 化学实验探究 综合实验设计与评价 | 实验探究题 |
| 三、填空题 | |||
| 19 | 0.65 | 氧化还原反应方程式的配平 铁的氧化物 亚铁盐 铁盐 | |




