2020届高三化学二轮每周大题必练— ——物质结构与性质
全国
高三
专题练习
2020-01-14
35次
整体难度:
适中
考查范围:
物质结构与性质
2020届高三化学二轮每周大题必练— ——物质结构与性质
全国
高三
专题练习
2020-01-14
35次
整体难度:
适中
考查范围:
物质结构与性质
一、填空题 添加题型下试题
填空题
|
较难(0.4)
名校
1. (1)下列有关说法正确的是_________________ 。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为________ ,SbCl5的晶体类型为_______ ,SbCl3的空间构型为____________ 。
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是___________ 。
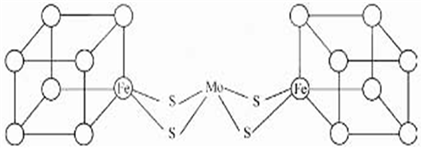
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:
图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________ 。
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式___________________ 。
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为_____________ 。
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为_______ g/cm3(已知NA,只需列式,无需化简)。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:
图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为
【知识点】 物质结构与性质综合考查解读
您最近一年使用:0次
2017-04-01更新
|
396次组卷
|
4卷引用:2017届黑龙江省哈尔滨市第九中学高三二模理科综合化学试卷
二、解答题 添加题型下试题
2. 过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ.二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是__ 。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
Ⅱ.2007年诺贝尔物理学奖为法国科学家阿尔贝⋅费尔和德国科学家彼得⋅格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。

(1)用A、B、O表示这类特殊晶体的化学式:__ 。
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:__ (用含x的代数式表示)。
(3)Mn的核外电子排布式为:___ 。
(4)下列有关说法正确的是___ 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2:

Ⅰ.二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
Ⅱ.2007年诺贝尔物理学奖为法国科学家阿尔贝⋅费尔和德国科学家彼得⋅格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。

(1)用A、B、O表示这类特殊晶体的化学式:
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:
(3)Mn的核外电子排布式为:
(4)下列有关说法正确的是
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2:

您最近一年使用:0次
2019-12-28更新
|
87次组卷
|
4卷引用:2010年郑州市智林学校高二下学期期末考试化学试题
(已下线)2010年郑州市智林学校高二下学期期末考试化学试题(已下线)2010-2011学年黑龙江省哈六中高一下学期期中考试化学试卷2019年秋高三化学复习强化练习—— 物质结构与性质大题练2020届高三化学二轮每周大题必练— ——物质结构与性质
解答题-无机推断题
|
适中(0.65)
3. 运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物 浓度均为
浓度均为 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

 元素R在周期表中的位置是
元素R在周期表中的位置是______ ;元素Z的原子结构示意图是______ 。
 元素Y和W形成的
元素Y和W形成的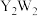 型化合物中含有化学键的类型为
型化合物中含有化学键的类型为______ 。
 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如 、
、 、COS等。
、COS等。
 下列能说明碳、硫两种元素非金属性相对强弱的是
下列能说明碳、硫两种元素非金属性相对强弱的是______  填序号
填序号
A.S与 发生化合反应比C与
发生化合反应比C与 化合更容易
化合更容易
B.酸性:
C. 中碳元素为
中碳元素为 价,硫元素为
价,硫元素为 价
价
 铅
铅 、锡
、锡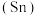 、锗
、锗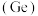 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
 锗的原子序数为
锗的原子序数为______ 。
 它们
它们 价氢氧化物的碱性由强到弱顺序为
价氢氧化物的碱性由强到弱顺序为______  填化学式
填化学式 。
。
 羰基硫
羰基硫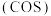 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和 相似。
相似。
 用电子式表示羰基硫
用电子式表示羰基硫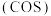 的形成过程:
的形成过程:______ 。
 羰基硫
羰基硫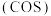 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:
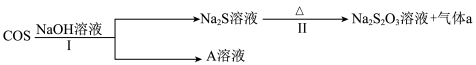
已知A是一种正盐,则A的化学式为______ ;若气体a为单质,反应II的离子方程式为______ 。
I.部分短周期主族元素的最高价氧化物对应的水化物
 浓度均为
浓度均为 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。
 元素R在周期表中的位置是
元素R在周期表中的位置是 元素Y和W形成的
元素Y和W形成的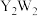 型化合物中含有化学键的类型为
型化合物中含有化学键的类型为 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如 、
、 、COS等。
、COS等。 下列能说明碳、硫两种元素非金属性相对强弱的是
下列能说明碳、硫两种元素非金属性相对强弱的是 填序号
填序号
A.S与
 发生化合反应比C与
发生化合反应比C与 化合更容易
化合更容易B.酸性:

C.
 中碳元素为
中碳元素为 价,硫元素为
价,硫元素为 价
价 铅
铅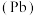 、锡
、锡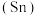 、锗
、锗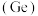 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论: 锗的原子序数为
锗的原子序数为 它们
它们 价氢氧化物的碱性由强到弱顺序为
价氢氧化物的碱性由强到弱顺序为 填化学式
填化学式 。
。 羰基硫
羰基硫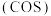 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和 相似。
相似。 用电子式表示羰基硫
用电子式表示羰基硫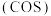 的形成过程:
的形成过程: 羰基硫
羰基硫 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图: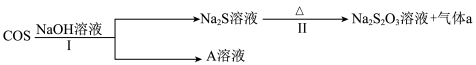
已知A是一种正盐,则A的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
4. 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
 基态铜原子的电子排布式为
基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与 的稳定性是CuO
的稳定性是CuO ______  填写“
填写“ ”、“
”、“ ”或“
”或“ ”
” 。
。
 硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为
硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“ ”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______  填“
填“ ”、“
”、“ ”
” 。
。
 常温下白色晶体,熔点为
常温下白色晶体,熔点为 ,
, 时升华,则
时升华,则 固体的晶体类型为
固体的晶体类型为 ______ ; 分子中Se原子的杂化类型为
分子中Se原子的杂化类型为 ______ 。
 镓元素在元素周期表中的位置是
镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性 价电子数少于价层轨道数
价电子数少于价层轨道数 ,其化合物可与具有孤对电子的分子或离子生成配合物,如
,其化合物可与具有孤对电子的分子或离子生成配合物,如 能与
能与 反应生成BF3·NH3,BF3·NH3的结构简式可表示为
反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
 金刚砂
金刚砂 的晶胞结构如图所示:
的晶胞结构如图所示:

则在SiC中,每个C原子周围紧邻的C原子数目为______ 个;若晶胞的边长为apm,则金刚砂的密度为 ______  。
。
 基态铜原子的电子排布式为
基态铜原子的电子排布式为  的稳定性是CuO
的稳定性是CuO  填写“
填写“ ”、“
”、“ ”或“
”或“ ”
” 。
。 硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为
硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为  ”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se  填“
填“ ”、“
”、“ ”
” 。
。 常温下白色晶体,熔点为
常温下白色晶体,熔点为 ,
, 时升华,则
时升华,则 固体的晶体类型为
固体的晶体类型为  分子中Se原子的杂化类型为
分子中Se原子的杂化类型为  镓元素在元素周期表中的位置是
镓元素在元素周期表中的位置是  价电子数少于价层轨道数
价电子数少于价层轨道数 ,其化合物可与具有孤对电子的分子或离子生成配合物,如
,其化合物可与具有孤对电子的分子或离子生成配合物,如 能与
能与 反应生成BF3·NH3,BF3·NH3的结构简式可表示为
反应生成BF3·NH3,BF3·NH3的结构简式可表示为  金刚砂
金刚砂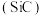 的晶胞结构如图所示:
的晶胞结构如图所示:
则在SiC中,每个C原子周围紧邻的C原子数目为
 。
。
您最近一年使用:0次
2020-01-13更新
|
153次组卷
|
2卷引用:2020届高三化学二轮每周大题必练— ——物质结构与性质
解答题-结构与性质
|
适中(0.65)
解题方法
5. 【化学一选修3: 物质结构与性质】1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属。所以钴及其化合物具有重要作用,回答下列问题:
(1)基态Co原子的电子排布式为___________ 。
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是__________ 。
②[Co(NH3)5H2O]Cl3中Co元素化合价为____ ,其配位原子为_____ ;1mol该晶体中含有____ molσ键。
③H2O2中O原子的杂化轨道类型是______ ,H2O2能与水互溶,除都是极性分子外,还因为____ 。
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是________ 。
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为_____ ;该晶胞中原子的空间利用率为__________ (用含a、b的计算式表示)。

(1)基态Co原子的电子排布式为
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是
②[Co(NH3)5H2O]Cl3中Co元素化合价为
③H2O2中O原子的杂化轨道类型是
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为

您最近一年使用:0次
2018-07-02更新
|
226次组卷
|
2卷引用:【全国市级联考】河南省平顶山市2017-2018学年高二下学期期末考试理科综合化学试题
解答题-原理综合题
|
适中(0.65)
解题方法
6. 氨是重要的化工原料,用途很广。
 合成氨工厂常用醋酸二氨合铜
合成氨工厂常用醋酸二氨合铜 由
由 和
和 构成
构成 溶液吸收对氨合成催化剂有毒害的CO气体。
溶液吸收对氨合成催化剂有毒害的CO气体。
 醋酸二氨合铜所含的元素中,第一电离能最大的是
醋酸二氨合铜所含的元素中,第一电离能最大的是 ______  填元素名称
填元素名称 。
。
 醋酸二氨合铜所含元素组成的单质,所属的晶体类型有
醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______  填标号
填标号 。
。
 离子晶体
离子晶体  分子晶体
分子晶体 原子晶体
原子晶体  金属晶体
金属晶体
 第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有
第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种 不含
不含 。
。
 气体与
气体与 相遇立即生成一种白色晶体:
相遇立即生成一种白色晶体: 。
。
 和
和 分子的空间构型分别为
分子的空间构型分别为 ______ 、 ______ 。
 晶体
晶体 中,B原子的杂化轨道类型为
中,B原子的杂化轨道类型为 ______ 。
 可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为
可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为 的物质。该物质易溶于水,在水溶液中以
的物质。该物质易溶于水,在水溶液中以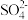 和
和 两种正四面体构型的离子存在。
两种正四面体构型的离子存在。 遇碱生成一种形似白磷的
遇碱生成一种形似白磷的 分子。
分子。

 下列相关说法中,正确的是
下列相关说法中,正确的是 ______  填序号
填序号 。
。
 是
是 的同分异构体
的同分异构体

 分解生成
分解生成 ,形成了4mol
,形成了4mol  键
键
 白磷的沸点比
白磷的沸点比 高,原因是
高,原因是 键键能比
键键能比 键大
键大
 白磷的化学性质比
白磷的化学性质比 活泼,说明P的非金属性比N强
活泼,说明P的非金属性比N强
 画出
画出 的结构
的结构 标明其中的配位键
标明其中的配位键 :
: ______ 。
 合成氨工厂常用醋酸二氨合铜
合成氨工厂常用醋酸二氨合铜 由
由 和
和 构成
构成 溶液吸收对氨合成催化剂有毒害的CO气体。
溶液吸收对氨合成催化剂有毒害的CO气体。  醋酸二氨合铜所含的元素中,第一电离能最大的是
醋酸二氨合铜所含的元素中,第一电离能最大的是  填元素名称
填元素名称 。
。 醋酸二氨合铜所含元素组成的单质,所属的晶体类型有
醋酸二氨合铜所含元素组成的单质,所属的晶体类型有  填标号
填标号 。
。 离子晶体
离子晶体  分子晶体
分子晶体 原子晶体
原子晶体 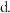 金属晶体
金属晶体  第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有
第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有  不含
不含 。
。 气体与
气体与 相遇立即生成一种白色晶体:
相遇立即生成一种白色晶体: 。
。  和
和 分子的空间构型分别为
分子的空间构型分别为  晶体
晶体 中,B原子的杂化轨道类型为
中,B原子的杂化轨道类型为  可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为
可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为 的物质。该物质易溶于水,在水溶液中以
的物质。该物质易溶于水,在水溶液中以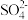 和
和 两种正四面体构型的离子存在。
两种正四面体构型的离子存在。 遇碱生成一种形似白磷的
遇碱生成一种形似白磷的 分子。
分子。 
 下列相关说法中,正确的是
下列相关说法中,正确的是  填序号
填序号 。
。 是
是 的同分异构体
的同分异构体 
 分解生成
分解生成 ,形成了4mol
,形成了4mol  键
键  白磷的沸点比
白磷的沸点比 高,原因是
高,原因是 键键能比
键键能比 键大
键大 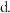 白磷的化学性质比
白磷的化学性质比 活泼,说明P的非金属性比N强
活泼,说明P的非金属性比N强  画出
画出 的结构
的结构 标明其中的配位键
标明其中的配位键 :
:
您最近一年使用:0次



