福建省泉州第十六中学2020-2021学年高二上学期期中考试化学(学考班)试题
福建
高二
期中
2020-12-23
138次
整体难度:
容易
考查范围:
化学反应原理、化学与STSE、认识化学科学、物质结构与性质、化学实验基础、常见无机物及其应用、有机化学基础、初中衔接知识点
一、单选题 添加题型下试题
| A.残余饭菜属于厨余垃圾,堆肥处理 |
| B.废报纸属于可回收垃圾,填埋处理 |
| C.废塑料属于有害垃圾,直接焚烧处理 |
| D.旧电池属于其他垃圾,随意丢弃处理 |
| A.氯水 | B.氮气 | C.海水 | D.沼气 |
【知识点】 无机物质的分类
| A.MgO | B.CO2 | C.HBr | D.H2O |
【知识点】 化学键概念理解及判断解读 化学键与物质类别关系的判断解读
| A.0.8 mol O2 |
| B.标准状况下22.4 L H2 |
| C.5.4 g H2O(H2O的摩尔质量为18g·mol-1) |
| D.0.6 NA个CO(NA为阿伏加德罗常数的值) |
【知识点】 阿伏加德罗常数
A.2Mg+CO2 2MgO+C 2MgO+C |
| B.NH3+HNO3=NH4NO3 |
| C.SiO2+2NaOH=Na2SiO3+H2O |
| D.Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
【知识点】 氧化还原反应的定义及实质
| A.铜与氯化铁溶液反应:Cu+Fe3+=Fe2++Cu2+ |
| B.氯气与溴化钠溶液反应:Cl2+Br-=Cl-+Br2 |
| C.稀硫酸与氢氧化钾溶液反应:H++OH-=H2O |
D.碳酸钠溶液与氯化钙溶液反应:CO +CaCl2=CaCO3↓+2Cl- +CaCl2=CaCO3↓+2Cl- |
【知识点】 离子方程式的正误判断解读 氯气 铜
| A.12C与13C | B.H2O与H2O2 | C.氧气与臭氧 | D.正丁烷与异丁烷 |
【知识点】 同分异构现象、同分异构体的概念解读 “四同”的相关比较解读

| A.分离硫酸钠和硫酸钡混合物 | B.除去氯气中混有少量氯化氢气体 |
| C.用氯化铵和熟石灰加热制取氨气 | D.配制100mL0.1mol·L-1氢氧化钠溶液 |
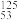 I可用于治疗肿瘤。下列关于
I可用于治疗肿瘤。下列关于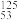 I的说法正确的是( )
I的说法正确的是( )| A.电子数为53 | B.质子数为72 | C.中子数为125 | D.质量数为178 |
【知识点】 原子的构成 原子的基本构成解读 原子中相关数值及其之间的相互关系解读

| A.CH4 | B.C6H6 | C.C2H4 | D.C2H6O |
【知识点】 有机物结构的表示方法解读 苯分子结构的特点解读
| A.往淀粉溶液滴入碘水后显紫色 |
| B.往氢氧化钠溶液滴入酚酞溶液后显蓝色 |
| C.往氯化铁溶液滴入KSCN溶液后显血红色 |
| D.往氯化钠溶液滴入硝酸银溶液后出现黄色沉淀 |
| A.氯气作自来水的杀菌消毒剂 |
| B.活性炭作呼吸面具的吸附剂 |
| C.还原铁粉作食品的抗氧化剂 |
| D.碳酸氢钠作焙制糕点的膨松剂 |
【知识点】 碳酸氢钠 化学科学对人类文明发展的意义解读 食品添加剂解读
A.H+、Na+、CO | B.Fe2+、Cl-、OH- |
C.Ba2+、K+、SO | D.Mg2+、NH 、NO 、NO |
【知识点】 无附加条件的离子共存解读 物质共存解读
A.CH4+Cl2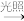 CH3Cl+HCl CH3Cl+HCl |
| B.CH2=CH2+Br2→CH2Br—CH2Br |
C.CH3CH2OH+3O2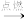 2CO2+3H2O 2CO2+3H2O |
D.CH3COOH+C2H5OH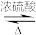 CH3COOC2H5+H2O CH3COOC2H5+H2O |
【知识点】 酯化反应解读 乙酸的酯化反应的机理解读
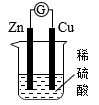
| 试管 | 等质量铁的形状 | 温度/℃ | 硫酸浓度/mol•L-1 |
| A | 铁片 | 25 | 0.5 |
| B | 铁粉 | 35 | 0.5 |
| C | 铁片 | 35 | 1.0 |
| D | 铁粉 | 35 | 2.0 |
| A.A | B.B | C.C | D.D |
【知识点】 浓度对化学反应速率的影响解读 温度对化学反应速率的影响解读
二、填空题 添加题型下试题
族 周期 | I | II | III | IV | V | VI | VII | 0 |
2 | C | N | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)非金属性最强的元素是
(2)属于稀有气体元素的是
(3)组成物质种类最多的元素是
(4)N与F的原子半径较大的是
(5)CH4与SiH4热稳定性较弱的是
(6)MgO与Al2O3中,能与强碱溶液反应的是
(7)最外层电子数为6的原子,其元素符号是
(8)某阳离子结构示意图为
 ,其离子符号是
,其离子符号是(9)Cl元素最高价氧化物对应水化物的化学式是
(10)Na的一种氧化物Na2O2,其中氧元素的化合价为
【知识点】 元素周期律的应用
A.甲烷B.乙烯C.乙酸D.油脂E.淀粉F.蛋白质
(1)最简单的烃是
(2)属于多糖的是
(3)动物毛发主要成分是
(4)分子式为C2H4O2的是
(5)工业上常用于制造肥皂的是
(6)分子呈平面结构且含有碳碳双键的是
(1)NO暴露在空气中,出现红棕色的原因是
(2)将食品置于低温条件下,常常可以保存更长时间的原因是
(3)盛有浓硫酸的容器敞口放置一段时间后,硫酸浓度变小的原因是
三、解答题 添加题型下试题

(1)将煤矸石粉碎的目的是
(2)步骤(I)中溶液A和沉淀分离的操作名称是
(3)步骤(Ⅱ)中溶液B含有的阴离子除Cl-、OH-外,还有
(4)步骤(Ⅲ)中溶液C的溶质含有NaHCO3,其俗称是
(5)步骤(Ⅳ)中Al(OH)3受热分解的化学方程式为
 CuSO4+SO2↑+2H2O,部分夹持仪器已略去】
CuSO4+SO2↑+2H2O,部分夹持仪器已略去】
【实验探究】
(1)装置(I)中仪器a的名称是
(2)实验进行一段时间后:
①装置(Ⅱ)中观察到紫色石蕊溶液颜色变为
②装置(Ⅲ)中观察到氯水颜色褪去,是因为SO2与氯水发生反应。补充完整该反应的化学方程式;SO2+Cl2+2H2O=H2SO4+2
(3)装置(Ⅳ)应从图中选用合适的尾气吸收装置是

(4)用3.2gCu与足量浓硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)该兴趣小组为进一步探究SO2的漂白性,依次进行如下实验。
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 品红溶液颜色 | SO2具有漂白性 |
| ② | 溶液恢复到原来颜色 | SO2的漂白具有 |
(6)硫酸是重要的化工产品。目前工业上主要采用接触法制硫酸,写出其中SO2与O2在一定条件下反应生成SO3的化学方程式:
I.在一定条件下,以CH4和H2O为原料,通过下列反应制备甲醇(CH3OH)。
已知:①CH4+H2O(g)
 CO(g)+3H2(g)△H=+206.0kJ·mol-1
CO(g)+3H2(g)△H=+206.0kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g)△H=-129.0kJ·mol-1
CH3OH(g)△H=-129.0kJ·mol-1(1)反应②的正反应属于
(2)上述两个反应达到平衡后,在其它条件不变的情况下,通过减小容器体积增大压强,则化学平衡向逆反应方向移动的是
(3)在密闭容器中发生①反应,若CH4起始浓度为2.0mol·L-1,水蒸气起始浓度为3.0mol·L-1,反应进行5min后,测得CH4浓度为0.5mol·L-1,则v(CH4)=
Ⅱ.常温下,浓度均为0.1mol·L-1的两种溶液;①氨水②NH4Cl溶液。
(4)写出①氨水中NH3·H2O的电离方程式:
(5)测得②溶液的pH<7,则溶液中c(NH
 )
)Ⅲ.如图所示装置,用惰性电极电解熔融氯化钠(2NaCl
 2Na+Cl2↑)。
2Na+Cl2↑)。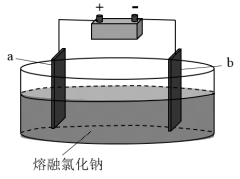
(6)通电时,C1-向
(7)电解一段时间后,在两个电极上分别生成金属钠和氯气。写出生成金属钠的电极反应式:
试卷分析
试卷题型(共 26题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 废弃电池的污染及回收 固体废弃物的处理 “白色污染”危害及防治 | |
| 2 | 0.94 | 无机物质的分类 | |
| 3 | 0.94 | 化学键概念理解及判断 化学键与物质类别关系的判断 | |
| 4 | 0.94 | 仪器使用与实验安全 实验安全 | |
| 5 | 0.94 | 阿伏加德罗常数 | |
| 6 | 0.94 | 氧化还原反应的定义及实质 | |
| 7 | 0.65 | 离子方程式的正误判断 氯气 铜 | |
| 8 | 0.94 | 同分异构现象、同分异构体的概念 “四同”的相关比较 | |
| 9 | 0.85 | 常用仪器及使用 化学实验基础操作 配制一定物质的量浓度的溶液实验的仪器 | |
| 10 | 0.94 | 原子的构成 原子的基本构成 原子中相关数值及其之间的相互关系 | |
| 11 | 0.85 | 有机物结构的表示方法 苯分子结构的特点 | |
| 12 | 0.94 | 常见阳离子的检验 常见阴离子的检验 化学实验 | |
| 13 | 0.85 | 分散系概念及其分类 胶体的性质和应用 | |
| 14 | 0.85 | 碳酸氢钠 化学科学对人类文明发展的意义 食品添加剂 | |
| 15 | 0.94 | 无附加条件的离子共存 物质共存 | |
| 16 | 0.85 | 酯化反应 乙酸的酯化反应的机理 | |
| 17 | 0.85 | 淀粉和纤维素组成与结构 常见合金的组成 橡胶 陶瓷 | |
| 18 | 0.85 | 原电池原理理解 原电池正负极判断 | |
| 19 | 0.85 | 水解反应 | |
| 20 | 0.94 | 浓度对化学反应速率的影响 温度对化学反应速率的影响 | |
| 二、填空题 | |||
| 21 | 0.85 | 元素周期律的应用 | |
| 22 | 0.94 | 乙烯分子的组成 乙酸“三式一型”书写及辨认 蛋白质的来源及作用 | |
| 23 | 0.85 | 一氧化氮的化学性质 浓硫酸的吸水性 温度对化学反应速率的影响 | |
| 三、解答题 | |||
| 24 | 0.65 | 含氧化铝的混合物的提纯 铝盐与强碱溶液反应 物质分离、提纯综合应用 常见无机物的制备 | 实验探究题 |
| 25 | 0.65 | 二氧化硫的漂白性 浓硫酸的强氧化性 铜与强氧化性酸的反应 综合实验设计与评价 | 实验探究题 |
| 26 | 0.65 | 热化学方程式书写及正误判断 化学反应速率计算 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |