铁、氯、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题。
(1)二氧化氯(ClO2)已逐步代替Cl2用于自来水处理,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。已知:25 ℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性HClO2________ HClO(填“>”“=”或“<”);在pH=5的上述处理过的饮用水中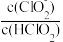 =
=___________ ;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________ 。
(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,下图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6,溶液中存在的金属阳离子为____________ (当溶液中金属离子浓度≤10-5mol·L-1时,可认为沉淀完全)。
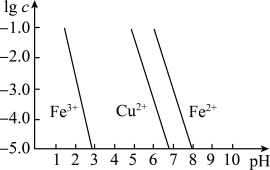
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=______________________ 。
(3)Na2S是常用的重金属离子沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是________________ ;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时的S2-浓度为___________________________ 。已知:Ksp(FeS)=6.3×10-18;Ksp(CuS)=6×10-36;Ksp(PbS)=2.4×10-18。
(1)二氧化氯(ClO2)已逐步代替Cl2用于自来水处理,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。已知:25 ℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性HClO2
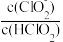 =
=(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,下图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6,溶液中存在的金属阳离子为

②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(3)Na2S是常用的重金属离子沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是
更新时间:2020-04-29 15:43:26
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】氢气是一种理想的绿色清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为___________ 。
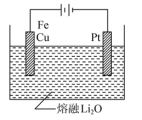
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为___________ 。
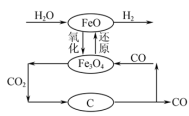
(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是___________ 。
(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。
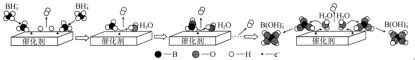
①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有___________ 。
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是___________ 。

(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为

(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是

(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。

①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
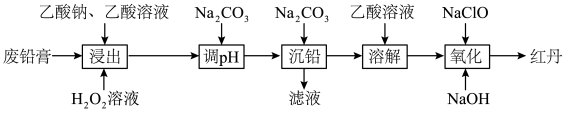
【推荐2】铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为 、
、 ,还有少量Pb、
,还有少量Pb、 、
、 )制取红丹(
)制取红丹( )的工艺流程如图:
)的工艺流程如图:
已知:①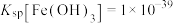 ;
; ;
;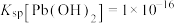 ;
;
②醋酸铅是弱电解质。
回答下列问题:
(1)粉碎镍废料、___________ 、___________ 等措施可以提高浸出速率。
(2)“浸出”时,加入乙酸、乙酸钠、 溶液可将含铅物质转化为
溶液可将含铅物质转化为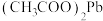 。
。 转化为
转化为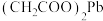 的化学方程式为
的化学方程式为___________ 。
(3)当金属离子浓度低于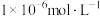 时,被认为沉淀完全,则“调pH”的范围是
时,被认为沉淀完全,则“调pH”的范围是___________ ~7.
(4)“沉铅”时,判断 完全沉淀的实验方法是
完全沉淀的实验方法是___________ 。
(5)“沉铅”后的滤液经除杂后可作为“回用液”循环利用。需要加入的除杂试剂是___________ 。
(6)“氧化”生成红丹的离子方程式为___________ 。
(7)若废铅膏中铅元素的质量分数为69%,用上述流程对1kg废铅膏进行处理,得到685g红丹,则铅的回收率为___________ %。
 、
、 ,还有少量Pb、
,还有少量Pb、 、
、 )制取红丹(
)制取红丹( )的工艺流程如图:
)的工艺流程如图:
已知:①
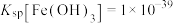 ;
; ;
;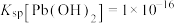 ;
;②醋酸铅是弱电解质。
回答下列问题:
(1)粉碎镍废料、
(2)“浸出”时,加入乙酸、乙酸钠、
 溶液可将含铅物质转化为
溶液可将含铅物质转化为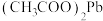 。
。 转化为
转化为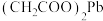 的化学方程式为
的化学方程式为(3)当金属离子浓度低于
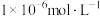 时,被认为沉淀完全,则“调pH”的范围是
时,被认为沉淀完全,则“调pH”的范围是(4)“沉铅”时,判断
 完全沉淀的实验方法是
完全沉淀的实验方法是(5)“沉铅”后的滤液经除杂后可作为“回用液”循环利用。需要加入的除杂试剂是
(6)“氧化”生成红丹的离子方程式为
(7)若废铅膏中铅元素的质量分数为69%,用上述流程对1kg废铅膏进行处理,得到685g红丹,则铅的回收率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】页岩气中含有 、
、 、
、 等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。
Ⅰ.Ni催化 加
加 形成
形成 ,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中
,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中 的百分含量及
的百分含量及 的转化率随温度的变化如图2所示。
的转化率随温度的变化如图2所示。

(1)260℃时生成主要产物所发生反应的化学方程式为___________ 。
(2)温度高于320℃, 的转化率下降的原因是
的转化率下降的原因是___________ 。
Ⅱ. 的处理:
的处理: 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的可能反应机理如图3所示。
再生的可能反应机理如图3所示。
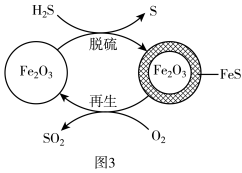
(3)再生时需控制通入 的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是___________ 。
(4)脱硫剂再生时可以使用水汽代替 。700℃条件下,用水汽代替
。700℃条件下,用水汽代替 再生时,生成
再生时,生成 、
、 和
和 ,
, 也可作脱硫剂。
也可作脱硫剂。
①写出水汽作用条件下脱硫剂再生反应的化学方程式:___________ 。
②用 再生时会生成污染性气体
再生时会生成污染性气体 ,用水汽再生时会排放出有毒的
,用水汽再生时会排放出有毒的 ,采用
,采用 和水汽混合再生的方法,可以将产生的
和水汽混合再生的方法,可以将产生的 和
和 转化为S单质。则为不排放出
转化为S单质。则为不排放出 和
和 ,理论上
,理论上 和水汽的体积比应为
和水汽的体积比应为___________ (写出计算过程)。
 、
、 、
、 等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。Ⅰ.Ni催化
 加
加 形成
形成 ,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中
,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中 的百分含量及
的百分含量及 的转化率随温度的变化如图2所示。
的转化率随温度的变化如图2所示。
(1)260℃时生成主要产物所发生反应的化学方程式为
(2)温度高于320℃,
 的转化率下降的原因是
的转化率下降的原因是Ⅱ.
 的处理:
的处理: 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的可能反应机理如图3所示。
再生的可能反应机理如图3所示。
(3)再生时需控制通入
 的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是(4)脱硫剂再生时可以使用水汽代替
 。700℃条件下,用水汽代替
。700℃条件下,用水汽代替 再生时,生成
再生时,生成 、
、 和
和 ,
, 也可作脱硫剂。
也可作脱硫剂。①写出水汽作用条件下脱硫剂再生反应的化学方程式:
②用
 再生时会生成污染性气体
再生时会生成污染性气体 ,用水汽再生时会排放出有毒的
,用水汽再生时会排放出有毒的 ,采用
,采用 和水汽混合再生的方法,可以将产生的
和水汽混合再生的方法,可以将产生的 和
和 转化为S单质。则为不排放出
转化为S单质。则为不排放出 和
和 ,理论上
,理论上 和水汽的体积比应为
和水汽的体积比应为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
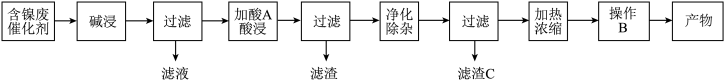
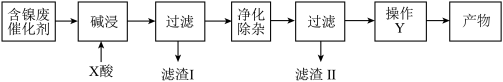
【推荐1】硫酸镍(NiSO4)是一种重要的化工原料,广泛应用于电镀、医药、印染等工业。以含镍废催化剂(主要含Ni及少量的Al、Al2O3、Fe和其它不溶于酸、碱的杂质)为原料生产NiSO4·7H2O晶体的两种工艺流程如下:
流程一:
流程二:
已知:部分金属氢氧化物的Ksp近似值如下表所示:
回答下列问题:
(1)流程一中所用酸A和流程二中所用酸X___________ (填“相同”或“不相同”);流程一中滤渣C和流程二中滤渣II___________ (填“相同”或“不相同”)。流程二中滤渣I是___________ 。
(2)流程一中“碱浸”时发生反应的离子方程式为_________________ 、___________________ 。
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,发生反应的离子方程式是____________________________________________ ;第二步,调节溶液的pH。
(4)分析比较流程一中操作B和流程二中操作Y后,回答操作Y是___________ 、___________ 、过滤、洗涤、干燥,即得产物。
(5)由已知信息列式计算:常温下,Ni2+完全沉淀时的pH值___________ 。
流程一:

流程二:

已知:部分金属氢氧化物的Ksp近似值如下表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
| Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
(1)流程一中所用酸A和流程二中所用酸X
(2)流程一中“碱浸”时发生反应的离子方程式为
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,发生反应的离子方程式是
(4)分析比较流程一中操作B和流程二中操作Y后,回答操作Y是
(5)由已知信息列式计算:常温下,Ni2+完全沉淀时的pH值
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】从钒铬锰铁矿渣(主要成分为 、
、 、
、 、
、 )中提
)中提 的一种工艺流程如下:
的一种工艺流程如下:
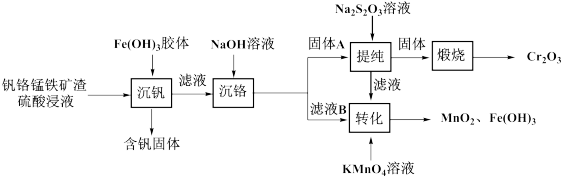
已知: 开始沉淀的
开始沉淀的 为6.3;
为6.3; 较大时,二价锰
较大时,二价锰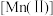 在空气中易被氧化。
在空气中易被氧化。
回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)常温下,各种形态五价钒粒子总浓度的对数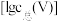 与
与 关系如图一、已知钒铬锰铁矿渣中
关系如图一、已知钒铬锰铁矿渣中 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为___________ 。(填化学式)

(3)某温度下, Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与 关系如图二、“沉铬”过程最佳
关系如图二、“沉铬”过程最佳 为
为___________ 。此时,滤液B中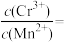
___________ 。 [已知:该温度下,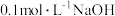 溶液的
溶液的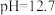 ,
, ,
,
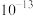 ]
]
(4)“提纯”过程中 的作用为
的作用为___________ 。
(5)“转化”过程中:
①除去 的离子方程式为___________
的离子方程式为___________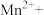 ___________
___________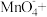 _____
_____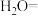 ______
______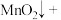 ___________
___________ (配平该方程式)
(配平该方程式) ____ 。
②写出除去 的离子方程式
的离子方程式____ (产物之一为 )。
)。
 、
、 、
、 、
、 )中提
)中提 的一种工艺流程如下:
的一种工艺流程如下:
已知:
 开始沉淀的
开始沉淀的 为6.3;
为6.3; 较大时,二价锰
较大时,二价锰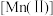 在空气中易被氧化。
在空气中易被氧化。回答下列问题:
(1)
 的电子式为
的电子式为(2)常温下,各种形态五价钒粒子总浓度的对数
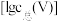 与
与 关系如图一、已知钒铬锰铁矿渣中
关系如图一、已知钒铬锰铁矿渣中 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为
(3)某温度下, Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与
 关系如图二、“沉铬”过程最佳
关系如图二、“沉铬”过程最佳 为
为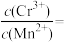
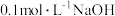 溶液的
溶液的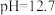 ,
, ,
,
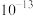 ]
](4)“提纯”过程中
 的作用为
的作用为(5)“转化”过程中:
①除去
 的离子方程式为___________
的离子方程式为___________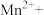 ___________
___________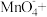 _____
_____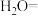 ______
______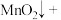 ___________
___________ (配平该方程式)
(配平该方程式) ②写出除去
 的离子方程式
的离子方程式 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】以废锌催化剂(主要成分为 及少量
及少量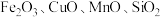 )为原料制备锌的流程如下:
)为原料制备锌的流程如下:
①“浸取”时,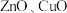 转化为
转化为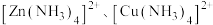 进入溶液;
进入溶液;
② 时,
时,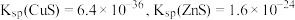 ;
;
③深度除杂标准:溶液中,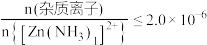 ;
;
(1)“滤渣1”的主要成分为 、
、_______ 。
(2)“深度除锰”是在碱性条件下将残留的 转化为
转化为 离子方程式为
离子方程式为_______ 。
(3)“深度除铜”时,锌的最终回收率,除铜效果{以反应后溶液中铜锌比 表示}与
表示}与 加入量[以
加入量[以 表示]的关系曲线如图所示。
表示]的关系曲线如图所示。 加入量
加入量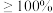 时,锌的最终回收率下降的原因是
时,锌的最终回收率下降的原因是_______ (用离子方程式表示),该反应的平衡常数为_______ (保留3位有效数字)。{已知 的
的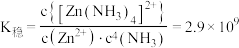 }
}
②“深度除铜”时 加入量最好应选
加入量最好应选_______ (填标号)。
A.90% B.100% C.110% D.120%
(4)“萃取”时有机萃取剂(用 表示)萃取金属离子的原理可表示为:
表示)萃取金属离子的原理可表示为: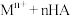 (有机层)
(有机层)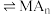 (有机层)
(有机层)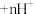 (水层)。“反萃取”的目的是将有机层
(水层)。“反萃取”的目的是将有机层 转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有
转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有_______ (答两点)。
(5) 存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。
存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。 晶体中
晶体中 的配位数为
的配位数为_______ 。
②图b闪锌矿型晶胞密度为 ,则
,则 与
与 的最近距离为
的最近距离为_______  。(设
。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 及少量
及少量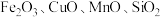 )为原料制备锌的流程如下:
)为原料制备锌的流程如下: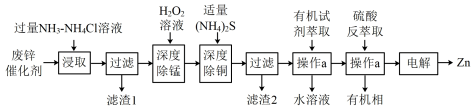
①“浸取”时,
 转化为
转化为 进入溶液;
进入溶液;②
 时,
时,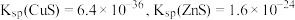 ;
;③深度除杂标准:溶液中,
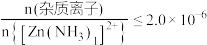 ;
;(1)“滤渣1”的主要成分为
 、
、(2)“深度除锰”是在碱性条件下将残留的
 转化为
转化为 离子方程式为
离子方程式为(3)“深度除铜”时,锌的最终回收率,除铜效果{以反应后溶液中铜锌比
 表示}与
表示}与 加入量[以
加入量[以 表示]的关系曲线如图所示。
表示]的关系曲线如图所示。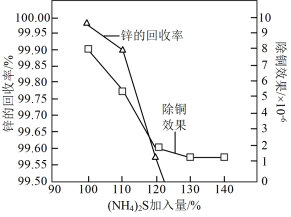
 加入量
加入量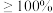 时,锌的最终回收率下降的原因是
时,锌的最终回收率下降的原因是 的
的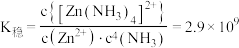 }
}②“深度除铜”时
 加入量最好应选
加入量最好应选A.90% B.100% C.110% D.120%
(4)“萃取”时有机萃取剂(用
 表示)萃取金属离子的原理可表示为:
表示)萃取金属离子的原理可表示为: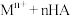 (有机层)
(有机层)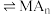 (有机层)
(有机层)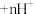 (水层)。“反萃取”的目的是将有机层
(水层)。“反萃取”的目的是将有机层 转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有
转移到水层,为尽可能多的提高反萃取率,应选择的实验条件或采取的实验操作有(5)
 存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。
存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。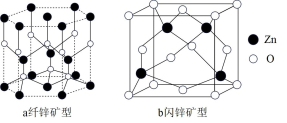
 晶体中
晶体中 的配位数为
的配位数为②图b闪锌矿型晶胞密度为
 ,则
,则 与
与 的最近距离为
的最近距离为 。(设
。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
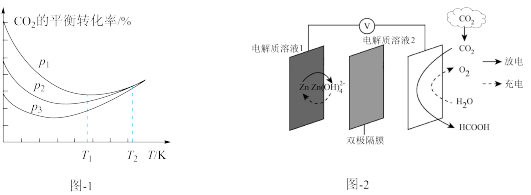
【推荐1】CO2资源化再生利用在解决环境和能源问题两个领域都极具重要意义。
(1)用CO2和H2为原料可合成燃料CH3OH,主要反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1
反应ⅢI:CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
①反应Ⅲ能够自发进行的原因是__ 。
②不同压强下,按n(CO2):n(H2)=1:3投料,测得CO2的平衡转化率随温度的变化关系如图1所示。压强p1__ p2(填“>”或“<”),T2温度时,曲线重合的原因是___ 。
(2)调节溶液pH可实现工业废气CO2的捕获和释放。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,c(H2CO3):c(HCO )=1:
)=1:__ 。
(3)NaBH4催化释氢。在催化剂作用下,NaBH4与水反应生成H2,可能的反应机理如图所示。
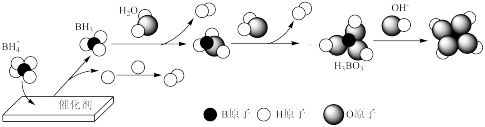
①其他条件不变时,以D2O代替H2O催化释氢,所得气体的分子式为___ 。
②已知:H3BO3为一元弱酸,H3BO3水溶液呈酸性的原因是___ (用离子方式表示)。
(4)一种新型Zn—CO2水介质电池示意图如图2,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸(HCOOH)。充电时电池总反应为__ ;放电时1molCO2转化为HCOOH,转移的电子数为___ mol。
(1)用CO2和H2为原料可合成燃料CH3OH,主要反应如下:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1反应Ⅱ:CO(g)+2H2(g)
 CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1反应ⅢI:CO2(g)+H2(g)
 CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3①反应Ⅲ能够自发进行的原因是
②不同压强下,按n(CO2):n(H2)=1:3投料,测得CO2的平衡转化率随温度的变化关系如图1所示。压强p1

(2)调节溶液pH可实现工业废气CO2的捕获和释放。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,c(H2CO3):c(HCO
 )=1:
)=1:(3)NaBH4催化释氢。在催化剂作用下,NaBH4与水反应生成H2,可能的反应机理如图所示。

①其他条件不变时,以D2O代替H2O催化释氢,所得气体的分子式为
②已知:H3BO3为一元弱酸,H3BO3水溶液呈酸性的原因是
(4)一种新型Zn—CO2水介质电池示意图如图2,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸(HCOOH)。充电时电池总反应为
您最近一年使用:0次
【推荐2】甲酸是一种有机化工原料,广泛用于农药、皮革、医药和橡胶等工业。请回答:
(1)活性Fe3O4-x催化反应 ,进而可制得甲酸。该反应的
,进而可制得甲酸。该反应的
_______ 0(填“>”或“<”),理由是_______ 。
(2)某温度下,HCOOH电离平衡常数为 ,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
_______ (电离度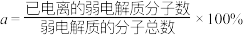 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。
(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.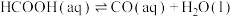
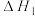
Ⅱ.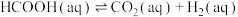
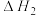
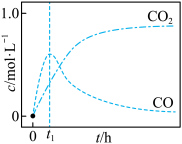
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/LHCOOH水溶液,分解产物均完全溶于水中。CO2、CO浓度与反应时间的变化关系如图所示。_______ 。
A.反应Ⅰ活化能小于反应Ⅱ
B.反应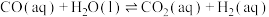
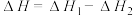
C.混合体系达平衡后: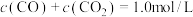
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,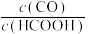 的值与未加盐酸时相同
的值与未加盐酸时相同
②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与反应时间的变化关系图_______ 。
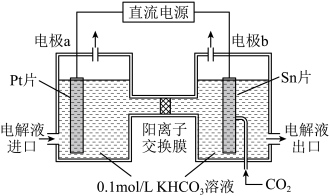
(4)一种由CO2电化学法合成甲酸盐的工作原理如图所示。电极b为_______ 极。电解一段时间后,若两侧电解液中K+的物质的量相差0.08mol,则阳极产生的气体在标准状况下的总体积为_______ L(假设产生的气体全部逸出)。
(1)活性Fe3O4-x催化反应
 ,进而可制得甲酸。该反应的
,进而可制得甲酸。该反应的
(2)某温度下,HCOOH电离平衡常数为
 ,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
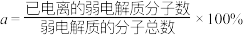 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.
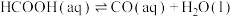
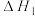
Ⅱ.
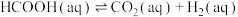
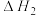
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/LHCOOH水溶液,分解产物均完全溶于水中。CO2、CO浓度与反应时间的变化关系如图所示。
A.反应Ⅰ活化能小于反应Ⅱ
B.反应
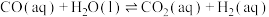
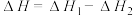
C.混合体系达平衡后:
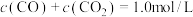
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,
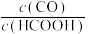 的值与未加盐酸时相同
的值与未加盐酸时相同②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与反应时间的变化关系图
(4)一种由CO2电化学法合成甲酸盐的工作原理如图所示。电极b为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
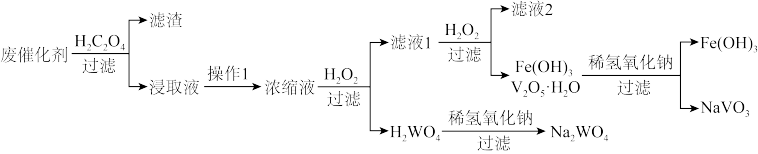
【推荐3】某废催化剂(主要含有WO3、V2O5、V2O4、V2O3、少量杂质Fe2O3、SiO2等)是能源行业产生的难处理多金属危险废物,其回收利用已成为当前研究的热点和重点。一种处理流程如下:
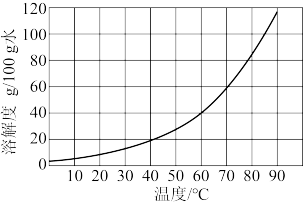
(1)已知草酸晶体(H2C2O4·2H2O)的溶解度随温度的变化如图所示。草酸酸浸时控制温度为90℃,理由是_______ ,实验室中宜选用的加热方式为_______ (“水浴加热”或“油浴加热”)。
(2)已知“浸取液”的主要成分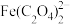 、
、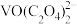 、
、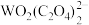 和过量的H2C2O4,滤渣的主要成分是
和过量的H2C2O4,滤渣的主要成分是_______ ;Fe2O3与H2C2O4的反应的离子方程式为_______ 。
(3)“浓缩液”经过两步氧化实现金属元素的分离。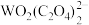 在溶液中存在平衡
在溶液中存在平衡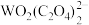
 WO2(C2O4)+
WO2(C2O4)+ ,WO2(C2O4)
,WO2(C2O4)
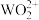 +
+  ,当溶液中的草酸氧化分解率到达67%时,
,当溶液中的草酸氧化分解率到达67%时,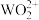 开始水解生成
开始水解生成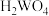 。
。
①写出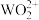 水解的离子方程式
水解的离子方程式_______ ;
②已知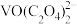 离子在溶液中也存在类似
离子在溶液中也存在类似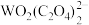 的电离平衡,下列有关
的电离平衡,下列有关 氧化
氧化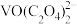 离子生成V2O5·H2O的说法错误的是
离子生成V2O5·H2O的说法错误的是_______ (填标号)。
A.加入 促使
促使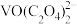 离子的电离平衡正向移动
离子的电离平衡正向移动
B.该过程涉及了2个以上的化学平衡
C.VO2+离子水解生成V2O5·H2O
(4)已知 K1;FeC2O4
K1;FeC2O4 Fe2++
Fe2++ K2,当“滤液1”中
K2,当“滤液1”中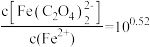 时,
时, 的浓度为
的浓度为_______ mol/L。(已知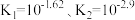 )
)

(1)已知草酸晶体(H2C2O4·2H2O)的溶解度随温度的变化如图所示。草酸酸浸时控制温度为90℃,理由是

(2)已知“浸取液”的主要成分
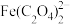 、
、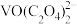 、
、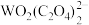 和过量的H2C2O4,滤渣的主要成分是
和过量的H2C2O4,滤渣的主要成分是(3)“浓缩液”经过两步氧化实现金属元素的分离。
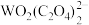 在溶液中存在平衡
在溶液中存在平衡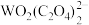
 WO2(C2O4)+
WO2(C2O4)+ ,WO2(C2O4)
,WO2(C2O4)
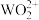 +
+  ,当溶液中的草酸氧化分解率到达67%时,
,当溶液中的草酸氧化分解率到达67%时,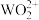 开始水解生成
开始水解生成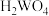 。
。①写出
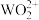 水解的离子方程式
水解的离子方程式②已知
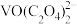 离子在溶液中也存在类似
离子在溶液中也存在类似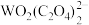 的电离平衡,下列有关
的电离平衡,下列有关 氧化
氧化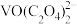 离子生成V2O5·H2O的说法错误的是
离子生成V2O5·H2O的说法错误的是A.加入
 促使
促使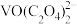 离子的电离平衡正向移动
离子的电离平衡正向移动B.该过程涉及了2个以上的化学平衡
C.VO2+离子水解生成V2O5·H2O
(4)已知
 K1;FeC2O4
K1;FeC2O4 Fe2++
Fe2++ K2,当“滤液1”中
K2,当“滤液1”中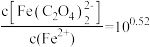 时,
时, 的浓度为
的浓度为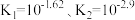 )
)
您最近一年使用:0次



