已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___ 。
A.H2C2O4+ =
= +
+ B.
B. +
+ =
= +
+
C.2 +CO2+H2O=2
+CO2+H2O=2 +
+ D.H2C2O4+
D.H2C2O4+ =
= +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
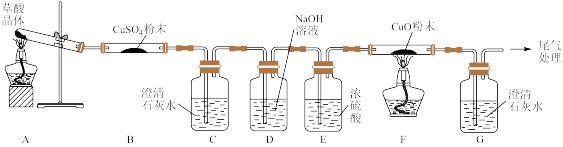
实验中观察到 B 中 CuSO4粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是___ , 证明有 CO 气体生成的现象是______ 。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1酸性 KMnO4溶液和 2 mL 0.1 mol·L-1H2C2O4溶液,再向乙试管中加入一粒黄豆大的 MnSO4固体,摇匀。填写表格:
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4的纯度。
实验步骤:准确称取 2.0 g Na2C2O4固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶 中,再向瓶中加入足量稀 H2SO4;用 0.016 0 mol·L-1 酸性 KMnO4溶液滴定,滴定至终点时消耗KMnO4溶液25.00 mL。
①KMnO4溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4的纯度是_________ 。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是
A.H2C2O4+
 =
= +
+ B.
B. +
+ =
= +
+
C.2
 +CO2+H2O=2
+CO2+H2O=2 +
+ D.H2C2O4+
D.H2C2O4+ =
= +H2O+CO2↑
+H2O+CO2↑(2)探究草酸分解产物

实验中观察到 B 中 CuSO4粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1酸性 KMnO4溶液和 2 mL 0.1 mol·L-1H2C2O4溶液,再向乙试管中加入一粒黄豆大的 MnSO4固体,摇匀。填写表格:
| 反应现象 | ① |
| 实验结论 | ② |
| 试管中发生反应的离子方程式 | ③ |
实验步骤:准确称取 2.0 g Na2C2O4固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶 中,再向瓶中加入足量稀 H2SO4;用 0.016 0 mol·L-1 酸性 KMnO4溶液滴定,滴定至终点时消耗KMnO4溶液25.00 mL。
①KMnO4溶液应装在
②Na2C2O4的纯度是
更新时间:2020-07-15 18:03:52
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是____________________ 。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的______________ 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去_____ (填离子符号),滤渣Ⅱ中含______ (填化学式)。加入H2C2O4时应避免过量,原因是_________________ 。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O Ba2++CrO42﹣═BaCrO4↓
步骤Ⅰ:移取x ml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L﹣1盐酸标准液滴定至终点,测得滴加的盐酸体积为V0 mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的______________ (填“上方”或“下方”)。BaCl2溶液的浓度为______________ mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______________ (填“偏大”或“偏小”)。

(1)毒重石用盐酸浸取前需充分研磨,目的是
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O Ba2++CrO42﹣═BaCrO4↓
步骤Ⅰ:移取x ml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L﹣1盐酸标准液滴定至终点,测得滴加的盐酸体积为V0 mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】滴定法是化学分析的常用方法,某兴趣小组利用滴定法进行如下实验。
【实验I】用 的
的 溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:
溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:
A.分别向碱式滴定管、酸式滴定管注入 标准溶液和待测醋酸至0刻度以上2~3cm
标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用 标准溶液滴定至终点,记下滴定管液面的刻度
标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2滴指示剂
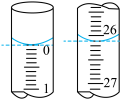
(1)①从上述实验步骤中选出正确的并按操作先后排序:______________ (用字母表示)。
②滴定开始和结束时读数若如图所示, 标准溶液的体积为
标准溶液的体积为__________ mL。
(2)有学生在实验过程中实验数据记录如下:
进行滴定操作时滴定管的正确操作应该是_______________ (填选项字母)。
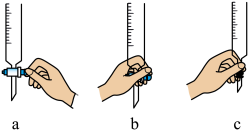
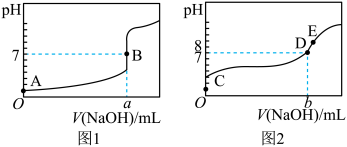
根据实验数据计算,c(待测液)_________ 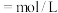 ,若滴定时标准液和待测液的浓度变大,滴定突跃范围变
,若滴定时标准液和待测液的浓度变大,滴定突跃范围变____________ (填“宽”“窄”)。
(3)常温下,若用 溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的
溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的 溶液的体积a
溶液的体积a______ b(填“>”“<”或“=”)。
(4)测定 的纯度。
的纯度。
称取ag样品,先用硫酸溶解,配成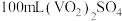 溶液,取20mL溶液置于锥形瓶中,再加入
溶液,取20mL溶液置于锥形瓶中,再加入 溶液
溶液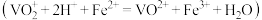 ,最后用
,最后用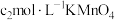 溶液滴定过量的
溶液滴定过量的 至
至___________________ (填现象)表示到达滴定终点.消耗 溶液的体积为
溶液的体积为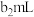 ,已知
,已知 被还原为
被还原为 ,
, 的质量分数是
的质量分数是__________ ( 的摩尔质量:
的摩尔质量: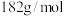 ),下列情况会导致产品纯度偏大的是
),下列情况会导致产品纯度偏大的是_________ (填标号)。
A. 溶液部分变质(含
溶液部分变质(含 ) B.滴定达终点时,仰视刻度线读数
) B.滴定达终点时,仰视刻度线读数
C.滴定前,在锥形瓶中加水稀释待测液 D.滴定终点时,滴定管尖嘴内有气泡生成
E. 溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
【实验I】用
 的
的 溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:
溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:A.分别向碱式滴定管、酸式滴定管注入
 标准溶液和待测醋酸至0刻度以上2~3cm
标准溶液和待测醋酸至0刻度以上2~3cmB.调节滴定管液面至0或0刻度以下,记下读数
C.用
 标准溶液滴定至终点,记下滴定管液面的刻度
标准溶液滴定至终点,记下滴定管液面的刻度D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2滴指示剂


(1)①从上述实验步骤中选出正确的并按操作先后排序:
②滴定开始和结束时读数若如图所示,
 标准溶液的体积为
标准溶液的体积为(2)有学生在实验过程中实验数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗 | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 1.10 | 21.00 |
3 | 25.00 | 2.20 | 22.20 |

根据实验数据计算,c(待测液)
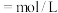 ,若滴定时标准液和待测液的浓度变大,滴定突跃范围变
,若滴定时标准液和待测液的浓度变大,滴定突跃范围变(3)常温下,若用
 溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的
溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的 溶液的体积a
溶液的体积a
(4)测定
 的纯度。
的纯度。称取ag样品,先用硫酸溶解,配成
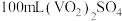 溶液,取20mL溶液置于锥形瓶中,再加入
溶液,取20mL溶液置于锥形瓶中,再加入 溶液
溶液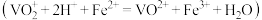 ,最后用
,最后用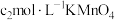 溶液滴定过量的
溶液滴定过量的 至
至 溶液的体积为
溶液的体积为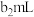 ,已知
,已知 被还原为
被还原为 ,
, 的质量分数是
的质量分数是 的摩尔质量:
的摩尔质量: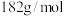 ),下列情况会导致产品纯度偏大的是
),下列情况会导致产品纯度偏大的是A.
 溶液部分变质(含
溶液部分变质(含 ) B.滴定达终点时,仰视刻度线读数
) B.滴定达终点时,仰视刻度线读数C.滴定前,在锥形瓶中加水稀释待测液 D.滴定终点时,滴定管尖嘴内有气泡生成
E.
 溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高,难挥发)有一定关系。
(1)室温下,测得0.1 mol/L H3PO4溶液的pH= 1.5,用电离方程式解释原因:_______ 。
(2)羟基磷酸钙[Ca5(PO4)3OH]是牙齿表面起保护作用的一层坚硬物质, 在唾液中存在如下平衡:Ca5(PO4)3OH(s) 5Ca2+(aq) +3
5Ca2+(aq) +3 (aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:
(aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:_______ 。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq) Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图。
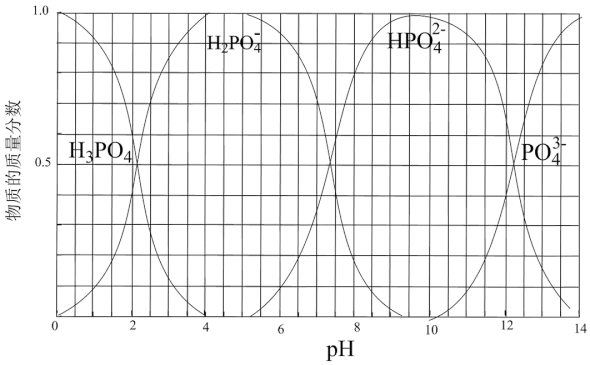
①向磷酸溶液中滴加NaOH溶液至pH = 10时发生的主要反应的离子方程式是_______ 。
②下列关于0.1 mol/L Na2HPO4溶液的说法正确的是_______ (填序号)。
a.Na2HPO4溶液显碱性,原因是 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+) + c(H+) = c(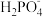 )+ 2c(
)+ 2c( ) + 3c(
) + 3c( )+ c(OH- )
)+ c(OH- )
c.c(Na+) = c(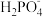 ) + c(
) + c( ) +c(
) +c( ) + c(H3PO4)
) + c(H3PO4)
(5)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ii.将可乐回流加热10 min,冷却至室温,过滤。
iii.取50.00 mL滤液,用百里香酚酞作指示剂,用0.100 mol/L NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00 mL。
①加热的目的是_______ 。
②该可乐样品中磷酸的含量为_______ g/L。
(1)室温下,测得0.1 mol/L H3PO4溶液的pH= 1.5,用电离方程式解释原因:
(2)羟基磷酸钙[Ca5(PO4)3OH]是牙齿表面起保护作用的一层坚硬物质, 在唾液中存在如下平衡:Ca5(PO4)3OH(s)
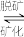 5Ca2+(aq) +3
5Ca2+(aq) +3 (aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:
(aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)
 Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。(4)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图。

①向磷酸溶液中滴加NaOH溶液至pH = 10时发生的主要反应的离子方程式是
②下列关于0.1 mol/L Na2HPO4溶液的说法正确的是
a.Na2HPO4溶液显碱性,原因是
 的水解程度大于其电离程度
的水解程度大于其电离程度b.c(Na+) + c(H+) = c(
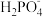 )+ 2c(
)+ 2c( ) + 3c(
) + 3c( )+ c(OH- )
)+ c(OH- )c.c(Na+) = c(
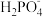 ) + c(
) + c( ) +c(
) +c( ) + c(H3PO4)
) + c(H3PO4)(5)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ii.将可乐回流加热10 min,冷却至室温,过滤。
iii.取50.00 mL滤液,用百里香酚酞作指示剂,用0.100 mol/L NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00 mL。
①加热的目的是
②该可乐样品中磷酸的含量为
您最近一年使用:0次
【推荐1】 作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I: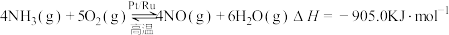
反应 II: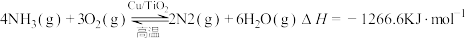
写出NO分解生成 与
与 的热化学方程式
的热化学方程式______ 。
(2)在恒温恒容装置中充入一定量的 和
和 ,在某催化剂的作用下进行反应I,测得不同时间的
,在某催化剂的作用下进行反应I,测得不同时间的 和
和 ,的浓度如表:
,的浓度如表:
则下列有关叙述中正确的是______ 。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 时,说明反应已达平衡
时,说明反应已达平衡
C.当容器内 时,说明反应已达平衡
时,说明反应已达平衡
D.前10分钟内的平均速率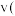

(3)氨催化氧化时会发生上述两个竞争反应I、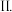 为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol  和2mol
和2mol  ,测得有关物质的量关系如图1:
,测得有关物质的量关系如图1:
①该催化剂在低温时选择反应______  填“I”或“II”
填“I”或“II” 。
。
② 时,
时, 的平衡常数
的平衡常数
______  不要求得出计算结果,只需列出数字计算式
不要求得出计算结果,只需列出数字计算式 。
。
③ 点比B点所产生的NO的物质的量少的主要原因
点比B点所产生的NO的物质的量少的主要原因______ 。
(4)合成氨工业会产生大量副产物 ,工业上常用高浓度的
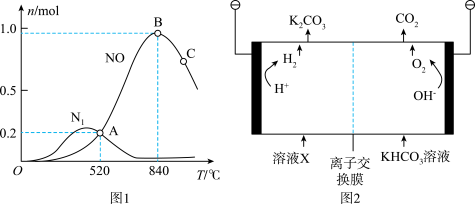
,工业上常用高浓度的 溶液吸收
溶液吸收 ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使 溶液再生,其装置如图2所示:
溶液再生,其装置如图2所示:
①在阳极区发生的反应包括______ 和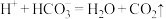 。
。
②简述 在阴极区再生的原理
在阴极区再生的原理______ 。
(5)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的 。
。
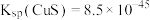
已知: 时,
时, ,
,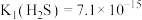 ,
,
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则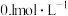 氢硫酸的
氢硫酸的
______  取近似整数
取近似整数 。
。
②已知,某废液接近于中性,若加入适量的氢硫酸,当废液中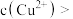
______ 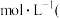 计算结果保留两位有效数字
计算结果保留两位有效数字 ,就会产生CuS沉淀。
,就会产生CuS沉淀。
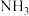 作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:
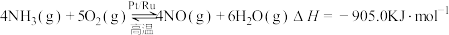
反应 II:
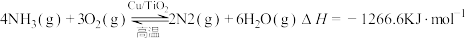
写出NO分解生成
 与
与 的热化学方程式
的热化学方程式(2)在恒温恒容装置中充入一定量的
 和
和 ,在某催化剂的作用下进行反应I,测得不同时间的
,在某催化剂的作用下进行反应I,测得不同时间的 和
和 ,的浓度如表:
,的浓度如表:时间 | 0 | 5 | 10 | 15 | 20 | 25 |
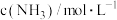 |  | 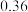 | 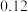 |  | 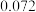 | 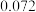 |
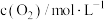 |  | 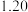 | 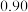 |  | 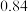 | 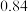 |
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内
 时,说明反应已达平衡
时,说明反应已达平衡C.当容器内
 时,说明反应已达平衡
时,说明反应已达平衡D.前10分钟内的平均速率
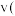

(3)氨催化氧化时会发生上述两个竞争反应I、
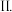 为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol  和2mol
和2mol  ,测得有关物质的量关系如图1:
,测得有关物质的量关系如图1:
①该催化剂在低温时选择反应
 填“I”或“II”
填“I”或“II” 。
。②
 时,
时, 的平衡常数
的平衡常数
 不要求得出计算结果,只需列出数字计算式
不要求得出计算结果,只需列出数字计算式 。
。③
 点比B点所产生的NO的物质的量少的主要原因
点比B点所产生的NO的物质的量少的主要原因(4)合成氨工业会产生大量副产物
 ,工业上常用高浓度的
,工业上常用高浓度的 溶液吸收
溶液吸收 ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使 溶液再生,其装置如图2所示:
溶液再生,其装置如图2所示:①在阳极区发生的反应包括
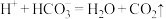 。
。②简述
 在阴极区再生的原理
在阴极区再生的原理(5)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的
 。
。已知:
 时,
时, ,
,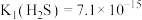 ,
,
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则
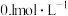 氢硫酸的
氢硫酸的
 取近似整数
取近似整数 。
。②已知,某废液接近于中性,若加入适量的氢硫酸,当废液中
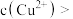
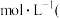 计算结果保留两位有效数字
计算结果保留两位有效数字 ,就会产生CuS沉淀。
,就会产生CuS沉淀。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】NO2和N2O4的相互转化2NO2(g) N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
Ⅰ.将N2O4 (g)转化为N2O4(l),可用来制备硝酸。
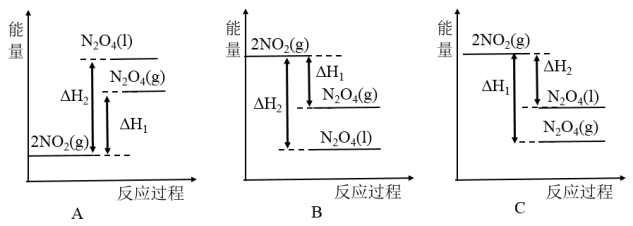
(1)已知2NO2(g) N2O4(g) △H1 2NO2(g)
N2O4(g) △H1 2NO2(g) N2O4(l) △H2
N2O4(l) △H2
下列能量变化示意图正确的是__________ 。
(2)NO2和N2O4物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为__________ 。
Ⅱ.对于2NO2(g) N2O4(g)反应体系,标准平衡常数Kθ=
N2O4(g)反应体系,标准平衡常数Kθ=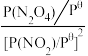 ,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
(1)若起始NO2的物质的量设为1mol,反应在恒定温度和标准压强下进行,N2O4的平衡产率为0.75,则Kθ=____________ 。
(2)利用现代手持技术传感器可以探究压强对2NO2(g) N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
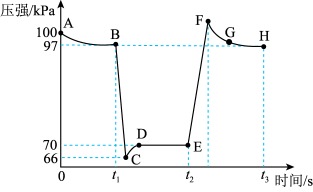
压强随时间变化的曲线
①B点时NO2的转化率为_______ 。
②E、H两点对应气体的平均相对分子质量ME____ MH(填“<、>或=”)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
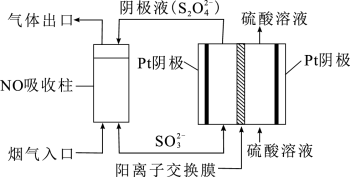
(3)①阴极区的电极反应式为_________ 。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为____ mL。
Ⅳ.常温下,将a mol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_____ (用含a和b的代数式表示)。
 N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:Ⅰ.将N2O4 (g)转化为N2O4(l),可用来制备硝酸。
(1)已知2NO2(g)
 N2O4(g) △H1 2NO2(g)
N2O4(g) △H1 2NO2(g) N2O4(l) △H2
N2O4(l) △H2下列能量变化示意图正确的是

(2)NO2和N2O4物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为
Ⅱ.对于2NO2(g)
 N2O4(g)反应体系,标准平衡常数Kθ=
N2O4(g)反应体系,标准平衡常数Kθ=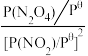 ,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。(1)若起始NO2的物质的量设为1mol,反应在恒定温度和标准压强下进行,N2O4的平衡产率为0.75,则Kθ=
(2)利用现代手持技术传感器可以探究压强对2NO2(g)
 N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
压强随时间变化的曲线
①B点时NO2的转化率为
②E、H两点对应气体的平均相对分子质量ME
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为
Ⅳ.常温下,将a mol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】高炉废渣在循环利用前.需要脱硫(硫元素主要存在形式为S2-,少量为SO32-和SO42-)处理。
(1)高温“两段法”氧化脱硫。第一阶段在空气中相关热化学方程式如下:
CaS(s)+2O2(g)= CaS04(s) △H=-907.1kJmol-1
CaS(s)+3/2O2(g)= CaO(s)+SO2(g) △H=-454.3kJmol-1
①第二阶段在惰性气体中,反应CaS(s)+3CaS04(s)=4CaO(s)+4SO2(g)的△H=________ kJmol-1。
②整个过程中,CaS完全转化生成1molS02,转移的电子数为_________ mol。
③生成的S02用硫酸铜溶液吸收电解氧化,总反应为CuS04+S02+2H20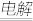 Cu+2H2S04。写出电解时阳极的电极反应式
Cu+2H2S04。写出电解时阳极的电极反应式__________ 。
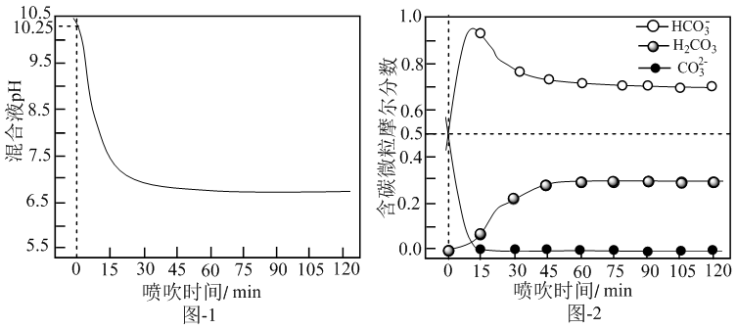
(2)喷吹C02脱硫。用水浸取炉渣,通入适量的C02,将硫元素以含硫气体形式脱去。当 C02的流量、温度一定时,渣-水混合液的pH、含碳元素各种微粒(H2C03、HCO3-、 CO32-)的分布随喷吹时间变化如图-1和图-2所示。_____________ (填字母)。
a.H2O2 b.BaCl2 c.CdCO3
②H2CO3第二步电离的电离常数为Ka2,则pKa2=_____________ (填数值,已知pKa2=—lgKa2)。
③通入CO215〜30min时,混合液中发生的主要脱硫反应离子方程式为_____________ 。
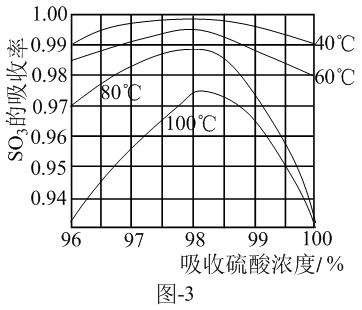
(3)硫酸工业生产中SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图-3,由图可知吸收SO3所用硫酸的适宜浓度为98.3%,温度_____________ ,而工业生产中一般采用60℃的可能原因是_____________ 。
(1)高温“两段法”氧化脱硫。第一阶段在空气中相关热化学方程式如下:
CaS(s)+2O2(g)= CaS04(s) △H=-907.1kJmol-1
CaS(s)+3/2O2(g)= CaO(s)+SO2(g) △H=-454.3kJmol-1
①第二阶段在惰性气体中,反应CaS(s)+3CaS04(s)=4CaO(s)+4SO2(g)的△H=
②整个过程中,CaS完全转化生成1molS02,转移的电子数为
③生成的S02用硫酸铜溶液吸收电解氧化,总反应为CuS04+S02+2H20
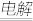 Cu+2H2S04。写出电解时阳极的电极反应式
Cu+2H2S04。写出电解时阳极的电极反应式(2)喷吹C02脱硫。用水浸取炉渣,通入适量的C02,将硫元素以含硫气体形式脱去。当 C02的流量、温度一定时,渣-水混合液的pH、含碳元素各种微粒(H2C03、HCO3-、 CO32-)的分布随喷吹时间变化如图-1和图-2所示。
a.H2O2 b.BaCl2 c.CdCO3
②H2CO3第二步电离的电离常数为Ka2,则pKa2=
③通入CO215〜30min时,混合液中发生的主要脱硫反应离子方程式为
(3)硫酸工业生产中SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图-3,由图可知吸收SO3所用硫酸的适宜浓度为98.3%,温度
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】2022年3月,我国科研团队准确测定了嫦娥五号带回的月壤样品中40多种元素的含量。研究人员曾在月壤中发现了辉钼矿(主要成分为MoS2,含有少量杂质),可用于制备钼酸钠晶体(Na2MoO4·2H2O),生产工艺如图。回答下列问题:
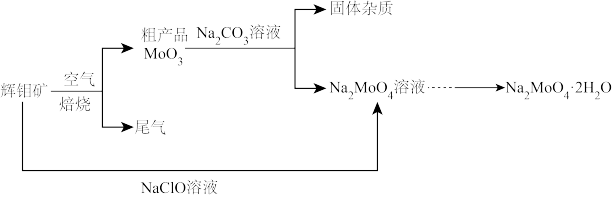
回答下列问题:
(1)焙烧时,采用逆流(空气从炉底进入,辉钼矿经粉碎后从炉顶进入)焙烧的目的是____ 。某些生产工艺在焙烧时加入CaCO3会更环保,其原因是____ (用化学方程式表示)。
(2)碱性条件下,也可将辉钼矿加入NaClO溶液中制得钼酸钠和硫酸盐,该反应的离子方程式为____ 。
(3)为得到高纯度的钼酸钠晶体,常需加入BaCl2固体除去Na2MoO4溶液中的SO 。若溶液中c(MoO
。若溶液中c(MoO )=0.40mol·L-1,c(SO
)=0.40mol·L-1,c(SO )=0.05mol·L-1,假设钼元素无损失,SO
)=0.05mol·L-1,假设钼元素无损失,SO 的最大去除率为
的最大去除率为____ %。[忽略溶液体积变化,已知:25℃,Ksp(BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10]。
(4)钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是____ (填字母)。
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。
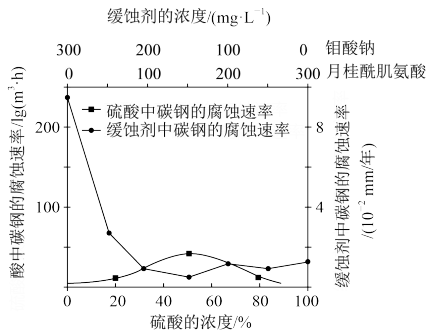
当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是____ 。若缓蚀剂为钼酸钠一月桂酰肌氨酸(总浓度为300mg·L-1),缓蚀效果最好时,钼酸钠(M=206g·mol-1)的物质的量浓度为____ mol·L-1(保留2位有效数字)。

回答下列问题:
(1)焙烧时,采用逆流(空气从炉底进入,辉钼矿经粉碎后从炉顶进入)焙烧的目的是
(2)碱性条件下,也可将辉钼矿加入NaClO溶液中制得钼酸钠和硫酸盐,该反应的离子方程式为
(3)为得到高纯度的钼酸钠晶体,常需加入BaCl2固体除去Na2MoO4溶液中的SO
 。若溶液中c(MoO
。若溶液中c(MoO )=0.40mol·L-1,c(SO
)=0.40mol·L-1,c(SO )=0.05mol·L-1,假设钼元素无损失,SO
)=0.05mol·L-1,假设钼元素无损失,SO 的最大去除率为
的最大去除率为(4)钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】我国有丰富的 资源,2020年10月,中科院工程研究所公布了利用
资源,2020年10月,中科院工程研究所公布了利用 制备重要工业用碱
制备重要工业用碱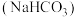 及盐
及盐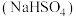 的闭路循环绿色工艺流程:
的闭路循环绿色工艺流程:

某校化学兴趣小组根据该流程在实验室中进行实验。回答下列问题:
(1)用以下实验装置图进行流程中的“一次反应”。
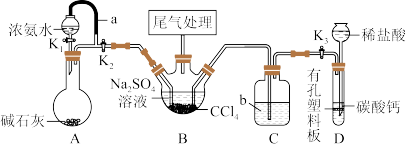
①装置A中橡皮管a的作用是_______ 。
②装置B中加入 的目的是
的目的是_______ 。
③装置C中的试剂b是_______ 。
(2)在“二次反应”中,硫酸铵溶液与过量的硫酸钠反应生成溶解度比较小的复盐 ,分离该复盐与溶液需要的玻璃仪器有
,分离该复盐与溶液需要的玻璃仪器有_______ 。
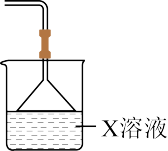
(3)依据该流程的闭路循环绿色特点,“一次反应”与“煅烧( )”的实验中均采用下图所示装置处理尾气,则烧杯中的X溶液最好选用
)”的实验中均采用下图所示装置处理尾气,则烧杯中的X溶液最好选用_______ 溶液。
(4)测定产品硫酸氢钠的纯度:称取 所得产品,配成
所得产品,配成 溶液,每次取出配制的溶液
溶液,每次取出配制的溶液 ,用
,用 标准溶液滴定,测得的实验数据如下表:
标准溶液滴定,测得的实验数据如下表:
所得产品硫酸氢钠的纯度为_______ (以百分数表示,保留三位有效数字)。
(5)分析上述流程图,写出利用该流程制备两种盐的总反应的化学方程式_______ 。
 资源,2020年10月,中科院工程研究所公布了利用
资源,2020年10月,中科院工程研究所公布了利用 制备重要工业用碱
制备重要工业用碱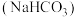 及盐
及盐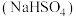 的闭路循环绿色工艺流程:
的闭路循环绿色工艺流程:
某校化学兴趣小组根据该流程在实验室中进行实验。回答下列问题:
(1)用以下实验装置图进行流程中的“一次反应”。

①装置A中橡皮管a的作用是
②装置B中加入
 的目的是
的目的是③装置C中的试剂b是
(2)在“二次反应”中,硫酸铵溶液与过量的硫酸钠反应生成溶解度比较小的复盐
 ,分离该复盐与溶液需要的玻璃仪器有
,分离该复盐与溶液需要的玻璃仪器有(3)依据该流程的闭路循环绿色特点,“一次反应”与“煅烧(
 )”的实验中均采用下图所示装置处理尾气,则烧杯中的X溶液最好选用
)”的实验中均采用下图所示装置处理尾气,则烧杯中的X溶液最好选用
(4)测定产品硫酸氢钠的纯度:称取
 所得产品,配成
所得产品,配成 溶液,每次取出配制的溶液
溶液,每次取出配制的溶液 ,用
,用 标准溶液滴定,测得的实验数据如下表:
标准溶液滴定,测得的实验数据如下表:| 序号 | 1 | 2 | 3 | 4 |
标准溶液体积/ | 20.05 | 18.40 | 19.95 | 20.00 |
(5)分析上述流程图,写出利用该流程制备两种盐的总反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某小组为测定化合物Co(NH3)yClx(其中Co为+3价)的组成,进行如下实验。
(1)氯的测定:准确称取2.675g该化合物,配成溶液后用1.00mol·L-1AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀(Ag2CrO4为砖红色)且不再消失时,消耗AgNO3溶液30.00mL。[已知:Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.12×10-12]
①AgNO3标准溶液需要放在棕色的滴定管中的原因是__ 。(用化学方程式表示)
②若滴定终点读数时滴定管下口悬挂了一滴液体,会使得测定结果__ 。(填“偏大”、“偏小”、“无影响”)
③用K2CrO4溶液作指示剂的理由是__ 。
(2)氨的测定:再准确称取2.675g该化合物,加适量水溶解,注入如图4___ 。(填仪器名称)中,然后通过仪器3滴加足量的NaOH溶液,加热1装置,产生的氨气被5中的盐酸吸收,多余的盐酸再用NaOH标准溶液反滴定,经计算,吸收氨气消耗1.00mol·L-1盐酸60.00mL。

装置A在整个实验中的作用是__ ,如果没有6中的冰盐水,会使得测定结果___ (填“偏大”、“偏小”、“无影响”)。
(3)通过处理实验数据可知该化合物的组成为___ 。
(1)氯的测定:准确称取2.675g该化合物,配成溶液后用1.00mol·L-1AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀(Ag2CrO4为砖红色)且不再消失时,消耗AgNO3溶液30.00mL。[已知:Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.12×10-12]
①AgNO3标准溶液需要放在棕色的滴定管中的原因是
②若滴定终点读数时滴定管下口悬挂了一滴液体,会使得测定结果
③用K2CrO4溶液作指示剂的理由是
(2)氨的测定:再准确称取2.675g该化合物,加适量水溶解,注入如图4

装置A在整个实验中的作用是
(3)通过处理实验数据可知该化合物的组成为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
(1)经检验,现象Ⅰ的白色沉淀为CuI,则反应的离子方程式为___ ,氧化产物与还原产物的物质的量之比为___ 。
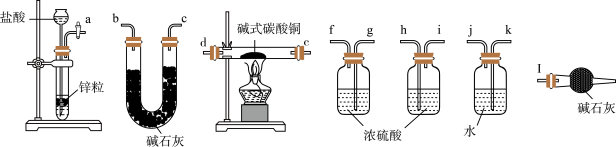
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3•yCu(OH)2•zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3•yCu(OH)2•zH2O与氢气反应的化学方程式___ ;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→___ →gf→___ →___ →___ →l
(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+ Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是___ 。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。

a.白色沉淀A是BaSO4,试剂Ⅰ是___ 。
b.证实沉淀中含有Cu2+和SO32-的理由是___ 。
| 实验 | 试剂 | 现象 | |
 | 滴管 | 试管 | |
| 0.2mol•L-1 CuSO4溶液 | 0.2mol•L-1NaI溶液 | Ⅰ.产生白色沉淀和黄色溶液 | |
| 0.2mol•L-1Na2CO3溶液 | Ⅱ.产生绿色沉淀和无色无味气体 | ||
| 0.2mol•L-1Na2SO3溶液 | Ⅲ.产生棕黄色沉淀 | ||
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3•yCu(OH)2•zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3•yCu(OH)2•zH2O与氢气反应的化学方程式
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+
 Cu+Cu2+
Cu+Cu2+①用稀硫酸证实沉淀中含有Cu+的实验现象是
②通过下列实验证实,沉淀中含有Cu2+和SO32-。

a.白色沉淀A是BaSO4,试剂Ⅰ是
b.证实沉淀中含有Cu2+和SO32-的理由是
您最近一年使用:0次
【推荐2】I.X是一种集洗涤、漂白、杀菌于一体的新型漂白剂(由四种短周期元素组成的纯净物),无毒无味,性能温和,且对环境友好。X从组成形式上可看成是某种正盐M与活性物质N的加合产物(mM·nN ,类似于结晶水合物,相对分子量不超过400)。现将X按如下流程实验,气体A能使带火星的木条复燃,固体B溶于水所得溶液显碱性,且焰色反应呈黄色。
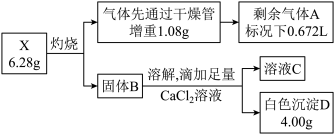
请回答:
(1)X中含有的非金属元素是_______ ,写出X灼烧的化学方程式是_______ 。
(2)向X的溶液中通入少量SO2,请写出离子方程式_______ 。
II.某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(3)该兴趣小组所记录的实验现象说明铜与铁离子的反应_______ (填有或没有)限度。
(4)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:_______ 、_______ 。
(5)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):_______ 。

请回答:
(1)X中含有的非金属元素是
(2)向X的溶液中通入少量SO2,请写出离子方程式
II.某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(3)该兴趣小组所记录的实验现象说明铜与铁离子的反应
(4)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:
(5)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】某同学为探究浅黄色液体X(仅含三种常见元素)的组成和性质,设计并完成如图实验:
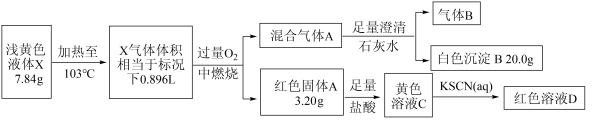
请回答如下问题:
(1)X中3种元素是_______ (用元素符号表示);气体B的摩尔质量为______ 。
(2)X在过量氧气中燃烧的化学方程式是_______ 。
(3)溶液C滴在淀粉-KI试纸上,试纸显蓝色,写出该变化中发生的离子方程式_______ 。
(4)用还原红色固体A,反应完全后生成黑色粉末(纯净物),黑色粉末的成分可能是_______ 。

请回答如下问题:
(1)X中3种元素是
(2)X在过量氧气中燃烧的化学方程式是
(3)溶液C滴在淀粉-KI试纸上,试纸显蓝色,写出该变化中发生的离子方程式
(4)用还原红色固体A,反应完全后生成黑色粉末(纯净物),黑色粉末的成分可能是
您最近一年使用:0次



