利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
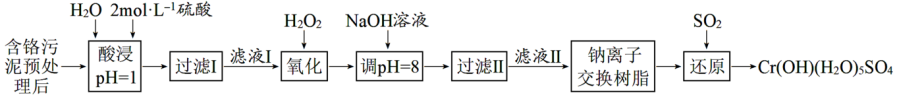
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O +H2O
+H2O 2CrO
2CrO +2H+
+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需________ 。
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O 转化为
转化为__________ (填微粒的化学式)。
(3)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______ 。
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:____________ 。
(5)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1 AgNO3标准溶液滴定待测液,已知:
①滴定时可选为滴定指示剂的是_______ (填编号),滴定终点的现象是_________ 。
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00mL,滴定终点时消耗AgNO3标准溶液10.00mL,则废水中SCN-的物质的量浓度为______________ 。

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+
+2H+③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O
 转化为
转化为(3)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:
(5)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1 AgNO3标准溶液滴定待测液,已知:
| 银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白色 | 黄色 | 白色 | 砖红色 | 白色 |
| Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
①滴定时可选为滴定指示剂的是
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00mL,滴定终点时消耗AgNO3标准溶液10.00mL,则废水中SCN-的物质的量浓度为
更新时间:2020-07-26 23:30:35
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】氧化锌是一种有独特物理化学性能的功能材料,广泛地应用于塑料、合成橡胶、电池、药膏、阻燃剂等产品的制作中。此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。工业上利用锌焙砂(主要成分为ZnO,含As2O3及铅、铜、镉的氧化物)生产高纯度氧化锌的工业流程如图所示:
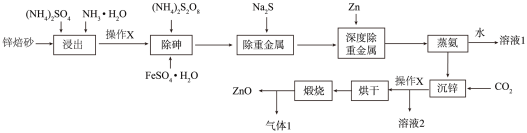
已知: As2O3微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
(1)Zn2+的简化电子排布式为___________________ 。
(2)操作X过程中,需用到的玻璃仪器有___________________ 、烧杯。
(3)“浸出”过程(NH4)2SO4和NH3·H2O按1:2参加反应生成了[ Zn(NH3)4]2+, 发生的离子反应方程式为____ 。
(4)“除砷”过程中,先加入过量的(NH4)2S2O8,然后再加入FeSO4·H2O,该过程中 (NH4)2S2O8过量的原因是________ 。
(5)已知三种硫化物的Ksp如表。当溶液中某离子物质的量浓度≤10-5mol · L-1时视为沉淀完全,则在加Na2S使Cu2+在溶液中的残留浓度为10-10mol·L-1时,Pb2+是否完全沉淀____ (填 “是”或“否”),理由是____________________________________________________________________________________________ (请列式计算说明)。
(6)流程中可循环利用的含氮物质有________________ (填物质化学式)。
(7)已知“蒸氨”后锌元素以Zn(NH3)2SO4存在,写出CO2“沉锌”的化学方程式_______________________ 。

已知: As2O3微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
(1)Zn2+的简化电子排布式为
(2)操作X过程中,需用到的玻璃仪器有
(3)“浸出”过程(NH4)2SO4和NH3·H2O按1:2参加反应生成了[ Zn(NH3)4]2+, 发生的离子反应方程式为
(4)“除砷”过程中,先加入过量的(NH4)2S2O8,然后再加入FeSO4·H2O,该过程中 (NH4)2S2O8过量的原因是
(5)已知三种硫化物的Ksp如表。当溶液中某离子物质的量浓度≤10-5mol · L-1时视为沉淀完全,则在加Na2S使Cu2+在溶液中的残留浓度为10-10mol·L-1时,Pb2+是否完全沉淀
物质 | CdS | CuS | PbS |
Ksp | 8.0× 10-27 | 6.3×10-36 | 8.0× 10-28 |
(7)已知“蒸氨”后锌元素以Zn(NH3)2SO4存在,写出CO2“沉锌”的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,以主要成分为CuFeS2的黄铜矿(含有杂质SiO2)为原料制取纳米Cu2O的一种工艺流程如图所示:
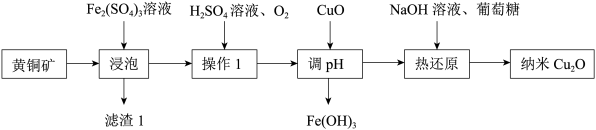
请回答下列问题:
(1)“滤渣1”中含有硫单质及_______ ,“浸泡”中反应的离子方程式为_______ 。
(2)“操作1”的目的是_______ 。
(3)“调pH”的过程中能否用CuCO3来代替CuO_______ (填“能”或“否”),要使Fe3+完全沉淀,则溶液的pH至少为_______ (已知该工艺条件下Ksp[Fe(OH)3]≈8×10-38,Kw≈1×10-14,lg2≈0.3,化学上认为当离子浓度小于1×10-5mol·L-1时沉淀完全)。
(4)“热还原”的实验现象是_______ 。
(5)现代工业也可用铜作电极,电解食盐水制备Cu2O,电解过程中首先生成CuCl(难溶于水),则生成氧化亚铜的化学方程式为_______ ;与用黄铜矿制备Cu2O工艺相比电解法的优点有_______ 。

请回答下列问题:
(1)“滤渣1”中含有硫单质及
(2)“操作1”的目的是
(3)“调pH”的过程中能否用CuCO3来代替CuO
(4)“热还原”的实验现象是
(5)现代工业也可用铜作电极,电解食盐水制备Cu2O,电解过程中首先生成CuCl(难溶于水),则生成氧化亚铜的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】金属及其化合物在生活中应用广泛。
Ⅰ.铁的腐蚀示意图如下所示:
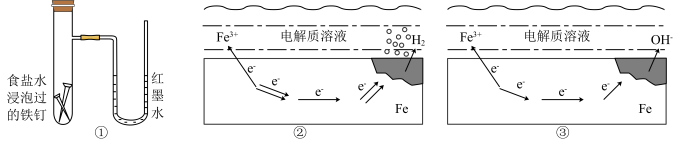
(1)装置①的反应原理和示意图__________ 的反应原理一致(填“②”或“③”)。
(2)装置图①U形管的现象是________ ,原因是_______ (用电极反应表示)。
Ⅱ.银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电场和照明器材等领域亦有广泛应用。某原电池装置如下图所示:
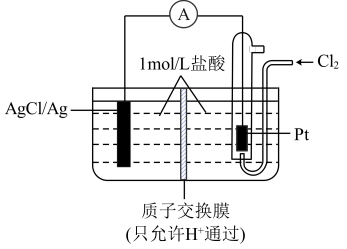
(3)负极的电极反应为__________ 。
(4)当电路中转移amole-时,交换膜左侧溶液中约减少__________ mol离子。
(5)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为__________ mol·L-1,pH为__________ 。
Ⅰ.铁的腐蚀示意图如下所示:

(1)装置①的反应原理和示意图
(2)装置图①U形管的现象是
Ⅱ.银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电场和照明器材等领域亦有广泛应用。某原电池装置如下图所示:

(3)负极的电极反应为
(4)当电路中转移amole-时,交换膜左侧溶液中约减少
(5)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某“84”消毒液部分标签如图所示,回答下列问题:
(1)某实验需用480mL0.2mol·L-1NaClO的消毒液,现用NaClO固体配制。
a.需要用托盘天平称量NaClO的固体质量为________ g;
b.配制时,一般可分为以下几个步骤:
①称量,②计算,③溶解,④摇匀,⑤移液,⑥洗涤,⑦定容,⑧冷却
正确的操作顺序为:________ (填序号)。
(2)在配制过程中,除需要托盘天平、烧杯、玻璃棒外还必需的仪器有_________________ 。
(3)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①容量瓶用蒸馏水洗净后,没烘干就直接使用:____________ 。
②溶解后未经冷却就移液:____________ 。
③移液时,有少量液体溅出:____________ 。
④定容时,俯视刻度线:____________ 。
| 净含量:500mL密度:1.19g·cm-3 主要成分:25%NaClO(NaClO的摩尔质量74.5g·mol-1) 注意事项:密封保存 |
a.需要用托盘天平称量NaClO的固体质量为
b.配制时,一般可分为以下几个步骤:
①称量,②计算,③溶解,④摇匀,⑤移液,⑥洗涤,⑦定容,⑧冷却
正确的操作顺序为:
(2)在配制过程中,除需要托盘天平、烧杯、玻璃棒外还必需的仪器有
(3)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①容量瓶用蒸馏水洗净后,没烘干就直接使用:
②溶解后未经冷却就移液:
③移液时,有少量液体溅出:
④定容时,俯视刻度线:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】用如图标签所示浓盐酸配制250mL0.4mol·L-1的稀盐酸,并进行有关实验。请回答:
(1)该浓盐酸的物质的量浓度为____ ,配制时需要量取浓盐酸___ mL。
(2)配制时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有___ 、__ 。
(3)配制溶液时有以下操作:①溶解②摇匀③洗涤并转移④冷却⑤量取⑥转移溶液⑦定容⑧装瓶贴标签,则正确的操作顺序是____ (填序号)。定容时的操作:当液面接近容量瓶刻度线时,___ ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)若实验遇到下列情况,所配溶液的浓度会(填“偏高”“偏低”或“不变”)
A.定容时仰视刻度线____ ;
B.容量瓶内壁附有水珠而未干燥处理____ ;
C.溶解后没有冷却便进行定容___ 。
| 容量:500mL分析纯 品名:浓盐酸 化学式:HCl 外观合格符合GB622-89 相对分子质量:36.5 质量分数:0.365 密度:1.18g·cm-3 试剂生产许可证编号:××× 上海××化学试剂厂 |
(2)配制时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
(3)配制溶液时有以下操作:①溶解②摇匀③洗涤并转移④冷却⑤量取⑥转移溶液⑦定容⑧装瓶贴标签,则正确的操作顺序是
(4)若实验遇到下列情况,所配溶液的浓度会(填“偏高”“偏低”或“不变”)
A.定容时仰视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.溶解后没有冷却便进行定容
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某学生配制 的
的 溶液
溶液 。
。
(1)若实验室提供20%的 浓溶液,密度约为
浓溶液,密度约为 ,其物质的量浓度是
,其物质的量浓度是_____  。
。
(2)配制时,必须使用的仪器有 烧杯、量筒、玻璃棒、胶头滴管和
烧杯、量筒、玻璃棒、胶头滴管和_______ 。
(3)实验过程中两次用到玻璃棒,其作用分别是:先用于_______ ,后用于______ 。
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是______ (填序号)。
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中未用少量水洗涤烧杯 次,并将洗涤液注入容量瓶
次,并将洗涤液注入容量瓶
④定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线
(5)若加蒸馏水时不慎超过了刻度,你将如何处理?___________ 。
 的
的 溶液
溶液 。
。(1)若实验室提供20%的
 浓溶液,密度约为
浓溶液,密度约为 ,其物质的量浓度是
,其物质的量浓度是 。
。(2)配制时,必须使用的仪器有
 烧杯、量筒、玻璃棒、胶头滴管和
烧杯、量筒、玻璃棒、胶头滴管和(3)实验过程中两次用到玻璃棒,其作用分别是:先用于
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中未用少量水洗涤烧杯
 次,并将洗涤液注入容量瓶
次,并将洗涤液注入容量瓶④定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线
(5)若加蒸馏水时不慎超过了刻度,你将如何处理?
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
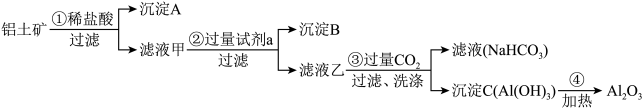
①沉淀 A、B的成分分别是____________ 、____________ ;步骤②中的试剂a是_________ ;(以上均填化学式)。
②试写出步骤③中发生反应的离子方程式______________ 、________________ ;
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2∙xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①加热酸溶过程中发生反应的化学方程式有:_______________________ 。
②氧化剂A可选用_________________ (填编号,下同)。
A.KMnO4 B.HNO3 C.Cl2
③要得到较纯的产品,试剂B可选用____________________ 。
A.NaOH B.CuO C.FeO
④试剂B的作用是_______________________________ 。
A.使Cu2+完全沉淀 B.使Fe3+完全沉淀 C.降低溶液的pH D.提高溶液的pH

①沉淀 A、B的成分分别是
②试写出步骤③中发生反应的离子方程式
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2∙xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①加热酸溶过程中发生反应的化学方程式有:
②氧化剂A可选用
A.KMnO4 B.HNO3 C.Cl2
③要得到较纯的产品,试剂B可选用
A.NaOH B.CuO C.FeO
④试剂B的作用是
A.使Cu2+完全沉淀 B.使Fe3+完全沉淀 C.降低溶液的pH D.提高溶液的pH
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上由MnS矿(还含少量 、MgO等)制备高纯硫酸锰,工艺流程图所示:
、MgO等)制备高纯硫酸锰,工艺流程图所示:
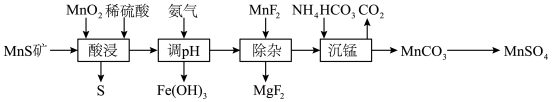
已知: 是一种有臭鸡蛋气味的有毒气体,其水溶液呈弱酸性。MnS难溶于水,HF是弱酸。
是一种有臭鸡蛋气味的有毒气体,其水溶液呈弱酸性。MnS难溶于水,HF是弱酸。
(1)“酸浸”,向硫酸溶液中加料方式为_______ (填序号)。
A.先加MnS矿,再加 B.先加
B.先加 ,再加MnS矿
,再加MnS矿
(2)“酸浸”过程中,生成S单质发生反应的离子方程式为_______ 。
(3)“调pH”时通入 后生成
后生成 的离子方程式为
的离子方程式为_______ ,氨气极易溶于水的主要原因是_______ 。
(4)“除杂”时若溶液pH过低, 沉淀不完全,可能的原因是
沉淀不完全,可能的原因是_______ 。
(5)“沉锰”反应的化学方程式为_______ 。
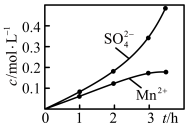
(6)用 悬浊液吸收
悬浊液吸收 也可以制取
也可以制取 。将
。将 和空气的混合气通入
和空气的混合气通入 悬浊液,测得吸收液中
悬浊液,测得吸收液中 、
、 的浓度随反应时间t变化如图。导致
的浓度随反应时间t变化如图。导致 、
、 浓度变化产生明显差异的原因是
浓度变化产生明显差异的原因是_______ 。
 、MgO等)制备高纯硫酸锰,工艺流程图所示:
、MgO等)制备高纯硫酸锰,工艺流程图所示:
已知:
 是一种有臭鸡蛋气味的有毒气体,其水溶液呈弱酸性。MnS难溶于水,HF是弱酸。
是一种有臭鸡蛋气味的有毒气体,其水溶液呈弱酸性。MnS难溶于水,HF是弱酸。(1)“酸浸”,向硫酸溶液中加料方式为
A.先加MnS矿,再加
 B.先加
B.先加 ,再加MnS矿
,再加MnS矿(2)“酸浸”过程中,生成S单质发生反应的离子方程式为
(3)“调pH”时通入
 后生成
后生成 的离子方程式为
的离子方程式为(4)“除杂”时若溶液pH过低,
 沉淀不完全,可能的原因是
沉淀不完全,可能的原因是(5)“沉锰”反应的化学方程式为
(6)用
 悬浊液吸收
悬浊液吸收 也可以制取
也可以制取 。将
。将 和空气的混合气通入
和空气的混合气通入 悬浊液,测得吸收液中
悬浊液,测得吸收液中 、
、 的浓度随反应时间t变化如图。导致
的浓度随反应时间t变化如图。导致 、
、 浓度变化产生明显差异的原因是
浓度变化产生明显差异的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】有机化合物的制备是有机化学研究的重要任务之一、某化学小组采用类似制乙酸乙酯的装置如图,以环己醇制备环己烯
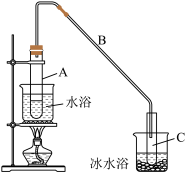
已知: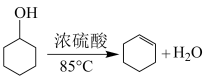
第一步:制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
(1)A中碎瓷片的作用是___________ ,导管B除了导气外还具有的作用是___________ 。
(2)试管C置于冰水浴中的目的是___________ 。
第二步:制备精品
(3)环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在___________ 层(填上或下),分液后用___________ (填入编号)洗涤。
A. 溶液 B.稀
溶液 B.稀 C.
C. 溶液
溶液
(4)再将环己烯按下图装置蒸馏,冷却水从___________ 口进入(填写“g”或“f”)。蒸馏时要加入生石灰,目的是___________ 。

(5)收集产品时,控制的温度应在___________ 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___________
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出

已知:

密度( ) ) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
(1)A中碎瓷片的作用是
(2)试管C置于冰水浴中的目的是
第二步:制备精品
(3)环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在
A.
 溶液 B.稀
溶液 B.稀 C.
C. 溶液
溶液(4)再将环己烯按下图装置蒸馏,冷却水从

(5)收集产品时,控制的温度应在
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
【氯化铁】熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
【氯化亚铁】熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。
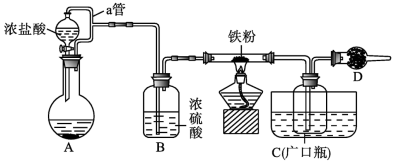
请回答下列问题。
(1)在装置A中,a管的作用是___________ ,用 与浓盐酸反应制取氯气的化学方程式为
与浓盐酸反应制取氯气的化学方程式为____________ 。
(2)仪器D的名称是___________ ,D中装的药品是碱石灰,其作用是___________ 。
(3)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60 g产品溶于过量的稀盐酸中;②加入足量的氯水;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40 g。
则该样品中铁元素的质量分数为___________ %(保留一位小数)。
(4)用题中所给的装置制得的产品中会含有氯化亚铁杂质,从而导致铁元素含量___________ (填“相等”“偏高”或“偏低”)。为避免产生氯化亚铁杂质,对题中所给的装置提出一种合理的改进方法:_______________________________ 。
【氯化铁】熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
【氯化亚铁】熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。

请回答下列问题。
(1)在装置A中,a管的作用是
 与浓盐酸反应制取氯气的化学方程式为
与浓盐酸反应制取氯气的化学方程式为(2)仪器D的名称是
(3)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60 g产品溶于过量的稀盐酸中;②加入足量的氯水;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40 g。
则该样品中铁元素的质量分数为
(4)用题中所给的装置制得的产品中会含有氯化亚铁杂质,从而导致铁元素含量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】 是中学常用的氧化剂。实验室制备
是中学常用的氧化剂。实验室制备 并探究其性质:
并探究其性质:
实验一:制备 。①高温下,在熔融KOH中用
。①高温下,在熔融KOH中用 氧化
氧化 制备
制备 ;②水浸后冷却,调整溶液pH至弱碱性,
;②水浸后冷却,调整溶液pH至弱碱性, 歧化生成
歧化生成 和
和 ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得
;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得 。
。
(1)步骤①选择_______(填字母)。
(2)步骤②中发生反应的离子方程式为_______ 。
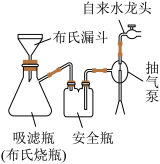
(3)利用如图所示装置过滤。减压过滤的优点是_______ (答一条即可)。用饱和高锰酸钾溶液洗涤 晶体的操作是
晶体的操作是_______ 。
实验二:探究 性质。在5.0mL 0.1
性质。在5.0mL 0.1
 溶液(含稀硫酸)中加入10.0mL 0.5
溶液(含稀硫酸)中加入10.0mL 0.5
 溶液,测得
溶液,测得 体积(V)与时间(t)关系如图所示。
体积(V)与时间(t)关系如图所示。
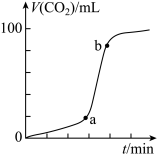
(4)关于ab段速率“突增”的原因(不考虑热效应),有同学猜想:可能是 对反应起催化作用。为了证实其猜想,请完成下列实验方案。
对反应起催化作用。为了证实其猜想,请完成下列实验方案。
实验结果, ,上述猜想正确。①
,上述猜想正确。①_______ ;②_______ 。
实验三:测定 样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入
样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入 mL
mL

 溶液(过量),充分反应后,用
溶液(过量),充分反应后,用
 标准
标准 溶液滴定至终点,消耗滴定液
溶液滴定至终点,消耗滴定液 mL。
mL。
(5)滴定终点现象是_______ 。
(6)该样品纯度为_______ (用含m、 、
、 、
、 、
、 的式子表示)。若滴定
的式子表示)。若滴定 溶液前俯视读数,滴定后仰视读数,则测得结果
溶液前俯视读数,滴定后仰视读数,则测得结果_______ (填“偏高”“偏低”或“无影响”)。
 是中学常用的氧化剂。实验室制备
是中学常用的氧化剂。实验室制备 并探究其性质:
并探究其性质:实验一:制备
 。①高温下,在熔融KOH中用
。①高温下,在熔融KOH中用 氧化
氧化 制备
制备 ;②水浸后冷却,调整溶液pH至弱碱性,
;②水浸后冷却,调整溶液pH至弱碱性, 歧化生成
歧化生成 和
和 ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得
;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得 。
。(1)步骤①选择_______(填字母)。
| A.瓷坩埚 | B.铝坩埚 | C.铁坩埚 | D.石英坩埚 |
(3)利用如图所示装置过滤。减压过滤的优点是
 晶体的操作是
晶体的操作是
实验二:探究
 性质。在5.0mL 0.1
性质。在5.0mL 0.1
 溶液(含稀硫酸)中加入10.0mL 0.5
溶液(含稀硫酸)中加入10.0mL 0.5
 溶液,测得
溶液,测得 体积(V)与时间(t)关系如图所示。
体积(V)与时间(t)关系如图所示。
(4)关于ab段速率“突增”的原因(不考虑热效应),有同学猜想:可能是
 对反应起催化作用。为了证实其猜想,请完成下列实验方案。
对反应起催化作用。为了证实其猜想,请完成下列实验方案。| 实验 | 0.1  (aq)(含稀硫酸) (aq)(含稀硫酸) | 0.5  (aq) (aq) | 添加物质 | 记录溶液褪色时间/s |
| Ⅰ | 2.0mL | 2.0mL | 无 |  |
| Ⅱ | ①_______。 | 2.0mL | ②_______。 |  |
 ,上述猜想正确。①
,上述猜想正确。①实验三:测定
 样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入
样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入 mL
mL

 溶液(过量),充分反应后,用
溶液(过量),充分反应后,用
 标准
标准 溶液滴定至终点,消耗滴定液
溶液滴定至终点,消耗滴定液 mL。
mL。(5)滴定终点现象是
(6)该样品纯度为
 、
、 、
、 、
、 的式子表示)。若滴定
的式子表示)。若滴定 溶液前俯视读数,滴定后仰视读数,则测得结果
溶液前俯视读数,滴定后仰视读数,则测得结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】石墨烯铜复合材料的电导率高,韧性好,可用于制备高铁的“超级导线”。某化学小组用如下组装装置测定其中的碳含量(铜、碳以外的成分不与浓硫酸反应)。
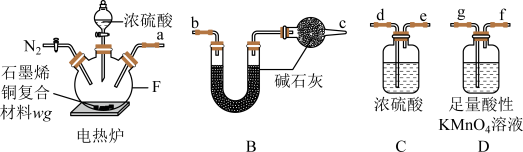
(1)纳米材料之一的石墨烯的同素异形体有多种,写出其中一种同素异形体的名称_____ 。
(2)装置接口的连接顺序为_____ 。
(3)A装置中反应容器F的名称为_____ ,装置B中球形干燥管中碱石灰的作用为_____ 。
(4)实验前后,各通入一次 ,将装置中的气体全部赶入到
,将装置中的气体全部赶入到 型管中,第一次通入
型管中,第一次通入 的作用是
的作用是_____ 。
(5)碳与浓硫酸反应的化学方程式为_____ 。
(6)装置D中发生反应的离子方程式_____ 。
(7)实验结束后,B装置中 型管增重
型管增重 ,则碳含量(质量分数)为
,则碳含量(质量分数)为_____ 。

(1)纳米材料之一的石墨烯的同素异形体有多种,写出其中一种同素异形体的名称
(2)装置接口的连接顺序为
(3)A装置中反应容器F的名称为
(4)实验前后,各通入一次
 ,将装置中的气体全部赶入到
,将装置中的气体全部赶入到 型管中,第一次通入
型管中,第一次通入 的作用是
的作用是(5)碳与浓硫酸反应的化学方程式为
(6)装置D中发生反应的离子方程式
(7)实验结束后,B装置中
 型管增重
型管增重 ,则碳含量(质量分数)为
,则碳含量(质量分数)为
您最近一年使用:0次



