氮、碳氧化物的排放会对环境造成污染。多年来化学工作者对氮、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
第一步:2NO(g)⇌N2O2(g)(快) ∆H1<0;v1正=k1正c2(NO); v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)⇌2NO2(g)(慢 )∆H2<0;v2正=k2正c(N2O2)c(O2); v2逆=k2逆c2(NO2)
①在两步的反应中,哪一步反应的活化能更大______ (填“第一步”或“第二步”)。
②一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_______ ;
II.(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中部分反应的热化方程式为:
①CH4(g)=C(s)+2H2(g) ΔH1>0
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=_________ (用含ΔH1、ΔH2、ΔH3的代数式表示)
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(正)_____ v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=____ 。
III.设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中电解制备过程的总反应化学方程式为________ 。

I.已知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
第一步:2NO(g)⇌N2O2(g)(快) ∆H1<0;v1正=k1正c2(NO); v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)⇌2NO2(g)(慢 )∆H2<0;v2正=k2正c(N2O2)c(O2); v2逆=k2逆c2(NO2)
①在两步的反应中,哪一步反应的活化能更大
②一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
II.(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中部分反应的热化方程式为:
①CH4(g)=C(s)+2H2(g) ΔH1>0
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(正)
III.设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中电解制备过程的总反应化学方程式为

更新时间:2020-11-18 09:14:25
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为_______ (用化学方程式表示,该反应为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因_______ 。
(2)①NH3去除尾气中NOx的,当V(NO)∶V(NO2)=1∶1时称为“快速SCR反应”,该反应化学方程式为:_______ 。
②合成NH3所用的原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+0.5O2(g)=CO2(g) ∆H1=-282.0 kJ·mol-1
H2(g)+0.5O2(g)=H2O(g) ∆ H 2=-241.8 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆ H 3=-836.3 kJ·mol-1
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:_______ 。
Ⅱ.(1)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
已知反应:N2(g)+O2(g)⇌2NO(g) ∆ H 1=+180.5 kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆ H 2
已知CO的燃烧热为283.0 kJ·mol-1,则∆ H 2=_______ 。
(2)氢能源是最具应用前景的能源之一,高纯氢制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接_______ 。产生H2的电极反应式是_______ 。
②改变开关连接方式,可得O2,制O2时,电极3的电极反应式是_______ 。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为
(2)①NH3去除尾气中NOx的,当V(NO)∶V(NO2)=1∶1时称为“快速SCR反应”,该反应化学方程式为:
②合成NH3所用的原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+0.5O2(g)=CO2(g) ∆H1=-282.0 kJ·mol-1
H2(g)+0.5O2(g)=H2O(g) ∆ H 2=-241.8 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆ H 3=-836.3 kJ·mol-1
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
Ⅱ.(1)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
已知反应:N2(g)+O2(g)⇌2NO(g) ∆ H 1=+180.5 kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆ H 2
已知CO的燃烧热为283.0 kJ·mol-1,则∆ H 2=
(2)氢能源是最具应用前景的能源之一,高纯氢制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接
②改变开关连接方式,可得O2,制O2时,电极3的电极反应式是
您最近一年使用:0次
【推荐2】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获。其原理如下图所示:

(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________ (填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______ 0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________ 。

③下列措施可提高反应ii中甲烷平衡转化率和反应速率的是_______ 。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.升温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:______________________________________________________ 。
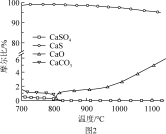
(3)空气反应器中发生的反应为CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________ 反应。
②在天然气燃烧过程中,可循环利用的物质为________ 。
(4)该原理总反应的热化学方程式为_____________________________________________ 。

(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为
②反应i和ii的平衡常数Kp与温度的关系如图1,则a

③下列措施可提高反应ii中甲烷平衡转化率和反应速率的是
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.升温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:

(3)空气反应器中发生的反应为CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为
②在天然气燃烧过程中,可循环利用的物质为
(4)该原理总反应的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】 是大气主要污染物之一,有效去除大气中的
是大气主要污染物之一,有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)在一定条件下,CO可以去除烟气中的 ,其反应过程分三步完成(Cat表示催化剂,[]表示空穴):
,其反应过程分三步完成(Cat表示催化剂,[]表示空穴):
ⅰ.Cat[]
ⅱ.Cat[]
ⅲ.……
写出第ⅲ步反应的方程式:___________ 。
(2)温度为T℃时,在一个容积为10L的恒容密闭容器中,充入1molCO和0.5mol 在催化剂作用下发生反应:
在催化剂作用下发生反应: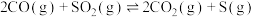
 。实验测得生成的
。实验测得生成的 的体积分数(φ)随着时间的变化曲线如图所示。
的体积分数(φ)随着时间的变化曲线如图所示。

①从反应开始到刚达到平衡,CO平均反应速率
___________ 。
②该温度下反应的平衡常数
___________ (填数值)。
③其它条件保持不变,再向上述平衡体系中充入 、
、 、
、 、
、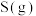 各0.2mol,再次达到平衡前v(正)
各0.2mol,再次达到平衡前v(正)___________ v(逆)(选填>、<或=)。
(3)现以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,用CO去除烟气中的
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,用CO去除烟气中的 ,反应相同的时间,
,反应相同的时间, 的去除率随反应温度的变化如图所示。
的去除率随反应温度的变化如图所示。

反应温度低于240℃时,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ ;
在240~500℃范围内,随着温度的升高, 去除率增大的主要原因是
去除率增大的主要原因是___________ 。
 是大气主要污染物之一,有效去除大气中的
是大气主要污染物之一,有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。(1)在一定条件下,CO可以去除烟气中的
 ,其反应过程分三步完成(Cat表示催化剂,[]表示空穴):
,其反应过程分三步完成(Cat表示催化剂,[]表示空穴):ⅰ.Cat[]

ⅱ.Cat[]

ⅲ.……
写出第ⅲ步反应的方程式:
(2)温度为T℃时,在一个容积为10L的恒容密闭容器中,充入1molCO和0.5mol
 在催化剂作用下发生反应:
在催化剂作用下发生反应: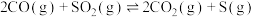
 。实验测得生成的
。实验测得生成的 的体积分数(φ)随着时间的变化曲线如图所示。
的体积分数(φ)随着时间的变化曲线如图所示。
①从反应开始到刚达到平衡,CO平均反应速率

②该温度下反应的平衡常数

③其它条件保持不变,再向上述平衡体系中充入
 、
、 、
、 、
、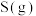 各0.2mol,再次达到平衡前v(正)
各0.2mol,再次达到平衡前v(正)(3)现以
 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,用CO去除烟气中的
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,用CO去除烟气中的 ,反应相同的时间,
,反应相同的时间, 的去除率随反应温度的变化如图所示。
的去除率随反应温度的变化如图所示。
反应温度低于240℃时,随着温度的升高,
 去除率降低的原因是
去除率降低的原因是在240~500℃范围内,随着温度的升高,
 去除率增大的主要原因是
去除率增大的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】自2020年7月1日起,在全国范围内实行轻型汽车国Ⅵ排放标准,该标准对氮氧化物、碳氢化物(HC)、一氧化碳和悬浮粒子等排放物的限制将更为严苛。
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为___ 附近,理由是________ 。推广使用无铅汽油的优点是____________ 。

(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g)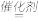 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1
已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+ O2(g)=CO(g) △H4
O2(g)=CO(g) △H4
则△H1=_______ (用含△H2、△H3、△H4的关系式表示)。
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H
①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H_____ 0,p1 ____ p2(填“>”或“<”)。

②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=_______ 。
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
①已知N2H4在水溶液中的一级电离方程式为N2H4▪H2O⇌ +OH-,则
+OH-,则 的电子式为
的电子式为________________ 。
②已知:Ag+(aq) +2NH3(aq)⇌[Ag(NH3)2]+(aq),其平衡常数表达式为Kf = =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc mol•L-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc mol•L-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____ mol•L-1(保留三位有效数字,提示: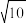 ≈3.16)。
≈3.16)。
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为

(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g)
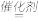 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+
 O2(g)=CO(g) △H4
O2(g)=CO(g) △H4 则△H1=
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H

②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
①已知N2H4在水溶液中的一级电离方程式为N2H4▪H2O⇌
 +OH-,则
+OH-,则 的电子式为
的电子式为②已知:Ag+(aq) +2NH3(aq)⇌[Ag(NH3)2]+(aq),其平衡常数表达式为Kf =
 =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc mol•L-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc mol•L-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=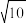 ≈3.16)。
≈3.16)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】CO2是一种常见的温室气体,它的吸收和利用也成为现代科技的热门课题。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) + O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________ (△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______ 。
(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:
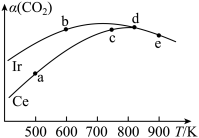
①用Ir和Ce作催化剂时,反应的活化能更低的是_________ ;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是________ ,反应的ΔH ____ 0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是__________ ;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
该反应平衡时CO2的转化率为___________ 。
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2O⇌NH3·H2O+H2CO3的平衡常数K=_________ 。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11 )。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) +
 O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:

①用Ir和Ce作催化剂时,反应的活化能更低的是
②a、b、c、d和e五种状态,反应一定达到平衡状态的是
③从状态a到c,CO2转化率不断增大的原因是
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
| 时间t/min | 0 | 10 | 20 | 30 | 40 |
| 总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2O⇌NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】氨气具有广泛用途,工业上利用反应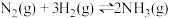
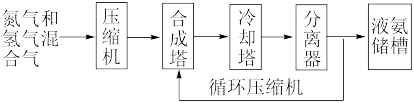
 合成氨,其基本合成过程如下:
合成氨,其基本合成过程如下:
(1)某小组为了探究外界条件对反应的影响,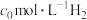 参加合成氨的反应,在
参加合成氨的反应,在 、
、 两种条件下分别达到平衡,测得
两种条件下分别达到平衡,测得 的浓度与反应时间的关系如图甲所示。请回答下列问题:
的浓度与反应时间的关系如图甲所示。请回答下列问题:
① 条件下,
条件下,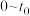 的平均反应速率
的平均反应速率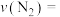
________  。
。
②相对 而言,
而言, 可能改变的条件是
可能改变的条件是________________ 。
③在 条件下,
条件下, 时刻将容器容积压缩至原来的
时刻将容器容积压缩至原来的 ,
, 时刻重新建立平衡状态。请在图中画出
时刻重新建立平衡状态。请在图中画出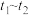 时刻
时刻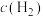 的变化曲线
的变化曲线________________ 。
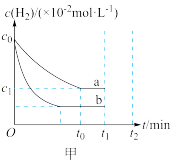
(2)某小组往一恒温恒压容器中充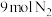 和
和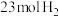 ,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强(
,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强( )的关系图。若体系在
)的关系图。若体系在 、
、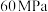 下达到平衡。
下达到平衡。
①此时 的平衡分压为
的平衡分压为________ MPa, 的平衡分压为
的平衡分压为________ MPa。(分压 总压
总压 物质的量分数)
物质的量分数)
②列式计算此时的平衡常数
________ 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是________________________ 。
 合成氨,其基本合成过程如下:
合成氨,其基本合成过程如下:
(1)某小组为了探究外界条件对反应的影响,
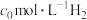 参加合成氨的反应,在
参加合成氨的反应,在 、
、 两种条件下分别达到平衡,测得
两种条件下分别达到平衡,测得 的浓度与反应时间的关系如图甲所示。请回答下列问题:
的浓度与反应时间的关系如图甲所示。请回答下列问题:①
 条件下,
条件下,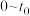 的平均反应速率
的平均反应速率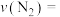
 。
。②相对
 而言,
而言, 可能改变的条件是
可能改变的条件是③在
 条件下,
条件下, 时刻将容器容积压缩至原来的
时刻将容器容积压缩至原来的 ,
, 时刻重新建立平衡状态。请在图中画出
时刻重新建立平衡状态。请在图中画出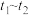 时刻
时刻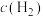 的变化曲线
的变化曲线

(2)某小组往一恒温恒压容器中充
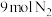 和
和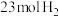 ,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强(
,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强( )的关系图。若体系在
)的关系图。若体系在 、
、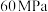 下达到平衡。
下达到平衡。①此时
 的平衡分压为
的平衡分压为 的平衡分压为
的平衡分压为 总压
总压 物质的量分数)
物质的量分数)②列式计算此时的平衡常数

(3)分离器中的过程对整个工业合成氨的意义是
您最近一年使用:0次
【推荐1】环氧乙烷(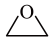 ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
(一)乙烯直接氧化法:
反应I:CH2=CH2(g)+ O2(g)→
O2(g)→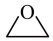 (g) ΔH1
(g) ΔH1
反应II:CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(g) ΔH2
(1)乙烯与O2在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为_____ 。
②M点后曲线下降的原因为_____ 。
③下列说法正确的有_____ (填标号)。
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.不同催化剂达到最高活性时的温度不同
C.催化剂的催化活性与温度成正比
(2)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。
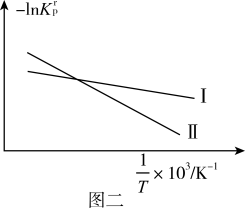
ΔH2_____ 0(填“>”或“<”)。
(二)电化学合成法
(3)科学家利用CO2、水合成环氧乙烷,有利于实现碳中和。总反应为:2CO2+2H2O→ +2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
+2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
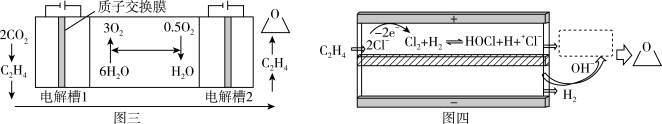
①电解槽1中阴极的电极反应式为_____ 。
②图四虚线框中发生多个反应,有中间产物HOCH2CH2Cl生成,最终生成环氧乙烷,其反应过程可描述为_____ 。
 ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:(一)乙烯直接氧化法:
反应I:CH2=CH2(g)+
 O2(g)→
O2(g)→ (g) ΔH1
(g) ΔH1反应II:CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(g) ΔH2
(1)乙烯与O2在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为
②M点后曲线下降的原因为
③下列说法正确的有
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.不同催化剂达到最高活性时的温度不同
C.催化剂的催化活性与温度成正比
(2)设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。
ΔH2
(二)电化学合成法
(3)科学家利用CO2、水合成环氧乙烷,有利于实现碳中和。总反应为:2CO2+2H2O→
 +2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
+2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
①电解槽1中阴极的电极反应式为
②图四虚线框中发生多个反应,有中间产物HOCH2CH2Cl生成,最终生成环氧乙烷,其反应过程可描述为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①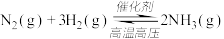 △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
则a=_________________ 。
(2)下图为不同温度(T)、不同投料比[n(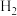 )/n(
)/n(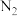 )]时反应达到平衡时
)]时反应达到平衡时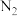 的转化率变化曲线。
的转化率变化曲线。
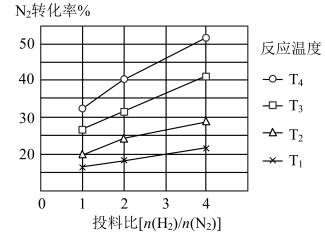
① 、
、 、
、 、
、 的大小关系为
的大小关系为__________________ 。
②保持温度和体积不变,提高投料比[n(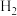 )/n(
)/n(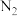 )],则重新达到平衡时,下列说法一定正确的是
)],则重新达到平衡时,下列说法一定正确的是_______ (填字母序号)。
A.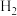 的浓度增大
的浓度增大
B.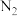 的转化率增大
的转化率增大
C.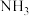 的体积分数增大
的体积分数增大
D.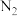 的浓度减小
的浓度减小
③温度为 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol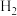 和1.0mol
和1.0mol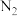 ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(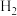 )表示该反应的平均速率为
)表示该反应的平均速率为____________________ ;反应在 时的平衡常数K=
时的平衡常数K=________________ 。
(3)一种新型除烟气中氮氧化物的方法是采用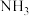 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出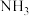 还原
还原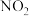 的化学反应方程式
的化学反应方程式_____________________________________ 。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________ 作指示剂;滴定过程中眼睛注视_____________ 。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________ (保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________ (填“偏大”、“偏小”、“不变”)。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①
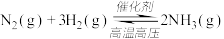 △H=a kJ/mol
△H=a kJ/mol②每破坏lmol有关化学键需要的能量如下表:
| H-H | N-H | N≡N |
| 436kJ | 391kJ | 946k |
(2)下图为不同温度(T)、不同投料比[n(
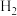 )/n(
)/n(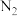 )]时反应达到平衡时
)]时反应达到平衡时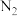 的转化率变化曲线。
的转化率变化曲线。
①
 、
、 、
、 、
、 的大小关系为
的大小关系为②保持温度和体积不变,提高投料比[n(
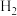 )/n(
)/n(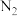 )],则重新达到平衡时,下列说法一定正确的是
)],则重新达到平衡时,下列说法一定正确的是A.
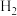 的浓度增大
的浓度增大B.
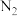 的转化率增大
的转化率增大C.
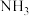 的体积分数增大
的体积分数增大D.
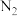 的浓度减小
的浓度减小③温度为
 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol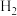 和1.0mol
和1.0mol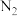 ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(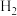 )表示该反应的平均速率为
)表示该反应的平均速率为 时的平衡常数K=
时的平衡常数K=(3)一种新型除烟气中氮氧化物的方法是采用
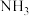 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出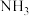 还原
还原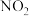 的化学反应方程式
的化学反应方程式(4)若用标准盐酸测定某稀氨水的浓度,应选择
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】“2030年前碳达峰,2060年前实现碳中和”定调国家级绿色发展战略。防治大气污染、水体污染等是世界各国保护环境的最重要课题。
由 合成甲醇是
合成甲醇是 资源化利用的重要方法。研究表明在催化剂作用下
资源化利用的重要方法。研究表明在催化剂作用下 和
和 可发生反应:CO2(g) + 3H2(g)
可发生反应:CO2(g) + 3H2(g) CH3OH (g) +H2O(g) ∆H
CH3OH (g) +H2O(g) ∆H
(1)投料比相同,在不同温度和不同压强下 和
和 合成甲醇时,
合成甲醇时, 的平衡转化率如图1所示。已知温度
的平衡转化率如图1所示。已知温度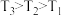 ,则该反应自发进行的条件是
,则该反应自发进行的条件是_______

(2)温度为T时,向 恒容密闭容器中充入H2和
恒容密闭容器中充入H2和 的混合气体
的混合气体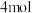 ,此时容器内压强为4p Kpa,两种气体的平衡转化率α与起始时
,此时容器内压强为4p Kpa,两种气体的平衡转化率α与起始时 的关系如图2所示。图2中
的关系如图2所示。图2中 的平衡转化率与
的平衡转化率与 的关系可用曲线
的关系可用曲线_______ (填“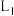 ”或“
”或“ ”)表示。该温度下,此反应的平衡常数
”)表示。该温度下,此反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(3)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。容易得到的副产物有
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。容易得到的副产物有 和
和 ,其中相对较多的副产物为
,其中相对较多的副产物为_______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。(标注“*”表示在催化剂表面吸附)

A. B.
B.
C. D.
D.
由
 合成甲醇是
合成甲醇是 资源化利用的重要方法。研究表明在催化剂作用下
资源化利用的重要方法。研究表明在催化剂作用下 和
和 可发生反应:CO2(g) + 3H2(g)
可发生反应:CO2(g) + 3H2(g) CH3OH (g) +H2O(g) ∆H
CH3OH (g) +H2O(g) ∆H(1)投料比相同,在不同温度和不同压强下
 和
和 合成甲醇时,
合成甲醇时, 的平衡转化率如图1所示。已知温度
的平衡转化率如图1所示。已知温度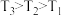 ,则该反应自发进行的条件是
,则该反应自发进行的条件是
(2)温度为T时,向
 恒容密闭容器中充入H2和
恒容密闭容器中充入H2和 的混合气体
的混合气体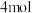 ,此时容器内压强为4p Kpa,两种气体的平衡转化率α与起始时
,此时容器内压强为4p Kpa,两种气体的平衡转化率α与起始时 的关系如图2所示。图2中
的关系如图2所示。图2中 的平衡转化率与
的平衡转化率与 的关系可用曲线
的关系可用曲线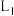 ”或“
”或“ ”)表示。该温度下,此反应的平衡常数
”)表示。该温度下,此反应的平衡常数

(3)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现
 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。容易得到的副产物有
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。容易得到的副产物有 和
和 ,其中相对较多的副产物为
,其中相对较多的副产物为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:
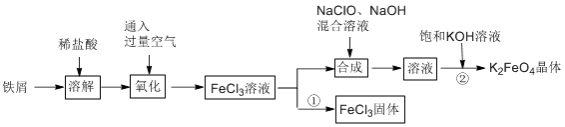
请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________ 。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________ 。
(3)为了检验“氧化”过程中所得溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______ (填字母)。
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液 e.酸性KMnO4溶液
(4)过程①制取FeCl3固体的具体操作步骤是________________________________________ 。若使6.5 mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH 小于_______ {已知该实验条件下,Ksp[(Fe(OH)3]=6.5×10-36,Kw=1.1×10-13}
(II)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
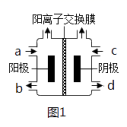
(1)收集到(CH3)4NOH的区域是______ (填a、b、c或d)。
(2)写出电解池总反应(化学方程式)___________________________ 。

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是
(2)“合成”阶段生成Na2FeO4的离子方程式为
(3)为了检验“氧化”过程中所得溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液 e.酸性KMnO4溶液
(4)过程①制取FeCl3固体的具体操作步骤是
(II)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是
(2)写出电解池总反应(化学方程式)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
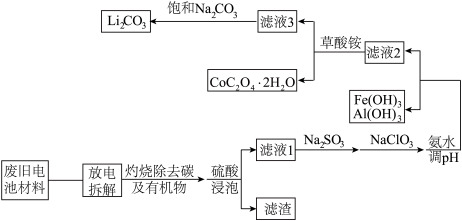
(1)“拆解”前需进入“放电”处理的目的是__ ;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__ 。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__ 。
(3)滤液1中加入Na2SO3的主要目的是__ ;加入NaClO3的主要目的是__ 。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图分析:沉钴时应控制n(C2O42-):n(Co2+)比为__ ,温度控制在__ ℃左右。

(1)“拆解”前需进入“放电”处理的目的是
(2)上述流程中将CoO2-转化为Co3+的离子方程式为
(3)滤液1中加入Na2SO3的主要目的是
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图分析:沉钴时应控制n(C2O42-):n(Co2+)比为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
(1)过程i中H2S发生了___ (选填“氧化”或“还原”)反应。
(2)过程ⅱ的离子方程式是____ 。
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeS04溶液中Fe2+的氧化速率如下表。
请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:____ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
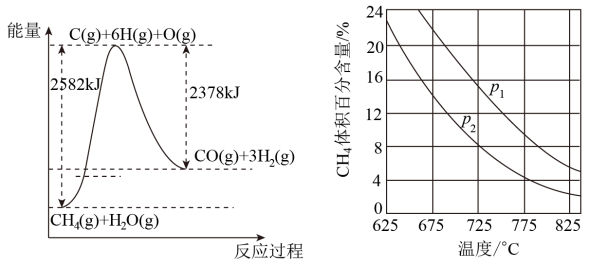
(4)①该过程的热化学方程式是____ 。
②比较压强p1和p2的大小关系:p1__ p2(选填“>”“<”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程示意图如下。
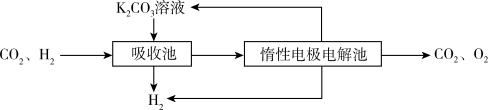
(5)①吸收池中发生反应的离子方程式是___ 。
②结合电极反应式,简述K2CO3溶液的再生原理:____ 。

请回答下列问题:
(1)过程i中H2S发生了
(2)过程ⅱ的离子方程式是
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeS04溶液中Fe2+的氧化速率如下表。
Ph | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
| Fe2+氧化速率/(g·L-1·H-1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.6 | 5.6 |
请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。

(4)①该过程的热化学方程式是
②比较压强p1和p2的大小关系:p1
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程示意图如下。

(5)①吸收池中发生反应的离子方程式是
②结合电极反应式,简述K2CO3溶液的再生原理:
您最近一年使用:0次



