25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图所示,已知达到平衡后,降低温度,A的转化率增大。
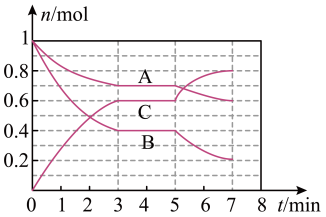
(1)根据图中数据,写出该反应的化学方程式:______ 。此反应的平衡常数的表达式K=_______ ,0~3 min内,A的速率为_______ 。在5~7min内,若K值不变,则此处曲线变化可能的原因是________ 。
(2)图中表示此反应的反应速率v和时间t的关系图:
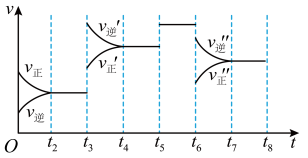
上图中t3时刻改变的条件是______ 。A的转化率最大的一段时间是_______ 。

(1)根据图中数据,写出该反应的化学方程式:
(2)图中表示此反应的反应速率v和时间t的关系图:

上图中t3时刻改变的条件是
更新时间:2020-11-28 09:42:07
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】工业合成氨的反应为:N2(g) + 3H 2(g)  2NH3(g); △H<0
2NH3(g); △H<0
(1)、随着温度升高,平衡常数K值变_______ 。
(2)改变反应条件,会使平衡发生移动。如下图象表示随条件改变,氨气的百分含量的变化趋势。
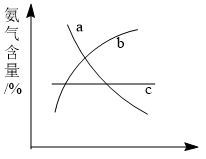
当横坐标为压强时,变化趋势正确的是(选填字母序号)_________ ,
当横坐标为温度时,变化趋势正确的是(选填字母序号)__________ 。
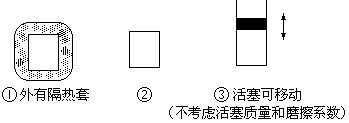
(3)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入①中3mol H2和1mol N2;②中2mol NH3;③中1.5mol H2和0.5mol N2和1mol NH3;一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为_____ (填容器编号)。
(4)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
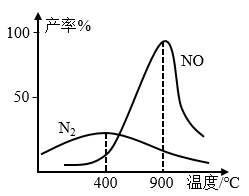
4NH3+5O2⇌4NO+6H2O 4NH3+3O2⇌2N2+6H2O 温度高于900℃时,NO产率下降的原因_____ 。
 2NH3(g); △H<0
2NH3(g); △H<0(1)、随着温度升高,平衡常数K值变
(2)改变反应条件,会使平衡发生移动。如下图象表示随条件改变,氨气的百分含量的变化趋势。

当横坐标为压强时,变化趋势正确的是(选填字母序号)
当横坐标为温度时,变化趋势正确的是(选填字母序号)
(3)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入①中3mol H2和1mol N2;②中2mol NH3;③中1.5mol H2和0.5mol N2和1mol NH3;一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为

(4)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):

4NH3+5O2⇌4NO+6H2O 4NH3+3O2⇌2N2+6H2O 温度高于900℃时,NO产率下降的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】 和
和 均为重要的工业原料。
均为重要的工业原料。
已知:I.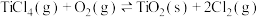
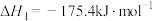
II.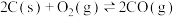
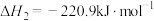
请回答下列问题:
(1) 与
与 反应生成
反应生成 、
、 和氯气的热化学方程式为
和氯气的热化学方程式为_______ 。升高温度对该反应的影响为_______ 。
(2)t℃时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和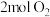 ,发生反应Ⅰ,
,发生反应Ⅰ, 达到平衡测得
达到平衡测得 的物质的量为
的物质的量为 。
。
①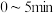 内,用
内,用 表示的反应速率
表示的反应速率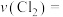
_______ 。
② 的平衡转化率为
的平衡转化率为_______ 。
③下列措施,既能加快逆反应速率又能增大 的平衡转化率是
的平衡转化率是_______ (填字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分 D.增大
D.增大 浓度
浓度
④t℃时,向 恒容密闭容器中充入
恒容密闭容器中充入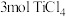 和一定量
和一定量 的混合气体,发生反应Ⅰ,两种气体的平衡转化率
的混合气体,发生反应Ⅰ,两种气体的平衡转化率 与起始的物质的量之比
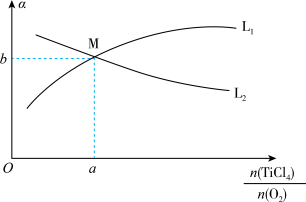
与起始的物质的量之比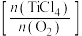 的关系如下图所示:能表示
的关系如下图所示:能表示 平衡转化率的曲线为
平衡转化率的曲线为_______ (填“ ”或“
”或“ ”)
”)
 和
和 均为重要的工业原料。
均为重要的工业原料。已知:I.
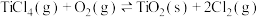
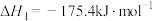
II.
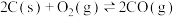
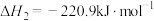
请回答下列问题:
(1)
 与
与 反应生成
反应生成 、
、 和氯气的热化学方程式为
和氯气的热化学方程式为(2)t℃时,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和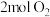 ,发生反应Ⅰ,
,发生反应Ⅰ, 达到平衡测得
达到平衡测得 的物质的量为
的物质的量为 。
。①
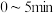 内,用
内,用 表示的反应速率
表示的反应速率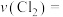
②
 的平衡转化率为
的平衡转化率为③下列措施,既能加快逆反应速率又能增大
 的平衡转化率是
的平衡转化率是A.缩小容器容积 B.加入催化剂 C.分离出部分
 D.增大
D.增大 浓度
浓度④t℃时,向
 恒容密闭容器中充入
恒容密闭容器中充入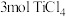 和一定量
和一定量 的混合气体,发生反应Ⅰ,两种气体的平衡转化率
的混合气体,发生反应Ⅰ,两种气体的平衡转化率 与起始的物质的量之比
与起始的物质的量之比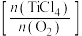 的关系如下图所示:能表示
的关系如下图所示:能表示 平衡转化率的曲线为
平衡转化率的曲线为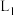 ”或“
”或“ ”)
”)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】由于温室效应和资源短缺,如何降低大气中CO2的含量并加以开发利用等问题,引起了全世界的普遍重视。目前工业上用CO为原料生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
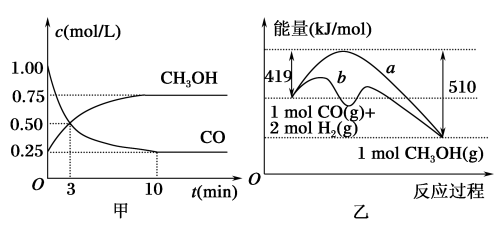
(1)图甲是反应时CO和CH3OH的浓度随时间的变化情况。从反应开始到达到平衡状态,用CO浓度的变化表示反应的平均反应速率v(CO)=___________ 。
(2)如图乙是该反应进行过程中能量的变化。曲线___________ (填“a”或“b”)表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为___________ kJ/mol。
(3)该反应的平衡常数K的表达式为___________ ,升高温度,平衡常数K___________ (填“增大”“减小”或“不变”)。
(4)恒容条件下,下列措施能使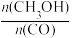 增大的有
增大的有___________ 。
A.升高温度 B.充入He C.再充入1 mol CO和2 mol H2 D.使用催化剂
 CH3OH(g)。
CH3OH(g)。
(1)图甲是反应时CO和CH3OH的浓度随时间的变化情况。从反应开始到达到平衡状态,用CO浓度的变化表示反应的平均反应速率v(CO)=
(2)如图乙是该反应进行过程中能量的变化。曲线
(3)该反应的平衡常数K的表达式为
(4)恒容条件下,下列措施能使
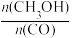 增大的有
增大的有A.升高温度 B.充入He C.再充入1 mol CO和2 mol H2 D.使用催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】根据要求写出方程式:
(1)酸性高锰酸钾与草酸反应的化学方程式___ ;
(2)硫代硫酸钠(Na2S2O3)与稀硫酸反应的化学方程式___ ;
(3)工业上冶炼铝的化学方程式___ ;
(4)惰性电极电解氯化铝溶液的离子方程式___ ;
(5)酸性条件下铬酸钾与重铬酸钾转化的离子方程式___ ;
(6)已知某反应的化学平衡常数的表达式为K=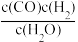 ,写出该反应的化学方程式
,写出该反应的化学方程式___ ;
(7)铅蓄电池的电池总反应化学方程式___ 。
(1)酸性高锰酸钾与草酸反应的化学方程式
(2)硫代硫酸钠(Na2S2O3)与稀硫酸反应的化学方程式
(3)工业上冶炼铝的化学方程式
(4)惰性电极电解氯化铝溶液的离子方程式
(5)酸性条件下铬酸钾与重铬酸钾转化的离子方程式
(6)已知某反应的化学平衡常数的表达式为K=
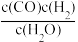 ,写出该反应的化学方程式
,写出该反应的化学方程式(7)铅蓄电池的电池总反应化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为:CO2(g)+3H2(g)⇌CH3OH(g) + H2O (g)
(1)该反应平衡常数的表达式K=_______ ;
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
(3)在5L密闭容器中充入1mol CO2和3mol H2,测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如图所示。
①若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率ʋ=_______ 。
②该反应是_______ 反应(选填“吸热”或“放热”);其它条件相同时,CH3OH在a点的正反应速率_______ CH3OH在b点的正反应速率(选填“>”、“<”或“=”);解释温度低于T时,φ(CH3OH)随温度升高而逐渐增加的原因_______ 。
(1)该反应平衡常数的表达式K=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
| A.增大H2的浓度,平衡向右移动 |
| B.移去部分CH3OH,正反应速率增大 |
| C.降低反应温度,正、逆反应速率都减小 |
| D.加入催化剂,可提高CO2的平衡转化率 |
(3)在5L密闭容器中充入1mol CO2和3mol H2,测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如图所示。

①若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率ʋ=
②该反应是
您最近一年使用:0次
【推荐3】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2mol CO2和9mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
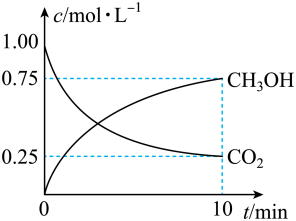
(1)该反应的平衡常数K表达式为_____________________________ 。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_________________ ,H2的转化率为___________ 。
(3)下列叙述中,能说明反应已达到化学平衡状态的是___________ (填字母)。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1:3:1:1
B.v正(CO2):v逆(H2)=1:3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变

(1)该反应的平衡常数K表达式为
(2)0~10min时间内,该反应的平均反应速率v(H2O)=
(3)下列叙述中,能说明反应已达到化学平衡状态的是
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1:3:1:1
B.v正(CO2):v逆(H2)=1:3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】一定温度下,有容积相等的甲、乙两个容器中,甲容器中加入0.1mol A和0.2mol B,乙容器中加入0.2mol A和0.2 mol B,两容器中均发生反应:A(s)+2B(g) ⇌2C(g)+D(g)。
(1)甲容器与乙容器中,平衡常数(K):甲__________ 乙(填 “>”、“=” 或“<”,下同),物质B的转化率:甲___________ 乙。
(2)如果甲的容积为2L,分别在三种不同实验条件下进行反应,反应物B的浓度随时间的变化如图所示。
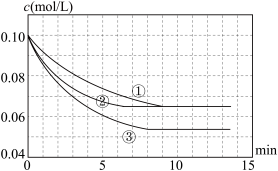
a.实验②,0~4 min 平均反应速度率:v(D)=_____________________ 。
b.与实验①相比,实验②和③分别改变了一种反应条件。请分析判断并填写下表:
(3)该反应为________ 反应(填“放热”或“吸热”)。
(4)不能说明该反应已达到平衡状态的是_______________
A.v正(B)= 2v逆(D) B. A的浓度保持不变
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(1)甲容器与乙容器中,平衡常数(K):甲
(2)如果甲的容积为2L,分别在三种不同实验条件下进行反应,反应物B的浓度随时间的变化如图所示。

a.实验②,0~4 min 平均反应速度率:v(D)=
b.与实验①相比,实验②和③分别改变了一种反应条件。请分析判断并填写下表:
| 实验 | 改变条件 | 判断理由 |
| ② | ||
| ③ |
(3)该反应为
(4)不能说明该反应已达到平衡状态的是
A.v正(B)= 2v逆(D) B. A的浓度保持不变
C.气体的平均摩尔质量不变 D.气体的密度保持不变
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
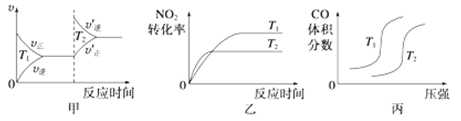
【推荐2】汽车尾气中CO、NO2在一定条件下可以发生反应:4CO(g)+2NO2(g)  4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:
4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:
(1)0~10 min内该反应的平均速率v(CO)=________ ,从11 min起其他条件不变,压缩容器的容积变为1 L,则c(NO2)的变化曲线可能为图中的________ (填字母)。
(2)恒温恒容条件下,不能说明该反应已达到平衡状态的是________ (填字母)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(3)写出该反应平衡常数表达式:______ ,增大压强平衡______ (填“正向”“不”“逆向”)移动,平衡常数______ (填“增大”“减小”“不变”)。
(4)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象表示正确的是_______ (填序号)。
 4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:
4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示: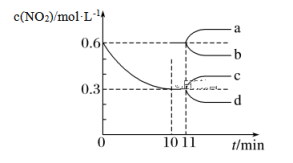
(1)0~10 min内该反应的平均速率v(CO)=
(2)恒温恒容条件下,不能说明该反应已达到平衡状态的是
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(3)写出该反应平衡常数表达式:
(4)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象表示正确的是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)  xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
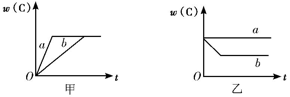
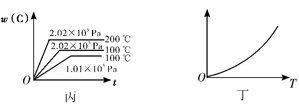
(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则____ 曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则___ 曲线表示恒温恒容的情况,且此时混合气体中w(C)___ (填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是___ (填“放热”或“吸热”)反应,x的值为___ 。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是____ (填序号)。
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
升高温度,平衡向____ (填“正反应”或“逆反应”)方向移动。
 xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。

(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则
(3)根据丙可以判断该可逆反应的正反应是
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
升高温度,平衡向
您最近一年使用:0次



