电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_______ 。
②下列方法中,可以使醋酸稀溶液中CH3COOH 电离程度增大的是_______ (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液 c. 加水稀释 d.加入少量醋酸钠晶体
加水稀释 d.加入少量醋酸钠晶体
(2)①一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向_______ (填“正”或“逆”)反应方向移动;溶液中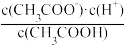 的值
的值_______ (填“增大”、“减小”或“不变”)。
②氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol·L-1;
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈_______ 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______ 性,NH4HCO3溶液中物质的量浓度最大的离子是_______ (填化学式)。
(3)99℃时,KW=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_______ 。
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=_______ 。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_______ 。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______ 。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸稀溶液中CH3COOH 电离程度增大的是
a.滴加少量浓盐酸 b.微热溶液 c.
 加水稀释 d.加入少量醋酸钠晶体
加水稀释 d.加入少量醋酸钠晶体(2)①一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向
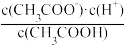 的值
的值②氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol·L-1;
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈
(3)99℃时,KW=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
更新时间:2020-12-27 19:14:04
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】富马酸亚铁(C4H2O4Fe)常用于治疗缺铁性贫血,也可作食品营养强化剂,它可由糠醛(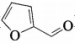 )和硫酸亚铁制备。已知
)和硫酸亚铁制备。已知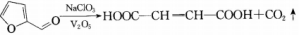 。
。
回答下列问题
I.制备富马酸(实验装置如图所示,夹持装置已略去)
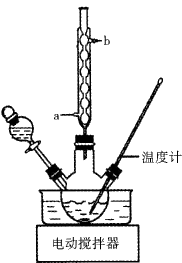
(1)将45.0g氯酸钠、0.2g五氧化二钒置于三颈烧瓶中,加入适量水,滴加糠醛并加热至90~100℃,维持此温度3~4h。实验中冷凝管的作用是_________ ,冷却液宜从___________ (填a”或“b”)处进入。
(2)冰水冷却使其结晶,并通过___________ 操作可以得到富马酸粗品。
(3)再用1mol·L-1HCl溶液重结晶,得到纯富马酸。该操作中用1mol·L-1HCl溶液的原因是_____________ 。
Ⅱ.合成富马酸亚铁
(4)取富马酸溶于适量水中,加入碳酸钠并加热、搅拌,调节pH6.5~6.7,产生大量气泡。写出该反应的化学方程式:___________ 。
(5)将硫酸亚铁溶液和适量的Na2SO3溶液缓慢加入上述反应液中,维持温度100℃并充分搅拌3~4h。
①该操作过程中加入适量的Na2SO3溶液,其目的是___________ 。
②写出生成富马酸亚铁的离子方程式:_____________ 。
(6)过滤、干燥得到产品。
过滤时滤纸要紧贴漏斗内壁,原因是________ 。
Ⅲ.产品纯度测定
(7)取0.300g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;立即用0.1000mol·L-1硫酸铈(Ⅳ)铵[(NH4)2Ce(SO4)3]标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗17.30mL标准液,则样品的纯度为___________ 。
 )和硫酸亚铁制备。已知
)和硫酸亚铁制备。已知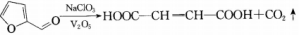 。
。回答下列问题
I.制备富马酸(实验装置如图所示,夹持装置已略去)

(1)将45.0g氯酸钠、0.2g五氧化二钒置于三颈烧瓶中,加入适量水,滴加糠醛并加热至90~100℃,维持此温度3~4h。实验中冷凝管的作用是
(2)冰水冷却使其结晶,并通过
(3)再用1mol·L-1HCl溶液重结晶,得到纯富马酸。该操作中用1mol·L-1HCl溶液的原因是
Ⅱ.合成富马酸亚铁
(4)取富马酸溶于适量水中,加入碳酸钠并加热、搅拌,调节pH6.5~6.7,产生大量气泡。写出该反应的化学方程式:
(5)将硫酸亚铁溶液和适量的Na2SO3溶液缓慢加入上述反应液中,维持温度100℃并充分搅拌3~4h。
①该操作过程中加入适量的Na2SO3溶液,其目的是
②写出生成富马酸亚铁的离子方程式:
(6)过滤、干燥得到产品。
过滤时滤纸要紧贴漏斗内壁,原因是
Ⅲ.产品纯度测定
(7)取0.300g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;立即用0.1000mol·L-1硫酸铈(Ⅳ)铵[(NH4)2Ce(SO4)3]标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗17.30mL标准液,则样品的纯度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题
(1) 时,水的
时,水的 ,则该温度
,则该温度___________ (填“>”“<”或“=”)25℃,其理由是___________ 。
(2)在(1)中所述温度下, 的溶液呈
的溶液呈___________ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由水电离出的
___________  。
。
(3)实验室用Zn和稀硫酸制取 ,反应时溶液中水的电离平衡
,反应时溶液中水的电离平衡___________ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________ 移动。
(4)25℃时,pH=4的盐酸中水的电离程度___________ (填“大于”“小于”或“等于”)pH=10的 溶液中水的电离程度。
溶液中水的电离程度。
(5) 乙酸(甲,
乙酸(甲,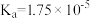 )和
)和 氯乙酸(乙,
氯乙酸(乙,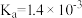 )的水溶液,下列可以表示两溶液中由水电离出的
)的水溶液,下列可以表示两溶液中由水电离出的 与加入水的体积
与加入水的体积 之间关系的是
之间关系的是___________ (填字母)。
a. b.
b.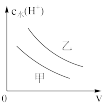 c.
c. d.
d.
(1)
 时,水的
时,水的 ,则该温度
,则该温度(2)在(1)中所述温度下,
 的溶液呈
的溶液呈
 。
。(3)实验室用Zn和稀硫酸制取
 ,反应时溶液中水的电离平衡
,反应时溶液中水的电离平衡(4)25℃时,pH=4的盐酸中水的电离程度
 溶液中水的电离程度。
溶液中水的电离程度。(5)
 乙酸(甲,
乙酸(甲,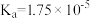 )和
)和 氯乙酸(乙,
氯乙酸(乙,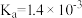 )的水溶液,下列可以表示两溶液中由水电离出的
)的水溶液,下列可以表示两溶液中由水电离出的 与加入水的体积
与加入水的体积 之间关系的是
之间关系的是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】 (三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验中可由金属钴及其他原料制备
(三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验中可由金属钴及其他原料制备 。
。
已知:① 在
在 时恰好完全沉淀为
时恰好完全沉淀为 ;
;
②不同温度下 在水中的溶解度如图所示。
在水中的溶解度如图所示。

(一) 的制备
的制备
 易潮解,
易潮解,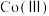 的氧化性强于
的氧化性强于 ,可用金属钻与氯气反应制备
,可用金属钻与氯气反应制备 。实验中利用如图装置(连接用橡胶管省略)进行制备。
。实验中利用如图装置(连接用橡胶管省略)进行制备。
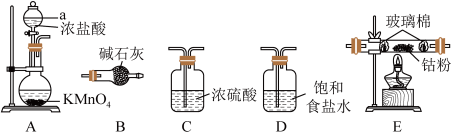
(1)用图中的装置组合制备 ,仪器a的名称为
,仪器a的名称为______ ,仪器连接顺序为______ (填标号)。装置B的作用是______ 。
(2)装置A中发生反应的离子方程式为______ 。
(二) 的制备步骤如下:
的制备步骤如下:
Ⅰ.在100mL锥形瓶内加入4.5g研细的 ,3g
,3g 和5mL水,加热溶解后加入0.3g活性炭作催化剂。
和5mL水,加热溶解后加入0.3g活性炭作催化剂。
Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL 溶液。
溶液。
Ⅲ.在60℃下反应一段时间后,经过______、冷却结晶、过滤、洗涤、干燥等操作,得到 晶体。
晶体。
根据以上步骤,回答下列问题:
(3)在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ中加入 ,请从平衡移动的角度解释加入
,请从平衡移动的角度解释加入 的目的
的目的______ 。
(4)步骤Ⅱ中在加入 溶液时,控制温度在10℃以下并缓慢加入的目的是
溶液时,控制温度在10℃以下并缓慢加入的目的是______ 。
(5)步骤Ⅲ中的操作名称为______ 。
(6) 的配位数为
的配位数为______ 。1L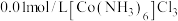 溶液和足量硝酸银反应,生成AgCl的物质的量为
溶液和足量硝酸银反应,生成AgCl的物质的量为______ mol。
 (三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验中可由金属钴及其他原料制备
(三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验中可由金属钴及其他原料制备 。
。已知:①
 在
在 时恰好完全沉淀为
时恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示。
在水中的溶解度如图所示。
(一)
 的制备
的制备 易潮解,
易潮解, 的氧化性强于
的氧化性强于 ,可用金属钻与氯气反应制备
,可用金属钻与氯气反应制备 。实验中利用如图装置(连接用橡胶管省略)进行制备。
。实验中利用如图装置(连接用橡胶管省略)进行制备。
(1)用图中的装置组合制备
 ,仪器a的名称为
,仪器a的名称为(2)装置A中发生反应的离子方程式为
(二)
 的制备步骤如下:
的制备步骤如下:Ⅰ.在100mL锥形瓶内加入4.5g研细的
 ,3g
,3g 和5mL水,加热溶解后加入0.3g活性炭作催化剂。
和5mL水,加热溶解后加入0.3g活性炭作催化剂。Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL
 溶液。
溶液。Ⅲ.在60℃下反应一段时间后,经过______、冷却结晶、过滤、洗涤、干燥等操作,得到
 晶体。
晶体。根据以上步骤,回答下列问题:
(3)在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ中加入
 ,请从平衡移动的角度解释加入
,请从平衡移动的角度解释加入 的目的
的目的(4)步骤Ⅱ中在加入
 溶液时,控制温度在10℃以下并缓慢加入的目的是
溶液时,控制温度在10℃以下并缓慢加入的目的是(5)步骤Ⅲ中的操作名称为
(6)
 的配位数为
的配位数为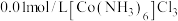 溶液和足量硝酸银反应,生成AgCl的物质的量为
溶液和足量硝酸银反应,生成AgCl的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】现有pH=2的醋酸溶液(甲)和pH=2的盐酸(乙)。
(1)取10mL的甲溶液,若加入少量无水醋酸钠固体,待固体溶解后,溶液中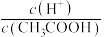 的值将
的值将_______ (填“增大”“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙溶液,各稀释100倍。稀释后的pH大小关系为:pH(甲)_______ pH(乙) (填“>”、“<”或“=”),若将甲、乙两溶液等体积混合,溶液的pH=_______ 。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)_______ V(乙)(填“>”、“<”或“=”)。
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)_______ c(CH3COO-)(填“>”、“<”或“=”)。
(1)取10mL的甲溶液,若加入少量无水醋酸钠固体,待固体溶解后,溶液中
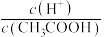 的值将
的值将(2)相同条件下,取等体积的甲、乙溶液,各稀释100倍。稀释后的pH大小关系为:pH(甲)
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LCH3COOH溶液的滴定曲线如下图所示。
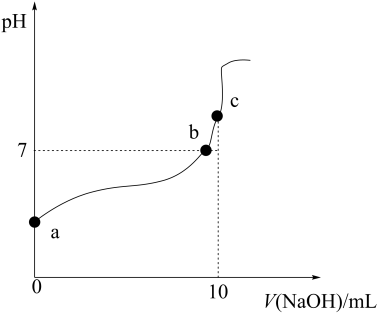
①a点溶液的pH___________ 1(填“>”、“<”或“=”,下同)。
②b点溶液中,c(Na+)___________ c(CH3COO−)。
③c点溶液中,c(Na+)___________ [c(CH3COO−)+c(CH3COOH)]。
④比较a、c两点水的电离程度:a___________ c。
(2)已知:25℃时CH3COOH、H2CO3和HClO的电离平衡常数:
①CH3COOH的电离平衡常数表达式Ka=___________ 。
②25℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)___________ pH(CH3COONa)(填“>”、“<”或“=”)。
③25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01mol/L,达到电离平衡时溶液中c(H+)=___________ mol/L。(已知: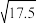 =4.2)
=4.2)
④下列化学反应能发生的是___________ 。
a.HClO+CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2+H2O+2NaClO=Na2CO3+2HClO
(3)25℃时Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下欲除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液的pH范围为___________ 。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LCH3COOH溶液的滴定曲线如下图所示。

①a点溶液的pH
②b点溶液中,c(Na+)
③c点溶液中,c(Na+)
④比较a、c两点水的电离程度:a
(2)已知:25℃时CH3COOH、H2CO3和HClO的电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 1.75×10–5 | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
①CH3COOH的电离平衡常数表达式Ka=
②25℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)
③25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01mol/L,达到电离平衡时溶液中c(H+)=
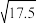 =4.2)
=4.2)④下列化学反应能发生的是
a.HClO+CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2+H2O+2NaClO=Na2CO3+2HClO
(3)25℃时Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下欲除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液的pH范围为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:
(1)“碱浸”时发生反应的离子方程式为___________ 。
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是___________ 。
(3)“沉碲”时控制溶液的pH为4.5〜5.0,生成TeO2沉淀。酸性不能过强,其原因是___________ ;防止局部酸度过大的操作方法是___________ 。
(4)“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是___________ 。
(5)25°C时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
①0.1mol·L-1H2TeO3电离度α约为___________ 。(α= ×100%)
×100%)
②0.lmol•L-1的NaHTeO3溶液中,下列粒子的物质的量浓度关系正确的是___________ 。
A.c(Na+)>c(HTeO )>c(OH-)>c(H2TeO3)>c(H+)
)>c(OH-)>c(H2TeO3)>c(H+)
B.c(Na+)+c(H+)>=c(HTeO )+c(TeO
)+c(TeO )+c(OH-)
)+c(OH-)
C.c(Na+)=c(TeO )+c(HTeO
)+c(HTeO )+c(H2TeO3)
)+c(H2TeO3)
D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO )
)

(1)“碱浸”时发生反应的离子方程式为
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是
(3)“沉碲”时控制溶液的pH为4.5〜5.0,生成TeO2沉淀。酸性不能过强,其原因是
(4)“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是
(5)25°C时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
①0.1mol·L-1H2TeO3电离度α约为
 ×100%)
×100%)②0.lmol•L-1的NaHTeO3溶液中,下列粒子的物质的量浓度关系正确的是
A.c(Na+)>c(HTeO
 )>c(OH-)>c(H2TeO3)>c(H+)
)>c(OH-)>c(H2TeO3)>c(H+)B.c(Na+)+c(H+)>=c(HTeO
 )+c(TeO
)+c(TeO )+c(OH-)
)+c(OH-)C.c(Na+)=c(TeO
 )+c(HTeO
)+c(HTeO )+c(H2TeO3)
)+c(H2TeO3)D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO
 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】向两支分别盛有0.1mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为_______ 三种酸由强到弱的顺序是(用化学式表示) ______ ,]硼酸(H3BO3)在食品、医药领域应用广泛。请完成B2H6气体与水反应的化学方程式:B2H6 +6H2O=2H3BO3 +_______ 。在其他条件相同时,反应H3BO3 +3CH3OH  B(OCH3)3 +3H2O中,H3BO3的转化率(
B(OCH3)3 +3H2O中,H3BO3的转化率( )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
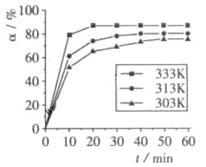
①温度对应该反应的反应速率和平衡移动的影响是_______
②该反应的△H_______ 0(填“<”、“=”或“>”)。
H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)
[B(OH)4]-( aq)+H+(aq)
已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K=_______ ,(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
 B(OCH3)3 +3H2O中,H3BO3的转化率(
B(OCH3)3 +3H2O中,H3BO3的转化率( )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是
②该反应的△H
H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l)
 [B(OH)4]-( aq)+H+(aq)
[B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】I. 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,
___________ (填“增大”“减小”或“不变”)。
(2)下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的是___________。
的电离程度增大,而电离平衡常数不变的是___________。
(3)依上表数据写出向NaClO溶液中通少量 的离子方程式:
的离子方程式:___________ 。
(4)pH相同的NaClO和 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
____ NaClO(填“ ”“
”“ ”或“
”或“ ”,下同),两溶液中:c(Na+)−c(ClO-)
”,下同),两溶液中:c(Na+)−c(ClO-)____ c(K+)−c(CH3COO-)。
II.常温下,用0.2000mol•L-1盐酸滴定25mL0.2000mol•L-1Na2CO3溶液(溶液均为新配制),其滴定曲线如图所示(忽略溶液混合时体积和温度的变化)。回答下列问题:
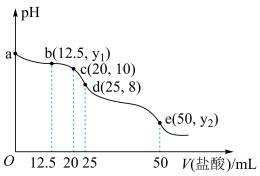
(5)往0.2000mol•L-1Na2CO3溶液中滴入2~3滴无色酚酞,溶液颜色会由无色变为________ ,判断的依据___________ (用离子方程式表示)。
(6)b点混合溶液中主要的溶质有Na2CO3、NaCl和___________ (填化学式),此时 =
=___________ 。
(7)c点混合溶液中,c(Na+)、c(CO )、(HCO
)、(HCO )、c(OH-)、c(H+)由大到小的顺序为
)、c(OH-)、c(H+)由大到小的顺序为___________ 。
(8)d点混合溶液中,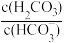 的数值是
的数值是___________ 。
 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:| 化学式 | HClO |  |  |
| 电离平衡常数 |  |  | Ka1=4×10-7,Ka2=5×10-11 |
(1)一般情况下,当温度升高时,

(2)下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的是___________。
的电离程度增大,而电离平衡常数不变的是___________。| A.升高温度 | B.加水稀释 |
C.加少量的 固体 固体 | D.加少量氢氧化钠浓溶液 |
(3)依上表数据写出向NaClO溶液中通少量
 的离子方程式:
的离子方程式:(4)pH相同的NaClO和
 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
 ”“
”“ ”或“
”或“ ”,下同),两溶液中:c(Na+)−c(ClO-)
”,下同),两溶液中:c(Na+)−c(ClO-)II.常温下,用0.2000mol•L-1盐酸滴定25mL0.2000mol•L-1Na2CO3溶液(溶液均为新配制),其滴定曲线如图所示(忽略溶液混合时体积和温度的变化)。回答下列问题:

(5)往0.2000mol•L-1Na2CO3溶液中滴入2~3滴无色酚酞,溶液颜色会由无色变为
(6)b点混合溶液中主要的溶质有Na2CO3、NaCl和
 =
=(7)c点混合溶液中,c(Na+)、c(CO
 )、(HCO
)、(HCO )、c(OH-)、c(H+)由大到小的顺序为
)、c(OH-)、c(H+)由大到小的顺序为(8)d点混合溶液中,
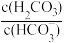 的数值是
的数值是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】硫化钠是一种重要的化工原料.工业上用硫酸钠来制得硫化钠.制备硫化钠的反应原理为:Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g)﹣Q,已知该可逆反应在1000℃时达到平衡,并保持反应器内恒温恒容.试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为______ ,若只改变一个影响因素,当平衡移动时,K值______ 变化(填“一定”或“不一定”);当K值变大时,逆反应速率______ .(填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说法错误的是______ .
a.容器内压强保持不变
b.氢气和水蒸气的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为______ .
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是______ .
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是______ ,请结合离子方程式,运用平衡原理进行解释:______ .
(1)此可逆反应的平衡常数表达式可表示为
(2)该反应达到平衡时下列说法错误的是
a.容器内压强保持不变
b.氢气和水蒸气的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
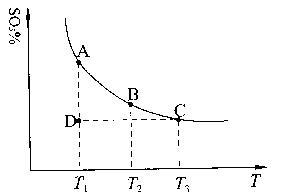
①2SO2(g)+O2(g) 2SO3(g)的△H
2SO3(g)的△H_______ 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡________ 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______ K2;若反应进行到状
态D时,v正___________ v逆(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
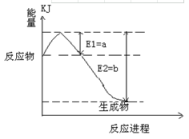
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中
能量变化示意图,请写出工业合成氨的热化学反应方程式:_________________ 。(△H的数值用含字母a、b的代数式表示)②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)______ c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式___________ 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是___________ ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是____________ ,产生该现象的原因是(用离子方程式表示)__________________________ 。
(已知25°C时KSP[AgCl]=1.0×10-10 mol2·L-2,KSP[AgI]=1.5×10-16 mol2·L-2)
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)
 2SO3(g)的△H
2SO3(g)的△H恒压条件下向上述平衡体系中通入氦气,平衡
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1
态D时,v正
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。

①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中
能量变化示意图,请写出工业合成氨的热化学反应方程式:
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是
(已知25°C时KSP[AgCl]=1.0×10-10 mol2·L-2,KSP[AgI]=1.5×10-16 mol2·L-2)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
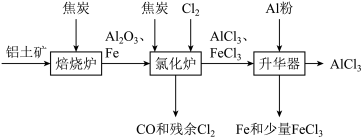
已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________ ,实验室配制氯化铝溶液时加入盐酸的目的是________________________ 。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________ 炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____ 。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________ 。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品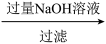 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 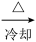 n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________ 。计算该样品中Al的质量分数________ (结果用m、n表示,不必化简)。

已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品
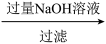 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3  n克Al2O3
n克Al2O3NaAlO2溶液与过量二氧化碳反应的离子方程式为:
您最近一年使用:0次



