绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)研究氮氧化物与悬浮大气中海盐粒子的相互作用时,涉及如下反应:
Ⅰ.2NO2(g)+NaCl(s)⇌ NaNO3(s)+ClNO(g) K1 ΔH1
Ⅱ.2NO(g)+Cl2(g)⇌2ClNO(g) K2 ΔH2
则4NO2(g)+2NaCl(s)⇌ 2NaNO3(s)+2NO(g)+Cl2(g) ΔH=___________ (用ΔH1、ΔH2表示);平衡常数K=___________ (用K1、K2表示)
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)⇌ 4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如表所示:
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1 :p0=___________ 。2~5 min内用NO2表示的该反应的平均反应速度为___________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___________ (填标号)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下:
Ⅰ:NO+Pt(s)=NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]
Ⅱ:CO+Pt(s)=CO(*)
Ⅲ:NO(*)=N(*)+O(*)
Ⅳ:CO(*)+O(*)=CO2+2Pt(s)
Ⅴ:N(*)+N(*)=N2+2Pt(s)
Ⅵ:NO(*)+N(*)=N2O+2Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。
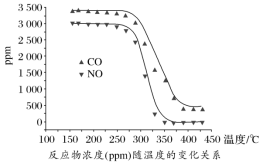
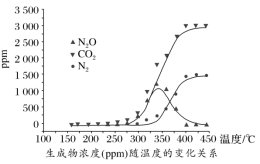
①330 ℃以下的低温区发生的主要反应的化学方程式是___________ 。
②反应V的活化能___________ 反应Ⅵ的活化能(填“<”、“>”或“=”),理由是:___________ 。
(1)研究氮氧化物与悬浮大气中海盐粒子的相互作用时,涉及如下反应:
Ⅰ.2NO2(g)+NaCl(s)⇌ NaNO3(s)+ClNO(g) K1 ΔH1
Ⅱ.2NO(g)+Cl2(g)⇌2ClNO(g) K2 ΔH2
则4NO2(g)+2NaCl(s)⇌ 2NaNO3(s)+2NO(g)+Cl2(g) ΔH=
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)⇌ 4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如表所示:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1 :p0=
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下:
Ⅰ:NO+Pt(s)=NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]
Ⅱ:CO+Pt(s)=CO(*)
Ⅲ:NO(*)=N(*)+O(*)
Ⅳ:CO(*)+O(*)=CO2+2Pt(s)
Ⅴ:N(*)+N(*)=N2+2Pt(s)
Ⅵ:NO(*)+N(*)=N2O+2Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。


①330 ℃以下的低温区发生的主要反应的化学方程式是
②反应V的活化能
更新时间:2021-01-14 21:27:14
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】合成气是一种重要的化工原料气,甲烷、二氧化碳自热重整制合成气的主要反应有:
Ⅰ.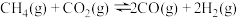
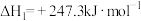
Ⅱ.

Ⅲ.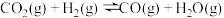
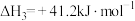
回答下列问题:
(1)
_______  。
。
(2)一定条件下,向VL恒容密闭容器中通入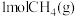 、
、 、
、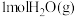 假设只发生上述Ⅰ、Ⅱ反应,达到平衡时,容器中
假设只发生上述Ⅰ、Ⅱ反应,达到平衡时,容器中 为0.6mol,
为0.6mol, 为0.8mol,
为0.8mol, 为0.8mol,此时
为0.8mol,此时 的物质的量为
的物质的量为_______ mol,反应Ⅱ的平衡常数为_______ 。
(3)不同温度下,向VL密闭容器中按照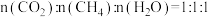 投料,实验测得平衡时
投料,实验测得平衡时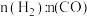 随温度的变化关系如图所示:
随温度的变化关系如图所示:
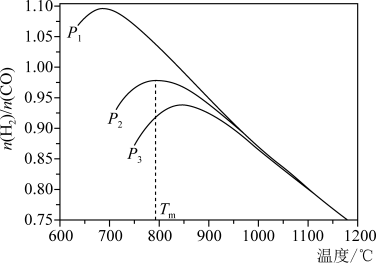
①压强 、
、 、
、 中最大的是
中最大的是_______ 。
②压强为 时,温度
时,温度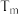 前随着温度升高,
前随着温度升高,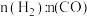 增大的可能原因是
增大的可能原因是_______ 。
(4)吉利公司研发的甲醇汽车,基于甲醇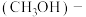 空气燃料电池,其工作原理如图:
空气燃料电池,其工作原理如图:
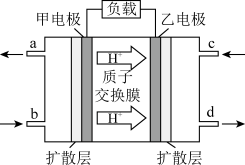
图中左侧电极的电极反应式为:_______ 。
Ⅰ.
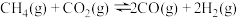
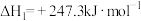
Ⅱ.


Ⅲ.
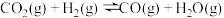
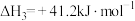
回答下列问题:
(1)

 。
。(2)一定条件下,向VL恒容密闭容器中通入
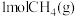 、
、 、
、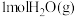 假设只发生上述Ⅰ、Ⅱ反应,达到平衡时,容器中
假设只发生上述Ⅰ、Ⅱ反应,达到平衡时,容器中 为0.6mol,
为0.6mol, 为0.8mol,
为0.8mol, 为0.8mol,此时
为0.8mol,此时 的物质的量为
的物质的量为(3)不同温度下,向VL密闭容器中按照
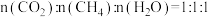 投料,实验测得平衡时
投料,实验测得平衡时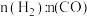 随温度的变化关系如图所示:
随温度的变化关系如图所示:
①压强
 、
、 、
、 中最大的是
中最大的是②压强为
 时,温度
时,温度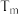 前随着温度升高,
前随着温度升高,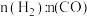 增大的可能原因是
增大的可能原因是(4)吉利公司研发的甲醇汽车,基于甲醇
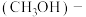 空气燃料电池,其工作原理如图:
空气燃料电池,其工作原理如图:
图中左侧电极的电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】CO2综合利用是降低碳排放的有效手段,有利于实现碳中和目标。下列是CO2综合利用的化学方法,回答下列问题:
(1)用氨水吸收CO2制化肥(NH4HCO3)。
①已知:NH3·H2O(aq)= (aq)+OH-(aq) ΔH1=akJ·mol-1
(aq)+OH-(aq) ΔH1=akJ·mol-1
CO2(g)+H2O(l)=H2CO3(aq) ΔH2=bkJ·mol-1
H2CO3(aq)+OH-(aq)= (aq)+H2O(l) ΔH3=ckJ·mol-1
(aq)+H2O(l) ΔH3=ckJ·mol-1
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为_______ 。
②已知常温下相关数据如表:
则反应 +
+ +H2O⇌NH3·H2O+H2CO3的平衡常数K=
+H2O⇌NH3·H2O+H2CO3的平衡常数K=_______ 。
③分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图1所示,若烟气中CO2的含量(体积分数)为15%,烟气通入氨水的流量为0.065m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,则脱除的CO2的物质的量最多为_______ (精确到0.01)。

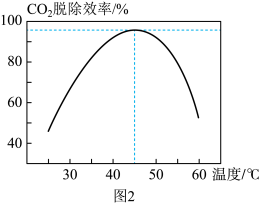
④CO2脱除效率与温度的关系如图2所示,高于45℃时,CO2脱除效率降低的原因可能是_______ (答出一条即可)。
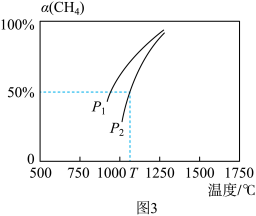
(2)用CO2和天然气可以制备CO和H2:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol·L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率[α(CH4)]与温度及压强的关系如图3所示,则压强p1_______ p2(填“>”或“<”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),改变氢碳比[n(H2)/n(CO2)],在不同温度下反应达到平衡状态,测得的实验数据如下表。
①氢碳比为1.5,温度为500K,判断该可逆反应达到平衡状态的依据是_______ (填标号)。
A.在相同时间段内,CH3OH的生成速率和CO2的消耗速率相等
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变
D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
②在700K、氢碳比为3.0条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为_______ 。
(1)用氨水吸收CO2制化肥(NH4HCO3)。
①已知:NH3·H2O(aq)=
 (aq)+OH-(aq) ΔH1=akJ·mol-1
(aq)+OH-(aq) ΔH1=akJ·mol-1CO2(g)+H2O(l)=H2CO3(aq) ΔH2=bkJ·mol-1
H2CO3(aq)+OH-(aq)=
 (aq)+H2O(l) ΔH3=ckJ·mol-1
(aq)+H2O(l) ΔH3=ckJ·mol-1则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为
②已知常温下相关数据如表:
| Kb(NH3·H2O) | 2.0×10-5 |
| Ka1(H2CO3) | 5.0×10-7 |
| Ka2(H2CO3) | 4.0×10-11 |
则反应
 +
+ +H2O⇌NH3·H2O+H2CO3的平衡常数K=
+H2O⇌NH3·H2O+H2CO3的平衡常数K=③分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图1所示,若烟气中CO2的含量(体积分数)为15%,烟气通入氨水的流量为0.065m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,则脱除的CO2的物质的量最多为

④CO2脱除效率与温度的关系如图2所示,高于45℃时,CO2脱除效率降低的原因可能是

(2)用CO2和天然气可以制备CO和H2:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol·L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率[α(CH4)]与温度及压强的关系如图3所示,则压强p1

(3)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),改变氢碳比[n(H2)/n(CO2)],在不同温度下反应达到平衡状态,测得的实验数据如下表。
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 40 | 22 |
①氢碳比为1.5,温度为500K,判断该可逆反应达到平衡状态的依据是
A.在相同时间段内,CH3OH的生成速率和CO2的消耗速率相等
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变
D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
②在700K、氢碳比为3.0条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq)△H1=akJ•mol﹣1;
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l)△H2=bkJ•mol﹣1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=ckJ•mol﹣1。
反应2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(1)△H=______ kJ•mol﹣1
(2)发电厂常用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=﹣681.8kJ•mol﹣1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~10min内,平均反应速率 (O2)
(O2)_____ mol•L﹣1•min﹣1;当升高温度,该反应的平衡常数K_____ (填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____ 。
A.加入一定量的粉状碳酸钙B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g)△H=﹣34.0kJ•mol﹣1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和2mol的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为_____ ;在1100K时,CO2的体积分数为______ 。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=_______ [已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=﹣746.8k•mol﹣1,生成无毒的N2和CO2。实验测得, 正=k正•c2(NO)•c2(CO),
正=k正•c2(NO)•c2(CO), 逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数)
逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数)
①达到平衡后,仅升高温度,k正增大的倍数_________ (填“>”“<”或“=”)k逆增大的倍数。
②1L容器中充1molCO和1molNO,一定温度达平衡,CO转化率为40%,则K正:K逆=___ (分数表示)
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq)△H1=akJ•mol﹣1;
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l)△H2=bkJ•mol﹣1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=ckJ•mol﹣1。
反应2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(1)△H=
(2)发电厂常用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=﹣681.8kJ•mol﹣1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 | |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
 (O2)
(O2)②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
A.加入一定量的粉状碳酸钙B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g)△H=﹣34.0kJ•mol﹣1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和2mol的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=﹣746.8k•mol﹣1,生成无毒的N2和CO2。实验测得,
 正=k正•c2(NO)•c2(CO),
正=k正•c2(NO)•c2(CO), 逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数)
逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数)①达到平衡后,仅升高温度,k正增大的倍数
②1L容器中充1molCO和1molNO,一定温度达平衡,CO转化率为40%,则K正:K逆=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO2催化加氢制甲醇的反应器中存在如下反应:
i.CO2(g) +3H2(g)=CH3OH(g)+H2O(g) △H1<0
ii.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3<0
(1) 5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
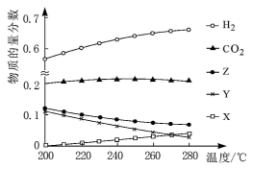
①体系中CO2的物质的量分数受温度的影响不大,原因是__ 。
②曲线__ (填“X”、“Y”或“Z”)代表CH3OH。
(2) 利用△H1计算甲醇摩尔燃烧热时,还需要利用反应___ 的△H。
(3) 反应i可能的反应历程如图所示。

①反应历程中,生成甲醇的决速步骤的反应方程式为___ 。
②△H1=___ (计算结果保留1位小数)。(已知:leV=1.6×10-22kJ)
注:方框内包含微粒种类及数目、微粒的相对总能量(如最后一个方框表示1个CH3OH(g)分子+1个H2O(g)分子的相对总能量为-0.51eV,单位:eV。)其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
(4) 750K下,在恒容密闭容器中,仅发生反应CH3OH(g) CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=
CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=___ (用含P0和a的式子表示)。
i.CO2(g) +3H2(g)=CH3OH(g)+H2O(g) △H1<0
ii.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3<0
(1) 5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

①体系中CO2的物质的量分数受温度的影响不大,原因是
②曲线
(2) 利用△H1计算甲醇摩尔燃烧热时,还需要利用反应
(3) 反应i可能的反应历程如图所示。

①反应历程中,生成甲醇的决速步骤的反应方程式为
②△H1=
注:方框内包含微粒种类及数目、微粒的相对总能量(如最后一个方框表示1个CH3OH(g)分子+1个H2O(g)分子的相对总能量为-0.51eV,单位:eV。)其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
(4) 750K下,在恒容密闭容器中,仅发生反应CH3OH(g)
 CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=
CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】汽车尾气中的CO、NOx是大气污染物。我国科研工作者经过研究,可以用不同方法处理氮的氧化物﹐防止空气污染。回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180kJ·mol−1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-906kJ·mol−1
请写出NH3将NO转化成无毒物质的热化学方程式:___________ 。
(2)工业上一种除去NO的一种反应机理如图所示:
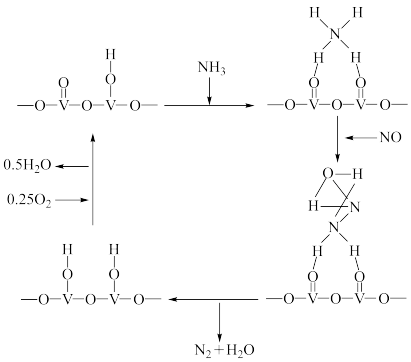
该反应的化学方程式为:___________ 。
(3)利用H2还原NO的反应2H2(g)+2NO(g) N2(g)+2H2O(g)的速率方程为
N2(g)+2H2O(g)的速率方程为 ,该反应在不同条件下的反应速率如下:
,该反应在不同条件下的反应速率如下:
则速率方程中,α=___________ ;β=___________ 。
(4)活性炭处理汽车尾气中NO的方法:C(s)+2NO(g) N2(g)+CO2(g)ΔH<0,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,以下能说明该反应一定达到平衡状态的是
N2(g)+CO2(g)ΔH<0,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,以下能说明该反应一定达到平衡状态的是___________ 。
A.v(N2)=v(CO2)
B.容器与外界不发生热交换
C.容器内气体的物质的量不变
D.容器内气体密度不变
(5)科研人员进一步研究了在C(s)+2NO(g) N2(g)+CO2(g)反应中,活性炭搭载钙、镧氧化物的反应活性对比。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol·L−1.不同温度下,测得2小时时NO去除率如图所示:
N2(g)+CO2(g)反应中,活性炭搭载钙、镧氧化物的反应活性对比。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol·L−1.不同温度下,测得2小时时NO去除率如图所示:

①据图分析,490℃以下反应活化能最小的是___________ (用a、b、c表示)。
②490℃时的反应速率v(NO)=___________ mol·L−1·h−1
③若某温度下此反应的平衡常数为100,则反应达到平衡时NO的去除率为___________ (保留两位有效数字)。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180kJ·mol−1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-906kJ·mol−1
请写出NH3将NO转化成无毒物质的热化学方程式:
(2)工业上一种除去NO的一种反应机理如图所示:

该反应的化学方程式为:
(3)利用H2还原NO的反应2H2(g)+2NO(g)
 N2(g)+2H2O(g)的速率方程为
N2(g)+2H2O(g)的速率方程为 ,该反应在不同条件下的反应速率如下:
,该反应在不同条件下的反应速率如下:| 温度 | c(H2)/mol·L−1 | c(NO)/mol·L−1 | 反应速率 |
| T1 | 0.1 | 0.1 |  |
| T1 | 0.3 | 0.1 | 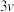 |
| T1 | 0.2 | 0.2 | 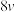 |
(4)活性炭处理汽车尾气中NO的方法:C(s)+2NO(g)
 N2(g)+CO2(g)ΔH<0,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,以下能说明该反应一定达到平衡状态的是
N2(g)+CO2(g)ΔH<0,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,以下能说明该反应一定达到平衡状态的是A.v(N2)=v(CO2)
B.容器与外界不发生热交换
C.容器内气体的物质的量不变
D.容器内气体密度不变
(5)科研人员进一步研究了在C(s)+2NO(g)
 N2(g)+CO2(g)反应中,活性炭搭载钙、镧氧化物的反应活性对比。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol·L−1.不同温度下,测得2小时时NO去除率如图所示:
N2(g)+CO2(g)反应中,活性炭搭载钙、镧氧化物的反应活性对比。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol·L−1.不同温度下,测得2小时时NO去除率如图所示:
①据图分析,490℃以下反应活化能最小的是
②490℃时的反应速率v(NO)=
③若某温度下此反应的平衡常数为100,则反应达到平衡时NO的去除率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是_____ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3.完成NaClO3氧化FeCl2的离子方程式: +Fe2++ _____=Cl-+Fe3++____,
+Fe2++ _____=Cl-+Fe3++____,________ 。
(3)制备无水氯化铁
已知:FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
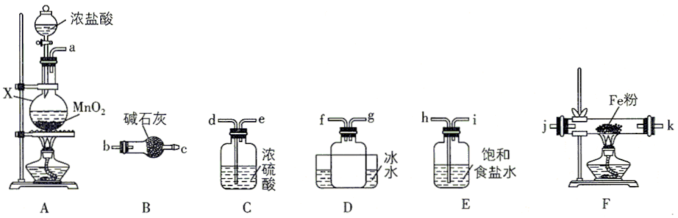
①装置的连接顺序为a→____ → j,k →_____ (按气流方向,用小写字母表示)。
②实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为_____ 。
(4)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①_______
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)_____ E(ii)(填“>”、 “<”或“=”,下同),平衡常数大小关系是:K(i)_____ K(ii)。
⑤另取5 mL l mol L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施__________ 。
(1)FeCl3净水的原理是
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3.完成NaClO3氧化FeCl2的离子方程式:
 +Fe2++ _____=Cl-+Fe3++____,
+Fe2++ _____=Cl-+Fe3++____,(3)制备无水氯化铁
已知:FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解

①装置的连接顺序为a→
②实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为
(4)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①
步骤 | 现象 | 结论 |
| Ⅰ.取5 mL1 mol⋅L−1 FeCl3溶液于试管中,通入SO2至饱和 | 溶液很快由黄色变为红棕色 | |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液 | 溶液中无明显光路 | ②红棕色物质不是 |
| Ⅲ .将步骤Ⅰ中的溶液静置 | 1小时后,溶液逐渐变为浅绿色 | |
| IV.向步骤Ⅲ中溶液加入2滴K3[Fe(CN)6]溶液 | ③ | 溶液中含有Fe2+ |
⑤另取5 mL l mol
 L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业尾气的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)已知:
 ;
;

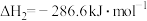 。
。
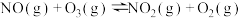
 。则
。则
___________  。
。
恒容密闭体系中NO氧化率随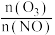 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随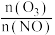 值增大而增大的主要原因是
值增大而增大的主要原因是___________ 。

(2)汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的 和
和 ,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:

①在 条件下,若
条件下,若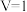 ,求前5min平均反应速率
,求前5min平均反应速率
___________  。
。
②已知:温度 ,则
,则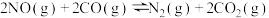
 ,则
,则
___________ 0.(填“>”“<”);在 条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能
条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能___________ 。
③在 条件下,下列说明该反应已经到达平衡状态的是
条件下,下列说明该反应已经到达平衡状态的是___________ (填字母)。
A.NO和CO的物质的量分数不变
B.混合气体的密度保持不变
C.容器中混合气体的平均摩尔质量不变
D.容器中压强不再变化
(1)已知:
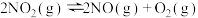
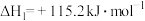 ;
;
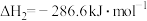 。
。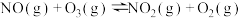
 。则
。则
 。
。恒容密闭体系中NO氧化率随
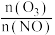 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随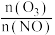 值增大而增大的主要原因是
值增大而增大的主要原因是
(2)汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的
 和
和 ,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
①在
 条件下,若
条件下,若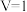 ,求前5min平均反应速率
,求前5min平均反应速率
 。
。②已知:温度
 ,则
,则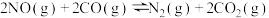
 ,则
,则
 条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能
条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能③在
 条件下,下列说明该反应已经到达平衡状态的是
条件下,下列说明该反应已经到达平衡状态的是A.NO和CO的物质的量分数不变
B.混合气体的密度保持不变
C.容器中混合气体的平均摩尔质量不变
D.容器中压强不再变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g) H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l) H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l) 2NH3(l)+CO2(g) ΔH3=
2NH3(l)+CO2(g) ΔH3=_____________ ,该反应能自发进行的主要原因是__________________ .
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
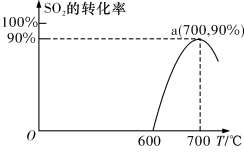
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______ mol•L-1•min-1,该温度下的平衡常数为_________ .
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________ 90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______ .
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
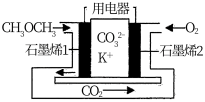
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.
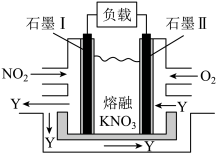
石墨I附近发生的反应为__________________________________ ,当外电路通过1mole-,正极上共消耗_______ mol N2O5。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)
 H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1反应2:H2NCOONH4(l)
 H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1请回答:CO(NH2)2 (l)+H2O(l)
 2NH3(l)+CO2(g) ΔH3=
2NH3(l)+CO2(g) ΔH3=(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)
 S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率
③下列说法一定能说明该反应达到平衡状态的是
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】下面是有关化学反应速率与限度的研究。
I.已知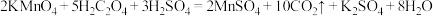
实验室利用下列方案探究影响化学反应速率的因素:
(1)实验时,分别量取稀硫酸酸化的 溶液和无色的草酸溶液,迅速混合并开始计时,通过测定
溶液和无色的草酸溶液,迅速混合并开始计时,通过测定___________ 来判断反应的快慢。
(2)实验①和②是探究___________ 对化学反应速率的影响。
(3)实验③从反应开始到结束用了t秒的时间,则用 表示0-t秒内该反应的平均速率为
表示0-t秒内该反应的平均速率为___________ mol/(L·s)(用含t的式子表示)
Ⅱ.一定条件下,在5L密闭容器内发生反应 ,
, 的物质的量随时间变化如表:
的物质的量随时间变化如表:
(4) 的平衡转化率为
的平衡转化率为___________ 。第2s时 的体积分数为
的体积分数为___________ 。
(5)恒温恒容下,不能说明该反应已经达到平衡状态的是___________(填序号)
(6)为加快该反应速率,可以采取的措施是___________。
I.已知
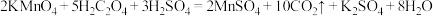
实验室利用下列方案探究影响化学反应速率的因素:
| 编号 | 温度/℃ | 草酸溶液( ) ) | 酸性 溶液 溶液 | ||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | ||
| ① | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| ② | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| ③ | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
 溶液和无色的草酸溶液,迅速混合并开始计时,通过测定
溶液和无色的草酸溶液,迅速混合并开始计时,通过测定(2)实验①和②是探究
(3)实验③从反应开始到结束用了t秒的时间,则用
 表示0-t秒内该反应的平均速率为
表示0-t秒内该反应的平均速率为Ⅱ.一定条件下,在5L密闭容器内发生反应
 ,
, 的物质的量随时间变化如表:
的物质的量随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 /mol /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 的平衡转化率为
的平衡转化率为 的体积分数为
的体积分数为(5)恒温恒容下,不能说明该反应已经达到平衡状态的是___________(填序号)
| A.容器内混合气体颜色不再变化 |
| B.容器内混合气体压强保持不变 |
| C.容器内混合气体密度保持不变 |
D. 和 和 的浓度之比2:1 的浓度之比2:1 |
| A.降低温度 | B.恒容时充入He(g) |
| C.恒压时充入He(g) | D.恒容时充入 (g) (g) |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】二甲醚可用作溶剂冷冻剂喷雾剂等,科学家提出利用CO2和H2合成二甲醚,反应原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H。
CH3OCH3(g)+3H2O(g) ∆H。
(1)已知①H2O(g)+CO(g) CO2(g)+H2(g) ∆H=+42 kJ·mol-1;
CO2(g)+H2(g) ∆H=+42 kJ·mol-1;
②CH3OCH3(g)+H2O(g) 2CH3OH(g) ∆H1=+24.52 kJ·mol-1;
2CH3OH(g) ∆H1=+24.52 kJ·mol-1;
③CH3OH(g) CO(g)+2H2(g) ∆H2=+90.73 kJ·mol-1。
CO(g)+2H2(g) ∆H2=+90.73 kJ·mol-1。
则∆H=_______ kJ·mol-1。
(2)对于恒温恒容条件下进行的反应①,下列说法能说明反应已达平衡的是_______ 。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=v(H2)逆 D.n(CO)与n(H2)的比值不变
(3)一定温度下,在一个2 L的密闭容器中充入2 mol CO2和6 mol H2发生上述反应,经过5 min反应达到平衡,此时容器中压强与起始压强之比为3:4,则用CH3OCH3表示的平均反应速率为_______ ,H2的转化率为_______ ;此时,若向体系中再加入2 mol CO2和1.5 mol H2O(g),平衡_______ 移动(填“正向”“逆向”或“不”)。
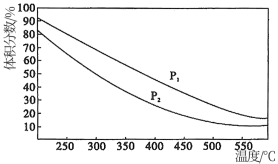
(4)一定温度下,密闭容器中进行的反应③,测得平衡时混合物中某物质的体积分数在不同压强下随温度的变化如图所示,则纵坐标表示的物质是_______ ,压强P1_______ P2(填“>”或“<”)。
(5)科学家利用石墨烯设计的二甲醚熔融燃料电池工作原理如图所示,工作时,通入氧气的电极为_______ (填负或正)极,负极的电极反应式为_______ 。
 CH3OCH3(g)+3H2O(g) ∆H。
CH3OCH3(g)+3H2O(g) ∆H。(1)已知①H2O(g)+CO(g)
 CO2(g)+H2(g) ∆H=+42 kJ·mol-1;
CO2(g)+H2(g) ∆H=+42 kJ·mol-1;②CH3OCH3(g)+H2O(g)
 2CH3OH(g) ∆H1=+24.52 kJ·mol-1;
2CH3OH(g) ∆H1=+24.52 kJ·mol-1;③CH3OH(g)
 CO(g)+2H2(g) ∆H2=+90.73 kJ·mol-1。
CO(g)+2H2(g) ∆H2=+90.73 kJ·mol-1。则∆H=
(2)对于恒温恒容条件下进行的反应①,下列说法能说明反应已达平衡的是
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=v(H2)逆 D.n(CO)与n(H2)的比值不变
(3)一定温度下,在一个2 L的密闭容器中充入2 mol CO2和6 mol H2发生上述反应,经过5 min反应达到平衡,此时容器中压强与起始压强之比为3:4,则用CH3OCH3表示的平均反应速率为
(4)一定温度下,密闭容器中进行的反应③,测得平衡时混合物中某物质的体积分数在不同压强下随温度的变化如图所示,则纵坐标表示的物质是

(5)科学家利用石墨烯设计的二甲醚熔融燃料电池工作原理如图所示,工作时,通入氧气的电极为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】Ⅰ、 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:

(1)可根据__________ 现象来判断甲、乙都已达到平衡。
(2)测得甲中A的转化率为b,则乙中C的转化率为_________ ;
(3)甲、乙中C的物质的量是_____ (填:“甲>乙”或“甲<乙”或“甲=乙” );
(4)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为_____ mol,
II.(1)自然界发生的一个固氮反应是N2(g)+O2(g)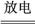 2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946 kJ·mol-1、498 kJ·mol-1、632 kJ·mol-1,则该反应的ΔH=
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946 kJ·mol-1、498 kJ·mol-1、632 kJ·mol-1,则该反应的ΔH=___ kJ·mol-1。
(2)恒压100 kPa时,反应2NO(g)+O2(g) 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g) N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
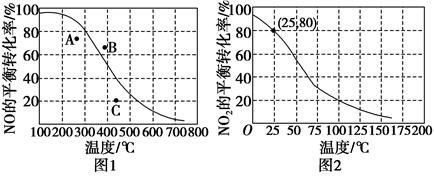
①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g) 2NO2(g)达到平衡时NO的转化率,则
2NO2(g)达到平衡时NO的转化率,则________ 点对应的压强最大。
②恒压100 kPa、25 ℃时,2NO2(g) N2O4(g)平衡体系中N2O4的体积分数为
N2O4(g)平衡体系中N2O4的体积分数为________ ,列式计算平衡常数Kp=____________ 。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据
(2)测得甲中A的转化率为b,则乙中C的转化率为
(3)甲、乙中C的物质的量是
(4)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为
II.(1)自然界发生的一个固氮反应是N2(g)+O2(g)
 2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946 kJ·mol-1、498 kJ·mol-1、632 kJ·mol-1,则该反应的ΔH=
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946 kJ·mol-1、498 kJ·mol-1、632 kJ·mol-1,则该反应的ΔH=(2)恒压100 kPa时,反应2NO(g)+O2(g)
 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g) N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)
 2NO2(g)达到平衡时NO的转化率,则
2NO2(g)达到平衡时NO的转化率,则②恒压100 kPa、25 ℃时,2NO2(g)
 N2O4(g)平衡体系中N2O4的体积分数为
N2O4(g)平衡体系中N2O4的体积分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】将捕集的 转化合成气
转化合成气 可有效实现碳资源的综合充分利用。
可有效实现碳资源的综合充分利用。
方法I: 热催化制备合成气:一定条件下用甲烷还原
热催化制备合成气:一定条件下用甲烷还原 制备合成气。
制备合成气。
相关化学键的键能数据
(1)反应的热化学方程式是:
_______  ,该反应为
,该反应为_______ (填“吸热”或“放热”)反应。平衡常数表达式
_______ 。
(2)已知某一温度时 ,测得某时刻反应混合物中
,测得某时刻反应混合物中 的浓度分别为
的浓度分别为 ,则此刻上述反应的平衡移动方向为
,则此刻上述反应的平衡移动方向为_______ (填“正向移动”“逆向移动”或“不移动”)。
(3)热力学分析表明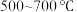 时易发生
时易发生 的歧化反应和
的歧化反应和 以上易发生
以上易发生 的裂解反应(方程式如下所示),一段时间后
的裂解反应(方程式如下所示),一段时间后 基催化剂的催化效果会明显下降,其原因是
基催化剂的催化效果会明显下降,其原因是_______ 。


方法II: 加氢备合成气:将原料气
加氢备合成气:将原料气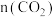 与
与 按一定比例在催化剂作用下发生反应a,同时伴随反应b发生,反应方程式如下所示。
按一定比例在催化剂作用下发生反应a,同时伴随反应b发生,反应方程式如下所示。
反应a: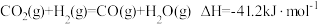
反应b: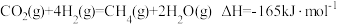
(4)将原料气按 置于恒容密闭容器中发生反应,在相同时间内测得平衡时各组分摩尔分数与温度的变化曲线如图所示,则制合成气适宜的温度为
置于恒容密闭容器中发生反应,在相同时间内测得平衡时各组分摩尔分数与温度的变化曲线如图所示,则制合成气适宜的温度为_______ 。

(5)理论上,能提高 平衡转化率的措施有
平衡转化率的措施有_______ (写出一条即可)。
 转化合成气
转化合成气 可有效实现碳资源的综合充分利用。
可有效实现碳资源的综合充分利用。方法I:
 热催化制备合成气:一定条件下用甲烷还原
热催化制备合成气:一定条件下用甲烷还原 制备合成气。
制备合成气。相关化学键的键能数据
| 化学键 |  |  |  |  |
键能 | 745 | 414 | 1046 | 436 |
(1)反应的热化学方程式是:

 ,该反应为
,该反应为
(2)已知某一温度时
 ,测得某时刻反应混合物中
,测得某时刻反应混合物中 的浓度分别为
的浓度分别为 ,则此刻上述反应的平衡移动方向为
,则此刻上述反应的平衡移动方向为(3)热力学分析表明
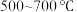 时易发生
时易发生 的歧化反应和
的歧化反应和 以上易发生
以上易发生 的裂解反应(方程式如下所示),一段时间后
的裂解反应(方程式如下所示),一段时间后 基催化剂的催化效果会明显下降,其原因是
基催化剂的催化效果会明显下降,其原因是

方法II:
 加氢备合成气:将原料气
加氢备合成气:将原料气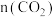 与
与 按一定比例在催化剂作用下发生反应a,同时伴随反应b发生,反应方程式如下所示。
按一定比例在催化剂作用下发生反应a,同时伴随反应b发生,反应方程式如下所示。反应a:
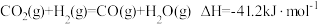
反应b:
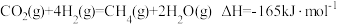
(4)将原料气按
 置于恒容密闭容器中发生反应,在相同时间内测得平衡时各组分摩尔分数与温度的变化曲线如图所示,则制合成气适宜的温度为
置于恒容密闭容器中发生反应,在相同时间内测得平衡时各组分摩尔分数与温度的变化曲线如图所示,则制合成气适宜的温度为
(5)理论上,能提高
 平衡转化率的措施有
平衡转化率的措施有
您最近一年使用:0次



