已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应: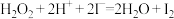 ,且生成的I2立即与试剂X反应而被消耗。由于溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应
,且生成的I2立即与试剂X反应而被消耗。由于溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应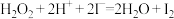 的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对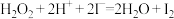 反应速率的影响。实验2中m=
反应速率的影响。实验2中m=_______ ,n=_______ 。
(2)一定温度下,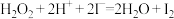 反应速率可以表示为
反应速率可以表示为 (k为常数),则:
(k为常数),则:
①根据上表数据关系可知,a、b的值依次为_______ 和_______ 。
②t=_______ 。
(3)实验5表明:
①硫酸铁能_______ 该反应速率。
②试用离子方程式表示 对
对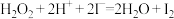 催化的过程为2Fe3++2I-=2Fe2++I2、
催化的过程为2Fe3++2I-=2Fe2++I2、_______ 。
(4)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致H2O2大量分解(已知温度为60℃时H2O2会分解50%以上),应该采取的加热方式是_______ 。
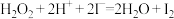 ,且生成的I2立即与试剂X反应而被消耗。由于溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应
,且生成的I2立即与试剂X反应而被消耗。由于溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应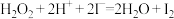 的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
 KI溶液 KI溶液 | H2O |  X溶液 X溶液 |  双氧水 双氧水 |  稀盐酸 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴 溶液 溶液 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对
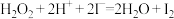 反应速率的影响。实验2中m=
反应速率的影响。实验2中m=(2)一定温度下,
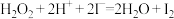 反应速率可以表示为
反应速率可以表示为 (k为常数),则:
(k为常数),则:①根据上表数据关系可知,a、b的值依次为
②t=
(3)实验5表明:
①硫酸铁能
②试用离子方程式表示
 对
对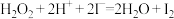 催化的过程为2Fe3++2I-=2Fe2++I2、
催化的过程为2Fe3++2I-=2Fe2++I2、(4)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致H2O2大量分解(已知温度为60℃时H2O2会分解50%以上),应该采取的加热方式是
更新时间:2021-01-08 07:58:43
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在一定条件下发生反应: 可以缓解大气中
可以缓解大气中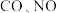 污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.
污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.
回答下列问题:
(1)控制变量是科学研究的重要方法,因此表中数据:a=_______ ,b=_______
(2)对比实验Ⅰ、Ⅲ的目的是_______
(3)实验Ⅰ和实验Ⅱ中, 的物质的量浓度
的物质的量浓度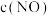 随时间t的变化曲线如图所示
随时间t的变化曲线如图所示
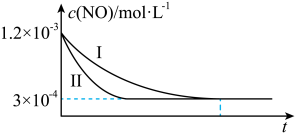
①根据图像可以得出的结论是_______ 。
②实验Ⅱ中, 平衡转化率为
平衡转化率为_______ %。
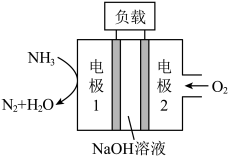
(4)瑞典ASES公司设计的常用于驱动潜艇的液氨-液氧环保燃料电池如图所示。该燃料电池工作时,正极为电极_______ (填“1”或“2”),负极的电极反应式为_______
 可以缓解大气中
可以缓解大气中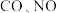 污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.
污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.| 实验编号 |  |  初始浓度/ 初始浓度/ |  初始浓度/ 初始浓度/ | 催化剂的比表面积/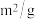 |
| Ⅰ | 280 | 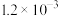 | 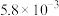 | 82 |
| Ⅱ | 280 | 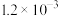 | b | 124 |
| Ⅲ | 350 | a | 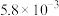 | 82 |
(1)控制变量是科学研究的重要方法,因此表中数据:a=
(2)对比实验Ⅰ、Ⅲ的目的是
(3)实验Ⅰ和实验Ⅱ中,
 的物质的量浓度
的物质的量浓度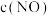 随时间t的变化曲线如图所示
随时间t的变化曲线如图所示
①根据图像可以得出的结论是
②实验Ⅱ中,
 平衡转化率为
平衡转化率为(4)瑞典ASES公司设计的常用于驱动潜艇的液氨-液氧环保燃料电池如图所示。该燃料电池工作时,正极为电极

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】工业上H2O2是一种重要的绿色氧化还原试剂,某小组对H2O2的催化分解实验进行探究。回答下列问题:
(1)在同浓度Fe3+的催化下,探究外界条件对H2O2分解反应速率的影响。实验装置如图所示:
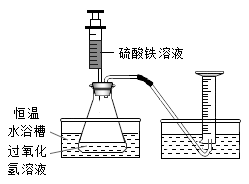
①H2O2溶液在Fe3+催化下分解的反应历程如下:
第一步反应历程为:2Fe3+ + H2O2 = 2Fe2+ +O2 +2H+
第二步反应历程为:________ ;
除了图中所示仪器之外,该实验还必需的仪器是________ 。
②请完成下面表格中I、II、III的实验记录内容或数据:
V1=________ ,V2=________ ;根据所学的知识判断,当三个实验中均产生10ml气体时,所需反应时间最长的是___________ (填“t1”、“t2”或“t3”)
(2)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。

①由图中信息可知________ 法制取得到的催化剂活性更高。
②推测Co2+、Ni2+两种离子中催化效果更好的是________ 。
(1)在同浓度Fe3+的催化下,探究外界条件对H2O2分解反应速率的影响。实验装置如图所示:

①H2O2溶液在Fe3+催化下分解的反应历程如下:
第一步反应历程为:2Fe3+ + H2O2 = 2Fe2+ +O2 +2H+
第二步反应历程为:
除了图中所示仪器之外,该实验还必需的仪器是
②请完成下面表格中I、II、III的实验记录内容或数据:
| 实验编号 | 0.1mol•L﹣1Fe2(SO4)3 | 0.1mol•L﹣1H2O2溶液 | 蒸馏水(mL) | 反应温度/℃ | 反应时间(秒) |
| Ⅰ | 2mL | 20mL | 0 | 20 | t1 |
| Ⅱ | 2mL | V1mL | 2mL | 20 | t2 |
| Ⅲ | V2 mL | 20mL | 0 | 50 | t3 |
(2)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。

①由图中信息可知
②推测Co2+、Ni2+两种离子中催化效果更好的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
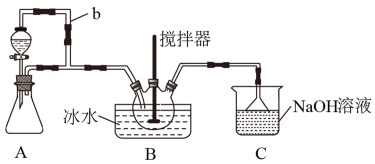
(1)装置A制取SO2
①A中反应的化学方程式为___ 。
②导管b的作用是___ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___ (只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___ 。
(3)装置C的主要作用是___ (用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___ 。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__ MnO4-+__ C2O42-+__ =__ Mn2++__ +__ H2O
②滴定终点时的现象为___ 。
③亚硝酰硫酸的纯度=___ 。(精确到0.1%)[M(NOSO4H)=127g·mol-1]

(1)装置A制取SO2
①A中反应的化学方程式为
②导管b的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是
(3)装置C的主要作用是
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:
②滴定终点时的现象为
③亚硝酰硫酸的纯度=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】高锰酸钾(KMnO4)又名灰锰氧,在实验室、化工生产、医疗等领域有广泛的应用。某实验小组利用MnO2为原料,与KClO3和KOH共熔制得锰酸钾,再利用歧化法制备高锰酸钾。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置___
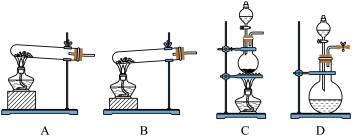
(2)①步骤Ⅰ中,墨绿色熔融物为___ (化学式)。
②反应1的化学方程式为___ 。
③铁坩埚不能换成瓷坩埚,原因是___ 。
(3)步骤Ⅱ中控制反应温度的方法是___ 。
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
由表中数据得到结论____ 。
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是___ 。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置

(2)①步骤Ⅰ中,墨绿色熔融物为
②反应1的化学方程式为
③铁坩埚不能换成瓷坩埚,原因是
(3)步骤Ⅱ中控制反应温度的方法是
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
| 实验编号 | pH值 | 产量/g | 平均产率/% |
| 1 | 11.04 | 2.06 | 56.5 |
| 2 | 10.50 | 2.24 | 61.7 |
| 3 | 10.00 | 2.33 | 64.2 |
| 4 | 9.50 | 2.13 | 58.6 |
| 5 | 9.04 | 1.86 | 51.3 |
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50 mL密度为1.1 g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示。
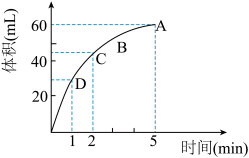
请依图回答下列问题:
(1)放出一半气体所需要的时间为_________________ ;
(2)A、B、C、D各点反应速率快慢的顺序是__________________ ;
(3)在5min后,收集到的气体体积不再增加,原因是______________________ ;
(4)过氧化氢溶液的初始物质的量浓度为__________ mol•L-1(保留两位有效数字)。
(5)在2L的密闭容器中充入一定量的SO3 气体,在一定温度和催化剂作用下,发生反应:2SO3 2SO2+O2,4min时达平衡状态,测得n(O2)=0.8mol,n(SO3)=6.4mol。求:氧气的生成速率v(O2)
2SO2+O2,4min时达平衡状态,测得n(O2)=0.8mol,n(SO3)=6.4mol。求:氧气的生成速率v(O2)_______ mol/(L·min),SO3的转化率______ ,此温度下平衡常数K=_______ 。

请依图回答下列问题:
(1)放出一半气体所需要的时间为
(2)A、B、C、D各点反应速率快慢的顺序是
(3)在5min后,收集到的气体体积不再增加,原因是
(4)过氧化氢溶液的初始物质的量浓度为
(5)在2L的密闭容器中充入一定量的SO3 气体,在一定温度和催化剂作用下,发生反应:2SO3
 2SO2+O2,4min时达平衡状态,测得n(O2)=0.8mol,n(SO3)=6.4mol。求:氧气的生成速率v(O2)
2SO2+O2,4min时达平衡状态,测得n(O2)=0.8mol,n(SO3)=6.4mol。求:氧气的生成速率v(O2)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】资料显示,酸性介质中, 和
和 反应转化为
反应转化为 和
和 。小组探究利用该反应测定
。小组探究利用该反应测定 含量的条件。
含量的条件。
(1)实验Ⅱ中反应的离子方程式是___________ 。
(2)实验Ⅰ的条件下 能将
能将 氧化为
氧化为 ,推测实验Ⅰ未出现紫色的原因:
,推测实验Ⅰ未出现紫色的原因:________ 。
(3)经检验,棕黑色沉淀为 ,针对实验Ⅲ中的现象,提出以下假设:
,针对实验Ⅲ中的现象,提出以下假设:
假设1: 的浓度较低,不足以将
的浓度较低,不足以将 氧化为
氧化为
假设2:溶液中存在还原剂 ,将生成的
,将生成的 ,还原为
,还原为
①甲同学分析上述实验设计,认为假设1不成立,理由是___________ 。
②针对假设2,乙同学设计实验Ⅳ证实了推测合理。
请写出实验操作和现象:___________ 。
③实验Ⅲ中生成 的离子方程式是
的离子方程式是___________ ,从化学反应原理的角度分析实验Ⅲ未得到紫色溶液的原因:___________ 。
(4)资料表明 可作为
可作为 和
和 反应转化为
反应转化为 的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向
的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向___________ 中滴加2滴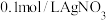 溶液,再加入
溶液,再加入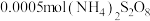 固体,加热至沸腾,观察到溶液变为紫色。
固体,加热至沸腾,观察到溶液变为紫色。
(5)根据上述实验,要利用 将
将 转化为
转化为 的反应来快速测定
的反应来快速测定 的含量,应控制的反应条件有;加热至沸腾、
的含量,应控制的反应条件有;加热至沸腾、___________ 。
 和
和 反应转化为
反应转化为 和
和 。小组探究利用该反应测定
。小组探究利用该反应测定 含量的条件。
含量的条件。| 实验 | 序号 | 物质a | 实验现象 |
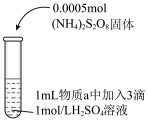 | Ⅰ |  溶液 溶液 | 无明显变化 |
| Ⅱ |  溶液 溶液 | 加热至沸腾, 后溶液变为紫色 后溶液变为紫色 | |
| Ⅲ |  溶液 溶液 | 加热至沸腾,生成大量棕黑色沉淀,静置,上层溶液未变紫色 |
(1)实验Ⅱ中反应的离子方程式是
(2)实验Ⅰ的条件下
 能将
能将 氧化为
氧化为 ,推测实验Ⅰ未出现紫色的原因:
,推测实验Ⅰ未出现紫色的原因:(3)经检验,棕黑色沉淀为
 ,针对实验Ⅲ中的现象,提出以下假设:
,针对实验Ⅲ中的现象,提出以下假设:假设1:
 的浓度较低,不足以将
的浓度较低,不足以将 氧化为
氧化为
假设2:溶液中存在还原剂
 ,将生成的
,将生成的 ,还原为
,还原为
①甲同学分析上述实验设计,认为假设1不成立,理由是
②针对假设2,乙同学设计实验Ⅳ证实了推测合理。
请写出实验操作和现象:
③实验Ⅲ中生成
 的离子方程式是
的离子方程式是(4)资料表明
 可作为
可作为 和
和 反应转化为
反应转化为 的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向
的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向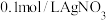 溶液,再加入
溶液,再加入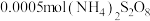 固体,加热至沸腾,观察到溶液变为紫色。
固体,加热至沸腾,观察到溶液变为紫色。(5)根据上述实验,要利用
 将
将 转化为
转化为 的反应来快速测定
的反应来快速测定 的含量,应控制的反应条件有;加热至沸腾、
的含量,应控制的反应条件有;加热至沸腾、
您最近一年使用:0次



