明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分为ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn基态原子核外电子排布式为_______ ,基态Zn原子电子占据最高能级的电子云轮廓图为_______ 形。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为_______ (写出一种)。
②氨是_______ 分子(“极性”或“非极性”),氨的热稳定性强于膦(PH3),原因是_______ 。
(3)黄铜是铜和锌组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu<IZn的原因是_______ 。
(4)《本草纲目》中记载炉甘石(主要成分为ZnCO3)可止血、消肿毒、生肌、明目等。Zn、C、O的电负性由大至小的顺序是_______ 。
(1)Zn基态原子核外电子排布式为
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO
 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为②氨是
(3)黄铜是铜和锌组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu<IZn的原因是
(4)《本草纲目》中记载炉甘石(主要成分为ZnCO3)可止血、消肿毒、生肌、明目等。Zn、C、O的电负性由大至小的顺序是
更新时间:2021-02-25 09:07:03
|
相似题推荐
【推荐1】电子工业对超细银粉的需求不断增加,制备过程如下:先将纯银粉溶于浓硝酸,室温下加氨水调节pH至8~9,搅拌下加入分散剂PEG与水合肼混合液,过滤、干燥、研磨得产品。
(1)Ag在周期表中与Cu相邻,Ag原子的基态外围电子排布式为_______ 。
(2)银粉溶于浓硝酸的离子方程式为_______ 。
(3) Ag+直接与水合肼反应过于激烈,加入氨水使反应更加平稳的原因是_______ 。
(4)在pH<4时,加入分散剂PEG与水合肼混合液未发现银单质生成,原因是_______ 。
(5)I-在AgI晶胞中位置如图所示,已知Ag+周围有距离最近且相等的4个I-,请画出Ag+在晶胞中的位置_______ 。
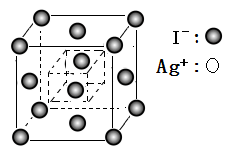
(1)Ag在周期表中与Cu相邻,Ag原子的基态外围电子排布式为
(2)银粉溶于浓硝酸的离子方程式为
(3) Ag+直接与水合肼反应过于激烈,加入氨水使反应更加平稳的原因是
(4)在pH<4时,加入分散剂PEG与水合肼混合液未发现银单质生成,原因是
(5)I-在AgI晶胞中位置如图所示,已知Ag+周围有距离最近且相等的4个I-,请画出Ag+在晶胞中的位置

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐2】X、Y、Z、W四种短周期主族元素,原子序数依次递增,X原子中有3个能量相等且自旋方向相同的电子,Y是地壳中含量最多的元素,Y与W同主族,Z在短周期主族元素中金属性最强。回答下列问题:
(1)X、Y、Z、W四种元素的原子半径从大到小的顺序为_______ (填元素符号)。
(2)元素Y的原子轨道表示式为_______ 。
(3)元素X与元素Y的简单气态氢化物中,稳定性较强的是_______ (填电子式)。
(4)Z原子的结构示意图为_______ 。
(5)W元素在元素周期表中的位置为_______ ,其价电子排布式为_______ 。
(1)X、Y、Z、W四种元素的原子半径从大到小的顺序为
(2)元素Y的原子轨道表示式为
(3)元素X与元素Y的简单气态氢化物中,稳定性较强的是
(4)Z原子的结构示意图为
(5)W元素在元素周期表中的位置为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】矿物斜长石(主要成分为KAlSi3O8)在一定温度范围内用氯化钠熔浸可制得氯化钾,反应原理是NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯原子最外层的电子排布式___ ;氧原子核外电子的轨道式___ ;铝原子核外有___ 种不同能量的电子。
(2)上述反应涉及的元素中,原子半径最大的是___ 。该反应中位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是___ ;从原子结构方面去分析钠元素的金属性强于铝元素的原因是___ 。
(3)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行对照实验(保持其它条件不变),获得如下数据:
①分析以上数据可以得出,氯化钠熔浸钾长石是___ (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是___ (选填编号)。
a.充分搅拌 b.延长反应时间
c.增大反应体系的压强 d.将钾长石粉碎成更小的颗粒
(2)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l) NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?___ ,(填“能说明”或“不能说明”)原因是___ 。
 KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。(1)氯原子最外层的电子排布式
(2)上述反应涉及的元素中,原子半径最大的是
(3)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行对照实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ― |
②950℃时,欲提高熔出钾的速率可以采取的措施是
a.充分搅拌 b.延长反应时间
c.增大反应体系的压强 d.将钾长石粉碎成更小的颗粒
(2)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】完成下列问题。
(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是_______ 。
a. b.
b.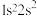 c.
c. d.
d.
(2)已知下图均与第三周期的主族元素有关。
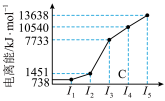
图甲
图甲表示第一至第五电离能数据,则该元素的原子有_______ 种不同运动状态的电子,基态原子未成对电子数为_______ 。
(3)以 燃料电池为电源电解法制取
燃料电池为电源电解法制取 ,二氧化氯(
,二氧化氯( )为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
)为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
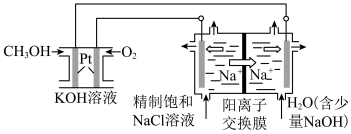
①图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ,阳极产生
,阳极产生 的反应式为
的反应式为_______ 。
②电解一段时间,从阴极处收集到的气体比阳极处收集到气体多1.12L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_______ mol(精确到小数点后两位)。
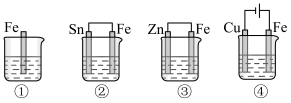
(4)下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是_______。
(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是
a.
 b.
b.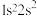 c.
c. d.
d.
(2)已知下图均与第三周期的主族元素有关。

图甲
图甲表示第一至第五电离能数据,则该元素的原子有
(3)以
 燃料电池为电源电解法制取
燃料电池为电源电解法制取 ,二氧化氯(
,二氧化氯( )为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
)为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取
 ,阳极产生
,阳极产生 的反应式为
的反应式为②电解一段时间,从阴极处收集到的气体比阳极处收集到气体多1.12L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为
(4)下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是_______。

| A.④>②>③>① | B.②>①>③>④ | C.④>②>①>③ | D.③>②>④>① |
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】A、B、C、D、E、F、G为前四周期元素且核电荷数依次增大,A元素原子核外电子只有一种运动状态,B、D同周期且p轨道上都有两个未成对的电子,E元素的一种单质为E8,分子结构呈现皇冠形,A与F同族,G是d区族序数最大但质子数最小的元素。
(1)G的核外电子排布式为_______
(2)C的基态电子轨道表示式为_______
(3)七种元素中,电负性最大、电负性最小和原子半径最小的三种元素,形成化合物X的电子式为_______ 。
(4)B、C、D三元素第一电离能由大到小的顺序为_______ (用元素符号表示)。
(5)D、E形成的三原子分子y,VSEPR构型为_______ ,中心原子杂化方式为_______ 。
(6)B、C、F、G形成的某种化合物,可用于检验G的+2价离子,该反应的现象是_______ 。
(1)G的核外电子排布式为
(2)C的基态电子轨道表示式为
(3)七种元素中,电负性最大、电负性最小和原子半径最小的三种元素,形成化合物X的电子式为
(4)B、C、D三元素第一电离能由大到小的顺序为
(5)D、E形成的三原子分子y,VSEPR构型为
(6)B、C、F、G形成的某种化合物,可用于检验G的+2价离子,该反应的现象是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】【化学—选修3:物质结构与性质】
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为_____________________ 。
(2)锗、砷、硒的第一电离能大小排序为_____________ 。H2SeO4的酸性比H2SeO3的强,其原因是_______________________ 。
(3)H2SeO3的中心原子杂化类型是_________ ;SeO32- 的立体构型是_________ 。与SeO32- 互为等电体的分子有(写一种物质的化学式即可)____________ 。
(4)H2Se属于___________ (填“极性”或“非极性”)分子;单质硒的熔点为217℃,它属于________ 晶体。
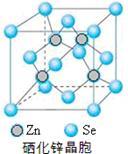
(5)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____________ ;若该晶胞密度为ρg•cm-3,硒化锌的摩尔质量为M g/mol。NA代表阿伏伽德罗常数,则晶胞参数a为______________ pm。
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为
(2)锗、砷、硒的第一电离能大小排序为
(3)H2SeO3的中心原子杂化类型是
(4)H2Se属于

(5)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】美国医学家证实了三价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的电子排布式为___________ ;
(2)O、N、S、Cr的第一电离能由大到小的顺序为___________ ;
(3)SO2分子的空间构型为___________ ,SO 中心原子的杂化方式为
中心原子的杂化方式为___________ ;
(4)CO2分子中含π键的数目为___________ ,它的等电子体中属于分子的有___________ (任写一种) ;
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·2H2O,该物质配离子中提供孤电子对的原子为___________ ;
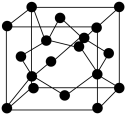
(6)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞的棱长为___________ pm(列出计算式)。
(1)Cr的电子排布式为
(2)O、N、S、Cr的第一电离能由大到小的顺序为
(3)SO2分子的空间构型为
 中心原子的杂化方式为
中心原子的杂化方式为(4)CO2分子中含π键的数目为
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·2H2O,该物质配离子中提供孤电子对的原子为
(6)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞的棱长为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】75号元素铼Re,熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。回答下列问题:
(1)锰原子价层电子的轨道表示式为__ ,锰处于周期表的__ 区。
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
①与铜离子形成配合物的分子或离子应具备的结构特征是__ 。
②醋酸根中C原子的杂化类型为__ ,1mol配离子[Cu(NH3)2]+中含有σ键的数目为__ 。
③写出与NH3互为等电子体的一种离子的化学式__ 。
(3)锰与铼处于同一族,金属铼的熔点高于锰,原因是___ 。
(4)三氧化铼为立方晶胞,晶胞参数为apm,三氧化铼的摩尔质量为Mg/mol;铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为__ ,铼原子填在了氧原子围成的空隙中___ (填“四面体”“立方体”或“八面体”),三氧化铼的密度为__ g/cm3。(用NA表示阿伏加 德罗常数的值)
(1)锰原子价层电子的轨道表示式为
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2]Ac+CO+NH3
 [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)①与铜离子形成配合物的分子或离子应具备的结构特征是
②醋酸根中C原子的杂化类型为
③写出与NH3互为等电子体的一种离子的化学式
(3)锰与铼处于同一族,金属铼的熔点高于锰,原因是
(4)三氧化铼为立方晶胞,晶胞参数为apm,三氧化铼的摩尔质量为Mg/mol;铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】硼及其化合物在工业中有很多用处。一些硼的卤化物的沸点如图所示:
(1)硼原子的核外共有_______ 种形状不同的电子云;溴原子的最外层电子排布式为_______ 。
(2)上表中三种卤化物分子的空间构型均为平面正三角形,由此推断F-B-F的键角为_______ ,BF3属于_______ 分子(填“极性”或“非极性”)。
(3)解释表中三种卤化硼沸点存在差异的原因_______ 。
| 卤化物 |  |  |  |
| 沸点/℃ | -100.3 | 12.5 | 90 |
(2)上表中三种卤化物分子的空间构型均为平面正三角形,由此推断F-B-F的键角为
(3)解释表中三种卤化硼沸点存在差异的原因
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】已知  和
和 可以形成
可以形成  和
和  两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
① 内的
内的 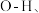 水分子间的范德华力和氢键,从强到弱依次为
水分子间的范德华力和氢键,从强到弱依次为___________ ;
②用球棍模型表示的水分子结构是 ; 可与
可与  形成
形成 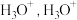 中的
中的 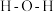 键角比
键角比  的键角
的键角___________ 。(填“大”或“小”)
(2)已知 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角
分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角 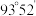 ,而两个
,而两个  键与
键与  键的夹角均为
键的夹角均为 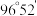 。
。
请回答下列问题:
① 子的电子式是
子的电子式是___________ ,结构式是___________ 。
② 分子是含有
分子是含有___________ 键和___________ 键的___________ (填“极性”或“非极性”)分子。
③ 能与水混溶,却不溶于
能与水混溶,却不溶于  试剂,请予以解释:
试剂,请予以解释:___________ 。
 和
和 可以形成
可以形成  和
和  两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题: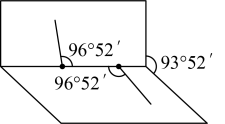
①
 内的
内的  水分子间的范德华力和氢键,从强到弱依次为
水分子间的范德华力和氢键,从强到弱依次为②用球棍模型表示的水分子结构是 ;
A. 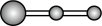 B.
B. 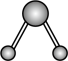 C.
C.  D.
D.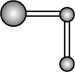
 可与
可与  形成
形成 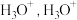 中的
中的 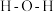 键角比
键角比  的键角
的键角(2)已知
 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角
分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角 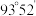 ,而两个
,而两个  键与
键与  键的夹角均为
键的夹角均为 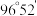 。
。请回答下列问题:
①
 子的电子式是
子的电子式是②
 分子是含有
分子是含有③
 能与水混溶,却不溶于
能与水混溶,却不溶于  试剂,请予以解释:
试剂,请予以解释:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】回答下列问题
(1)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
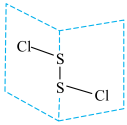
①S2Cl2的结构式为___________ , 的化学键类型为
的化学键类型为___________ (填“极性键”、“非极性键”或“极性键和非极性键”),它是___________ (填“极性”或“非极性”)分子。
②电负性:S___________ Cl (填“>”或“<”), 中硫的化合价为
中硫的化合价为___________ 。
③S2Cl2分子中S原子的杂化轨道类型为___________ ,每个S原子有 ___________ 对孤电子对。
(2)毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2 CaCN2+C;
CaCN2+C; ;
; 与水反应生成尿素
与水反应生成尿素 ;尿素合成三聚氰胺。
;尿素合成三聚氰胺。
①基态钙原子电子占据的最高能级符号是___________ ,其核外共有___________ 种不同能量的电子。
② 中阴离子为
中阴离子为 ,
, 与CO2分子空间结构相似,由此可以推知
与CO2分子空间结构相似,由此可以推知 的空间结构为
的空间结构为___________ 。
③尿素分子 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为___________ 。
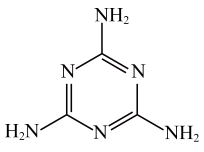
④三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为___________ 。
(1)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。

①S2Cl2的结构式为
 的化学键类型为
的化学键类型为②电负性:S
 中硫的化合价为
中硫的化合价为③S2Cl2分子中S原子的杂化轨道类型为
(2)毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C
 CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2 CaCN2+C;
CaCN2+C; ;
;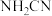 与水反应生成尿素
与水反应生成尿素 ;尿素合成三聚氰胺。
;尿素合成三聚氰胺。①基态钙原子电子占据的最高能级符号是
②
 中阴离子为
中阴离子为 ,
, 与CO2分子空间结构相似,由此可以推知
与CO2分子空间结构相似,由此可以推知 的空间结构为
的空间结构为③尿素分子
 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为④三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为

您最近一年使用:0次

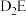 的沸点比
的沸点比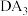 的沸点低,其原因是
的沸点低,其原因是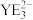 的键角比
的键角比 的键角小的原因是
的键角小的原因是

