常温下,向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,滴定曲线如图所示。
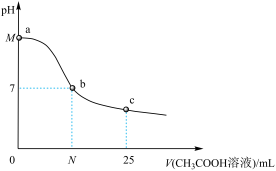
下列说法中不正确 的是

下列说法中
| A.a点对应的M=13 |
| B.b点对应的N>12.5 |
| C.曲线ab(不含a、b点)上总是存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.c点对应的溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
21-22高三上·北京昌平·期末 查看更多[3]
(已下线)专题10 溶液中离子浓度的关系(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练黑龙江省哈尔滨市第一六二中学2021-2022学年高三上学期第三次月考化学试题北京市昌平区2021届高三上学期期末考试化学试题
更新时间:2021-03-08 10:29:41
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】室温下,向20.00mL0.1000mol•L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与pH随加如稀硫酸体积的变化如图所示。下列说法正确的是
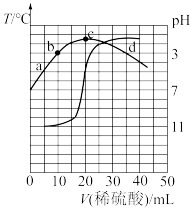

| A.稀硫酸的浓度为0.1000mol•L-1 |
| B.室温下MOH的电离平衡常数Kb=1.0×10-6 |
| C.b点对应的溶液中:2c(OH-)+c(MOH)=c(M+)+2c(H+) |
D.当pH=7时,溶液中存在c(H+)=c(OH-)<c(M+)<c(SO ) ) |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃,图中曲线Ⅰ是 溶液滴定
溶液滴定 醋酸的滴定曲线;曲线Ⅱ为0.1000mol/L盐酸滴定25mL、c mol/L氨水的滴定曲线。已知
醋酸的滴定曲线;曲线Ⅱ为0.1000mol/L盐酸滴定25mL、c mol/L氨水的滴定曲线。已知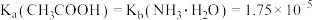 。下列叙述错误的是
。下列叙述错误的是

 溶液滴定
溶液滴定 醋酸的滴定曲线;曲线Ⅱ为0.1000mol/L盐酸滴定25mL、c mol/L氨水的滴定曲线。已知
醋酸的滴定曲线;曲线Ⅱ为0.1000mol/L盐酸滴定25mL、c mol/L氨水的滴定曲线。已知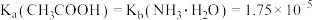 。下列叙述错误的是
。下列叙述错误的是
| A.水的电离程度:b>a |
| B.由曲线Ⅰ可确定NaOH溶液滴定醋酸时可选用酚酞作指示剂 |
C.a点离子浓度从大到小的顺序为c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
D.将曲线Ⅰ和曲线Ⅱ的c点溶液混合,溶液中存在c( )=c(CH3COO-) )=c(CH3COO-) |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】常温下,用0.10mol/LNaOH溶液分别滴定20.00mL起始浓度也均为0.1mol/L的一元弱酸HX和HY溶液,已知HX电离程度小于HY,且当 时,可以认为弱酸达电离平衡时的浓度近似等于起始浓度,其滴定曲线如图所示,下列说法正确的是
时,可以认为弱酸达电离平衡时的浓度近似等于起始浓度,其滴定曲线如图所示,下列说法正确的是

 时,可以认为弱酸达电离平衡时的浓度近似等于起始浓度,其滴定曲线如图所示,下列说法正确的是
时,可以认为弱酸达电离平衡时的浓度近似等于起始浓度,其滴定曲线如图所示,下列说法正确的是
A.图中曲线I对应的为HY,II电离常数为 |
B.在 和 和 两点对应的溶液中,满足 两点对应的溶液中,满足 |
C.两条曲线终点坐标分别为 、 、 ,两曲线相比,曲线I选用酚酞作终点指示剂误差更小 ,两曲线相比,曲线I选用酚酞作终点指示剂误差更小 |
| D.当溶液pH=7时,曲线Ⅱ加入NaOH物质的量与剩余酸的物质的量之比为1:10 |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,向100 mL 0.1 mol·L-1 H2A溶液中滴加0.1 mol·L-1 NaOH溶液,测得混合溶液中pc(H2A)、pc(HA-)、pc(A2-)随pH的变化曲线如图所示[已知:X代表H2A、HA-、A2-,pc(X)=-lgc(X)]。下列说法正确的是


| A.曲线III代表pc(H2A)与溶液pH的变化关系 |
| B.H2A的电离常数Ka1=1×10-5 |
| C.水的电离程度:c>b>a |
| D.b点对应的溶液中,c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】温度为t℃时,在l0mLl.0mol·L-1的盐酸中,逐滴滴入xmol·L-1的氨水,随着氨水逐渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如下图所示(忽略混合时溶液体积的变化)。下列有关判断正确的是
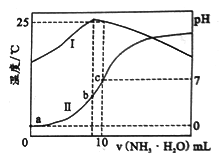

| A.x=1.0 |
| B.a点时,水的电离程度最大 |
| C.b点时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
D.c 点时,c(NH3·H2O)= mol·L-1 mol·L-1 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列有关溶液中粒子浓度的关系式中,正确的是( )

| A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① |
| B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
| C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+) |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,下列有关叙述正确的是
| A.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
B.同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c( )大小顺序为:①=②>③ )大小顺序为:①=②>③ |
C.Na2CO3溶液中,2c(Na+)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
| D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐3】25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,NH3·H2O的电离平衡常数Kb=1.75×10-5,现在25 ℃时向10 mL浓度均为0.1 mol·L-1的HCl和CH3COOH的混合溶液中逐滴加入0.1 mol·L-1的氨水,溶液的pH变化曲线如图所示。下列有关说法不正确的是( )


| A.A点到B点,溶液的导电性逐渐减小 |
| B.整个过程中,C点处水的电离程度最大 |
| C.pH =7时对应的点应在C点和D点之间,此时溶液中存在:c(NH4+)=c(CH3COO-)+c(CH3COOH) |
| D.D点处:c(NH4+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+) |
您最近半年使用:0次

 溶液,滴定过程中的pH变化如下图所示。下列分析正确的是
溶液,滴定过程中的pH变化如下图所示。下列分析正确的是

 时,溶液中
时,溶液中


