常温下,有甲、乙两份体积均为1L,浓度均为0.1mol•L-1的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH变为a;②乙与等体积、浓度为0.1mol•L-1的HCl混合,在混合溶液中:n(NH )+n(H+)-n(OH-)=bmol.则a、b正确的答案组合是
)+n(H+)-n(OH-)=bmol.则a、b正确的答案组合是
 )+n(H+)-n(OH-)=bmol.则a、b正确的答案组合是
)+n(H+)-n(OH-)=bmol.则a、b正确的答案组合是| A.9~11之间;0.1 | B.9~11之间;0.05 |
| C.12~13之间;0.2 | D.13;0.1 |
更新时间:2021-03-18 17:46:06
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A. | B. | C. | D.OH-的物质的量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】在0.1mol∙L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向逆反应方向移动 |
| C.加入少量0.1mol∙L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向逆反应方向移动 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】室温下,用含少量 的
的 溶液制备
溶液制备 的过程如图所示。已知
的过程如图所示。已知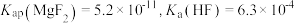 。下列说法不正确的是
。下列说法不正确的是

 的
的 溶液制备
溶液制备 的过程如图所示。已知
的过程如图所示。已知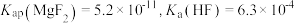 。下列说法不正确的是
。下列说法不正确的是
A.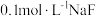 溶液中: 溶液中: |
B.“除镁"得到的上层清液中: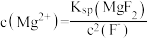 |
C.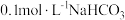 溶液中: 溶液中: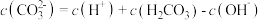 |
D.“沉锰”时发生反应的离子方程式: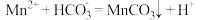 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
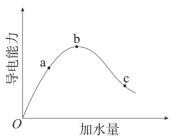
【推荐2】用0.1mol/L NaOH溶液滴定10mL 0.1mol/L盐酸,利用电导率传感器可绘制滴定过程中的电导率曲线如下图所示。下列说法错误的是
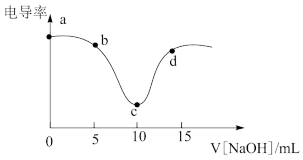

| A.电导率最低点c点就是酸碱中和滴定的终点 |
| B.由图所知,随着NaOH溶液增加,溶液pH先变小后变大 |
C.b、c、d点都存在: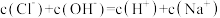 |
| D.a点电导率最大是因为此时溶液中导电微粒浓度最高 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】25℃时,用HCl气体调节0.1mol/L氨水的pH,溶液中微粒浓度的对数值(lgc、反应物的物质的量之比[n(HCl)/n(NH3·H2O)]与pH的关系如下图。若忽略通入气体后溶液体积的变化。下列说法错误的是
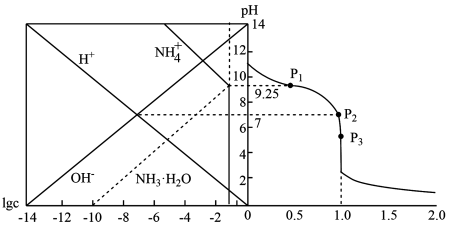

| A.P2所示溶液中:c(Cl-)>c(NH3·H2O) |
| B.P1所示溶液中:c(Cl-)<0.05mol/L |
C.[n(HCl)/n(NH3·H2O)]=1.5时溶液中: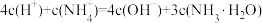 |
| D.25℃时,NH4Cl水解平衡常数数量级为10-10 |
您最近一年使用:0次