磷酸亚铁锂( )电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
)电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
(1)下列关于Li原子电子排布图表示的状态中,能量最高的为___ (填标号)。
a.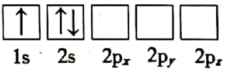
b.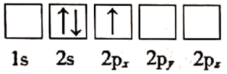
c.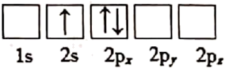
d.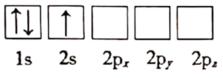
(2)LiFePO4中PO 的空间构型为
的空间构型为___ ,与其互为等电子体的分子有___ (填一种即可)。
(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3、PI3,则他们的熔点由高到低的顺序为___ ,键角由小到大的顺序为___ 。
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是___ (填元素符号),判断依据是___ 。
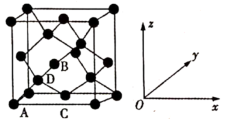
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为__ 。
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为__ g∙cm−3(用含x的式子表示)。
 )电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
)电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:(1)下列关于Li原子电子排布图表示的状态中,能量最高的为
a.

b.

c.

d.

(2)LiFePO4中PO
 的空间构型为
的空间构型为(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3、PI3,则他们的熔点由高到低的顺序为
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是

(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为
更新时间:2021-05-07 13:59:49
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】铝镍钴系永磁合金以铁,镍、铝元素为主要成分,还含有铜、钴、钛等元素.具有高剩磁和低温度系数,磁性稳定.现多用于仪表工业中制造磁电系仪表、流量计、微特电机,继电器等。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,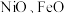 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为________ ,熔沸点:
____  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(2) 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是___________ 。
(3)氢能源发展的关键环节是新型储氢材料,氨硼烷 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
①氨硼烷分子中B原子采取_________ 杂化。
②氨硼烷晶体中存在的作用力有范德华力,极性键、________ 和________ 。
(4)立方氮化硼 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
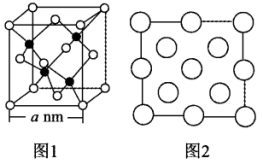
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置________ 。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,
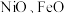 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(2)
 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是(3)氢能源发展的关键环节是新型储氢材料,氨硼烷
 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。①氨硼烷分子中B原子采取
②氨硼烷晶体中存在的作用力有范德华力,极性键、
(4)立方氮化硼
 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
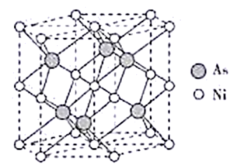
【推荐2】Ⅰ.(1)下列晶体中,属于离子晶体的是_______ 。
A. B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是_______ 。
A.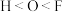 B.
B.  C.
C. 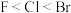 D.
D. 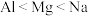
(3)下列能级中轨道数为5的是_______ 。
A. 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级
(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为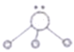 ,以下叙述正确的是
,以下叙述正确的是_______ 。
A. 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形
C. 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关 键、π键说法中
键、π键说法中不正确 的是_______ 。
A. 分子中有2个
分子中有2个 键,2个π键
键,2个π键
B. 气体单质中,一定有 键,可能有π键
键,可能有π键
C. 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强
D. 两个原子之间形成共价键时,最多有一个 键
键
Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为_______ , 成为阳离子时首先失去
成为阳离子时首先失去_______ 轨道电子。
(2)金属 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子_______ 。
(3)已知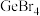 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为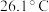 ,沸点为
,沸点为 ,则
,则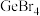 晶体类型为
晶体类型为_______ ,中心原子的杂化类型为_______ 。
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是_______ 。
(5) 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
_______  。
。
A.
 B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是
A.
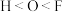 B.
B.  C.
C. 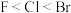 D.
D. 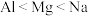
(3)下列能级中轨道数为5的是
A.
 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。
 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为 ,以下叙述正确的是
,以下叙述正确的是A.
 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形C.
 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关
 键、π键说法中
键、π键说法中A.
 分子中有2个
分子中有2个 键,2个π键
键,2个π键B. 气体单质中,一定有
 键,可能有π键
键,可能有π键C.
 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强D. 两个原子之间形成共价键时,最多有一个
 键
键Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 成为阳离子时首先失去
成为阳离子时首先失去(2)金属
 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子(3)已知
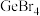 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为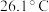 ,沸点为
,沸点为 ,则
,则 晶体类型为
晶体类型为(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但
 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是(5)
 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
 。
。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】按要求回答下列问题:
(1)黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是2Cu2O+Cu2S 6Cu+SO2↑。则29Cu的外围电子轨道表示式为
6Cu+SO2↑。则29Cu的外围电子轨道表示式为____ ;比较Cu2O与Cu2S,熔点较高的是____ ,原因为____ 。
(2)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为____ ;该晶体中原子之间的作用力是____ 。
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似(如图),该晶体储氢后的化学式应为____ 。

(4)铁有δ、γ、α三种同素异形体(如图),γ晶体晶胞中所含有的铁原子数为____ ,δ、α两种晶胞中铁原子的配位数之比为____ 。

(1)黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是2Cu2O+Cu2S
 6Cu+SO2↑。则29Cu的外围电子轨道表示式为
6Cu+SO2↑。则29Cu的外围电子轨道表示式为(2)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似(如图),该晶体储氢后的化学式应为

(4)铁有δ、γ、α三种同素异形体(如图),γ晶体晶胞中所含有的铁原子数为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】硒( )在电子工业中可用于光电管、太阳能电池,硒元素可形成多种化合物。
)在电子工业中可用于光电管、太阳能电池,硒元素可形成多种化合物。
(1)单质硒的熔点为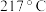 ,它属于
,它属于___________ 晶体。
(2)基态硒原子中,核外电子占据的最高能级的符号是___________ 。
(3)与硒元素相邻的同周期元素有砷和溴,这三种元素的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(4) 的立体构型是
的立体构型是___________ ;与 互为等电子体的分子有
互为等电子体的分子有___________ (写一种物质的化学式即可)。
(5) 水溶液比
水溶液比 水溶液的酸性强,原因是
水溶液的酸性强,原因是___________ 。
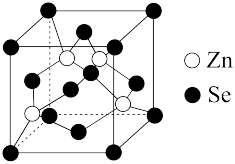
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________ 。
 )在电子工业中可用于光电管、太阳能电池,硒元素可形成多种化合物。
)在电子工业中可用于光电管、太阳能电池,硒元素可形成多种化合物。(1)单质硒的熔点为
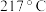 ,它属于
,它属于(2)基态硒原子中,核外电子占据的最高能级的符号是
(3)与硒元素相邻的同周期元素有砷和溴,这三种元素的第一电离能由小到大的顺序为
(4)
 的立体构型是
的立体构型是 互为等电子体的分子有
互为等电子体的分子有(5)
 水溶液比
水溶液比 水溶液的酸性强,原因是
水溶液的酸性强,原因是(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】铁系元素是第一过渡系列第VIII族的三个相邻元素——Fe、Co、Ni,它们是人体必需的微量元素,也是现代工业和高新技术的重要材料。
(1)基态Ni的轨道中未成对电子有___________ 个。
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。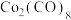 常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测
常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测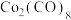 是
是___________ (填“极性”或“非极性”)分子;写出CO的结构式:___________ 。
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故 在酸性溶液中常发生水解:
在酸性溶液中常发生水解: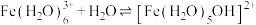 (配离子)
(配离子)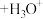 。则配离子中
。则配离子中 的配位数为
的配位数为___________ ,1mol该配离子所含σ键的数目为___________ (设 为阿伏伽德罗常数)。
为阿伏伽德罗常数)。
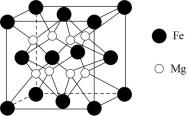
(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为___________ 。
(1)基态Ni的轨道中未成对电子有
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。
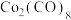 常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测
常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测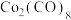 是
是
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故
 在酸性溶液中常发生水解:
在酸性溶液中常发生水解: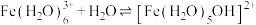 (配离子)
(配离子)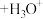 。则配离子中
。则配离子中 的配位数为
的配位数为 为阿伏伽德罗常数)。
为阿伏伽德罗常数)。(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为

您最近一年使用:0次
【推荐3】明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分为ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn基态原子核外电子排布式为_______ ,基态Zn原子电子占据最高能级的电子云轮廓图为_______ 形。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为_______ (写出一种)。
②氨是_______ 分子(“极性”或“非极性”),氨的热稳定性强于膦(PH3),原因是_______ 。
(3)黄铜是铜和锌组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu<IZn的原因是_______ 。
(4)《本草纲目》中记载炉甘石(主要成分为ZnCO3)可止血、消肿毒、生肌、明目等。Zn、C、O的电负性由大至小的顺序是_______ 。
(1)Zn基态原子核外电子排布式为
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO
 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为②氨是
(3)黄铜是铜和锌组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu<IZn的原因是
(4)《本草纲目》中记载炉甘石(主要成分为ZnCO3)可止血、消肿毒、生肌、明目等。Zn、C、O的电负性由大至小的顺序是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】M、N、R、X、Y五种元素在元素周期表中的位置如下图所示。元素M和R的原子序数之和等于N的原子序数,元素R和X的原子序数之和等于Y的原子序数。
(1)N的元素名称为_______ 。
(2)在同周期元素中,比元素M的第一电离能小的元素有______ 种。
(3)元素M与元素X、Y形可成化合物MX3、MY3,MY3分子中元素Y的化合价为+1价。
①化合物MX3分子构型为_______ 。
②比较MX3、MY3键角大小∠XMX_____ ∠YMY(填“>”、“<”或“=”)
(4)基团的诱导效应对有机酸的酸性有较大的影响。有机酸的酸性强弱可用电离常数的负对数pKa的大小来衡量,则pKa(CH2XCOOH)____ pKa(CH3COOH)(填“>”、“<”或“=”)
(5)元素X的简单氢化物HX极易溶于水,其重要原因是HX分子可以跟水分子形成氢键,那么在HX的水溶液中可能存在的氢键类型有_____ 种。
(6)化合物XeX2的晶体属四方晶系,晶胞参数如图所示(晶胞棱边夹角均为90°)。已知Xe-X键长为rpm,晶胞中O、C间距离d=___ pm。
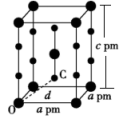
| M | R | X |
| N | Y |
(2)在同周期元素中,比元素M的第一电离能小的元素有
(3)元素M与元素X、Y形可成化合物MX3、MY3,MY3分子中元素Y的化合价为+1价。
①化合物MX3分子构型为
②比较MX3、MY3键角大小∠XMX
(4)基团的诱导效应对有机酸的酸性有较大的影响。有机酸的酸性强弱可用电离常数的负对数pKa的大小来衡量,则pKa(CH2XCOOH)
(5)元素X的简单氢化物HX极易溶于水,其重要原因是HX分子可以跟水分子形成氢键,那么在HX的水溶液中可能存在的氢键类型有
(6)化合物XeX2的晶体属四方晶系,晶胞参数如图所示(晶胞棱边夹角均为90°)。已知Xe-X键长为rpm,晶胞中O、C间距离d=

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
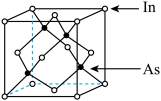
【推荐2】砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是____________ 。
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。已知:AsCl3和InCl3均为分子晶体。AsCl3沸点为130℃,InCl3沸点为500℃
①33As简化的电子排布式为___________ 。
②AsCl3分子的空间结构为___________ 。
③AsCl3沸点低于InCl3沸点的原因是___________ 。
④InCl3晶体中分子间存在配位键,配位原子是___________ 。
(3)InAs为原子之间以共价键的成键方式结合而成的晶体,其晶胞结构如图所示。已知该晶胞棱长为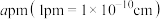 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
___________ g·cm-3。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。已知:AsCl3和InCl3均为分子晶体。AsCl3沸点为130℃,InCl3沸点为500℃

①33As简化的电子排布式为
②AsCl3分子的空间结构为
③AsCl3沸点低于InCl3沸点的原因是
④InCl3晶体中分子间存在配位键,配位原子是
(3)InAs为原子之间以共价键的成键方式结合而成的晶体,其晶胞结构如图所示。已知该晶胞棱长为
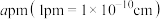 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】氟及其化合物用途十分广泛,回答下列问题:
(1)基态氟原子核外电子运动状态有___________ 种;
(2) 的熔点为
的熔点为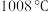 ,熔化呈液态时能导电;
,熔化呈液态时能导电; 的熔点为
的熔点为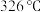 ,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置
,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置___________ ; 的基态价电子排布图为:
的基态价电子排布图为:___________ ;由信息可知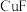 晶体类型是
晶体类型是___________ (填“离子晶体”、“共价晶体”或“分子晶体”)。
(3)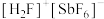 (氟锑酸)是一种超强酸,阳离子
(氟锑酸)是一种超强酸,阳离子 的杂化类型为
的杂化类型为___________ ,其离子空间构型为___________ 。
(4) 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为___________  (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,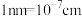 )。
)。

(1)基态氟原子核外电子运动状态有
(2)
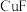 的熔点为
的熔点为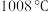 ,熔化呈液态时能导电;
,熔化呈液态时能导电; 的熔点为
的熔点为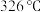 ,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置
,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置 的基态价电子排布图为:
的基态价电子排布图为: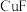 晶体类型是
晶体类型是(3)
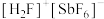 (氟锑酸)是一种超强酸,阳离子
(氟锑酸)是一种超强酸,阳离子 的杂化类型为
的杂化类型为(4)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,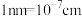 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】填空。
(1)铁及其化合物在生活中有广泛应用。Fe3+基态核外电子排布式为_______ 。
(2)实验室用KSCN溶液检验Fe3+。类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______ 。
(3)某铁的化合物结构简式如图1所示。

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②上述化合物中氮原子的杂化方式为_______ ,_______ 。
(4)利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图2所示。
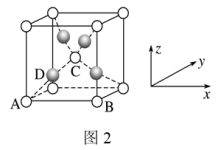
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为( ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为_______ ,它代表_______ 原子。
(1)铁及其化合物在生活中有广泛应用。Fe3+基态核外电子排布式为
(2)实验室用KSCN溶液检验Fe3+。类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是
(3)某铁的化合物结构简式如图1所示。

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为
②上述化合物中氮原子的杂化方式为
(4)利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图2所示。

该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(
 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】氮族元素包括氮(N)、磷(P)、砷( )、锑(
)、锑( )、铋(
)、铋( )和镆(
)和镆( )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
(1) 基态原子核外电子排布式为
基态原子核外电子排布式为___________ , 基态原子核外有
基态原子核外有___________ 个未成对电子。
(2) 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是___________ 。
(4) 离子中P的杂化类型为
离子中P的杂化类型为___________ , 分子的空间构型均为
分子的空间构型均为___________ ,其键角依次减小的原因是___________ 。
(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为___________ ,该晶体密度为___________  (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
 )、锑(
)、锑( )、铋(
)、铋( )和镆(
)和镆( )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:(1)
 基态原子核外电子排布式为
基态原子核外电子排布式为 基态原子核外有
基态原子核外有(2)
 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、
 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是(4)
 离子中P的杂化类型为
离子中P的杂化类型为 分子的空间构型均为
分子的空间构型均为(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为
 (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。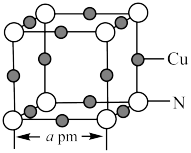
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】铁和硫及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态 的价电子排布图为
的价电子排布图为______ 。
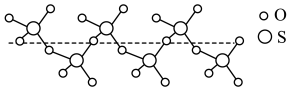
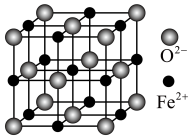
(2)某种硫的氧化物冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示,从该结构片段分析可知该物质的化学式为______ ,两种原子的第一电离能大小关系是______ 。
(3)有机铁肥三硝酸六尿素合铁(Ⅲ)的化学式为 。尿素分子中C原子的杂化方式是
。尿素分子中C原子的杂化方式是______ , 中“
中“ ”与
”与 (Ⅲ)之间的作用力是
(Ⅲ)之间的作用力是______ ,根据价层电子对互斥理论推测 的空间构型为
的空间构型为____________ 。
(4) 可用
可用 检验,
检验, 对应的酸有两种,分别为硫氰酸
对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸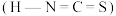 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是______ ,原因是_________________________________________ 。
(5)立方 晶体的晶胞结构如图所示,其晶胞边长为
晶体的晶胞结构如图所示,其晶胞边长为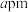 ,列式表示
,列式表示 晶体的密度:
晶体的密度:______  (用含
(用含 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 )。
)。
(1)基态
 的价电子排布图为
的价电子排布图为(2)某种硫的氧化物冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示,从该结构片段分析可知该物质的化学式为

(3)有机铁肥三硝酸六尿素合铁(Ⅲ)的化学式为
 。尿素分子中C原子的杂化方式是
。尿素分子中C原子的杂化方式是 中“
中“ ”与
”与 (Ⅲ)之间的作用力是
(Ⅲ)之间的作用力是 的空间构型为
的空间构型为(4)
 可用
可用 检验,
检验, 对应的酸有两种,分别为硫氰酸
对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸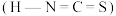 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是(5)立方
 晶体的晶胞结构如图所示,其晶胞边长为
晶体的晶胞结构如图所示,其晶胞边长为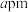 ,列式表示
,列式表示 晶体的密度:
晶体的密度: (用含
(用含 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次



