处理烟气中SO2常采用的方法有CO还原法和碱液吸收法。请回答下列问题:
I.水煤气还原法﹒
已知:i.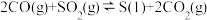
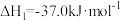
ii.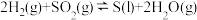
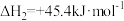
(1)写出CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式:_______ 。若该反应在恒温、恒容体系中进行,达到平衡的标志为_______ (填选项字母)
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.H2O(g)与H2(g)的体积比保持不变
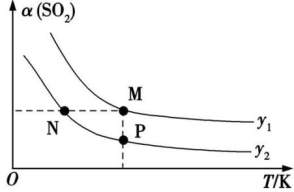
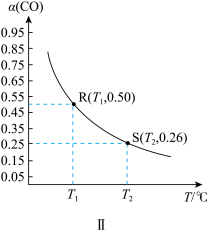
(2)一定压强下,发生反应 ,平衡时
,平衡时 的转化率
的转化率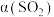 与投料比的比值[
与投料比的比值[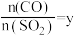 ]、温度T的关系如图所示。比较平衡时,
]、温度T的关系如图所示。比较平衡时, 的转化率
的转化率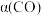 :N
:N_______ M(填“>”“<”或“=”,下同),逆反应速率:N_______ P
(3)T℃,向10L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii,5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①该温度下,反应ii的平衡常数K=_______ 。
②其他条件不变,6min时缩小容器体积。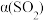
_______ (填“增大”“减小”或“不变”)
II.碱液吸收法
步骤1:用足量氨水吸收SO2
步骤2:再加入熟石灰,发生反应:2 +Ca2++2OH-+
+Ca2++2OH-+ =CaSO3↓+2NH3·H2O
=CaSO3↓+2NH3·H2O
(4)已知:25℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b,该温度下,步骤2中反应的平衡常数K=_______ (用含a、b的代数式表示)。
I.水煤气还原法﹒
已知:i.
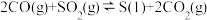
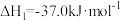
ii.
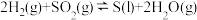
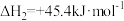
(1)写出CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式:
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.H2O(g)与H2(g)的体积比保持不变
(2)一定压强下,发生反应
 ,平衡时
,平衡时 的转化率
的转化率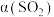 与投料比的比值[
与投料比的比值[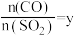 ]、温度T的关系如图所示。比较平衡时,
]、温度T的关系如图所示。比较平衡时, 的转化率
的转化率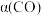 :N
:N
(3)T℃,向10L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii,5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①该温度下,反应ii的平衡常数K=
②其他条件不变,6min时缩小容器体积。
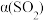
II.碱液吸收法
步骤1:用足量氨水吸收SO2
步骤2:再加入熟石灰,发生反应:2
 +Ca2++2OH-+
+Ca2++2OH-+ =CaSO3↓+2NH3·H2O
=CaSO3↓+2NH3·H2O(4)已知:25℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b,该温度下,步骤2中反应的平衡常数K=
更新时间:2021-05-14 09:23:52
|
相似题推荐
【推荐1】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1

(1)若用4.48 L CH4还原NO生成N2,则放出的热量为_____ kJ(保留两位小数)。(气体体积已折算为标准状况下)
(2)用电化学处理含NO3—的废水,电解的原理如图1所示,则电解时阴极的电极反应式为__ ;
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(3)T1时,该反应的化学平衡常数的数值为_____ 。
(4)下列说法不正确的是_____ (填字母)。
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)  CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(5)250~300 ℃时,乙酸的生成速率减小的主要原因是__________ 。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1

(1)若用4.48 L CH4还原NO生成N2,则放出的热量为
(2)用电化学处理含NO3—的废水,电解的原理如图1所示,则电解时阴极的电极反应式为
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)
 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。(3)T1时,该反应的化学平衡常数的数值为
(4)下列说法不正确的是
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,在原容器中充入一定量氦气,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb<Kd |
 CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。(5)250~300 ℃时,乙酸的生成速率减小的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。回答下列问题:
(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ/mol
NO(g)+ O2(g)=NO2(g) △H=-58.2kJ/mol
O2(g)=NO2(g) △H=-58.2kJ/mol
写出NO与臭氧(O3)反应生成NO2的热化学方程式_____________ 。
(2)温度为T1时,在三个容积均为1L的密闭容器中仅发生反应:
2NO(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
实验测得:v正=v(NO)消耗= 2v(O2) 消耗= k正c2(NO)·c(O2),v逆=v(NO2) 消耗= k逆c2 (NO2),k正、k逆为速率常数,受温度影响。
①温度为T1时,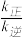 =
=________ ;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m_________ n(填“>”、“<“或“=”)。
②若容器Ⅱ中达到平衡时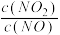 =1,则NO的转化率为
=1,则NO的转化率为______ ,x=_______ 。
③容器Ⅲ中起始时v正___________ v逆(填“>”、“<”或“=”)。

④T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随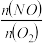 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是___________ ;当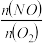 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的___________ 。
(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ/mol
NO(g)+
 O2(g)=NO2(g) △H=-58.2kJ/mol
O2(g)=NO2(g) △H=-58.2kJ/mol写出NO与臭氧(O3)反应生成NO2的热化学方程式
(2)温度为T1时,在三个容积均为1L的密闭容器中仅发生反应:
2NO(g)+O2(g)
 2NO2(g) △H<0
2NO2(g) △H<0实验测得:v正=v(NO)消耗= 2v(O2) 消耗= k正c2(NO)·c(O2),v逆=v(NO2) 消耗= k逆c2 (NO2),k正、k逆为速率常数,受温度影响。
| 容器编号 | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
| c(NO) | c(O2) | c(NO2) | c(O2) | |
| I | 0.6 | 0.3 | 0 | 0.2 |
| II | 0.5 | x | 0.3 | |
| III | 0.3 | 0.25 | 0.2 | |
①温度为T1时,
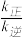 =
=②若容器Ⅱ中达到平衡时
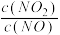 =1,则NO的转化率为
=1,则NO的转化率为③容器Ⅲ中起始时v正

④T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随
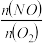 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是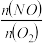 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
您最近一年使用:0次
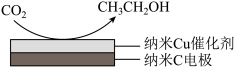
【推荐3】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:
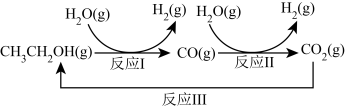
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式_____________________________ 。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图
(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
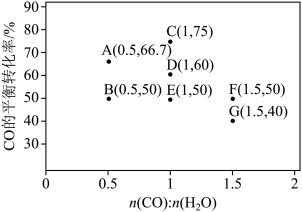
① 经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=________ (填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是________ 。
② 对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是_____________________________________________________________ 。
③ 比较A、B两点对应的反应速率大小:VA______ VB(填“<” “=”或“>”)。反应速率v=v正-v逆=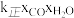 -
- ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时 =
=__________ (计算结果保留1位小数)。
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中lg =
=____________________________________ (列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是_____________________________________________________________________ 。

(1)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/molCH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol请写出反应I的热化学方程式
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图
(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

① 经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=
② 对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是
③ 比较A、B两点对应的反应速率大小:VA
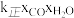 -
- ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时 =
=(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中lg
 =
=②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是

您最近一年使用:0次
【推荐1】铝鞣剂[主要成分为Al(OH)2Cl]主要用于鞣制皮革。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂的一种工艺如图:

回答下列问题:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________ 。“水解”采用90℃而不在室温下进行的原因是_________________ 。
(2)“酸溶”时,Al2O3发生反应的离子方程式为____________________ 。
(3)“氧化”时,发生反应的离子方程式为________________________ 。
(4)“除杂”时产生废渣的主要成分为____ (填化学式),对其合理的处理方法是回收后制成___ 。
(5)准确称取所制备的铝鞣剂mg,将其置于足量硝酸中,待样品完全溶解后,加入足量AgNO3溶液,充分反应,过滤、洗涤、干燥得固体ng.则样品中Al(OH)2Cl的质量分数为____ (用含m、n的代数式表示)。

回答下列问题:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为
(2)“酸溶”时,Al2O3发生反应的离子方程式为
(3)“氧化”时,发生反应的离子方程式为
(4)“除杂”时产生废渣的主要成分为
(5)准确称取所制备的铝鞣剂mg,将其置于足量硝酸中,待样品完全溶解后,加入足量AgNO3溶液,充分反应,过滤、洗涤、干燥得固体ng.则样品中Al(OH)2Cl的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如图:
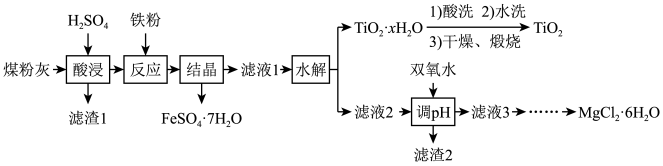
已知:酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离出SO 和一种阳离子。
和一种阳离子。
请回答下列问题:
(1)为了提高酸浸效率,可以采取的措施有_______ 。
(2)“反应”时加入铁粉的作用是_______ (用离子方程式表示)。
(3)资料显示,硫酸亚铁在不同温度下结晶可分别得到不同产物。其溶解度曲线如图所示,则结晶得 的操作是
的操作是_______ 、_______ ,过滤,冷水洗涤,干燥。

(4)“水解”反应的离子方程式是_______ 。所得TiO2·xH2O沉淀进行水洗的具体操作_______ 。
(5)滤渣2的主要成分为_______ (写化学式)。

已知:酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离出SO
 和一种阳离子。
和一种阳离子。请回答下列问题:
(1)为了提高酸浸效率,可以采取的措施有
(2)“反应”时加入铁粉的作用是
(3)资料显示,硫酸亚铁在不同温度下结晶可分别得到不同产物。其溶解度曲线如图所示,则结晶得
 的操作是
的操作是
(4)“水解”反应的离子方程式是
(5)滤渣2的主要成分为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮的化合物在工农业生产中有着重要的作用,氮的化合物也会对大气及水体等产生污染,在利用这些物质的同时,治理和减少污染是重要的课题。
(1)NH3和N2H4是氮元素的两种重要的氢化物。
①结合NH3分子的结构和性质,解释NH3常用作制冷剂的原因___________ 。
②N2H4能使锅炉内壁的铁锈(Fe2O3·xH2O)变成磁性氧化层,减缓锅炉锈蚀,且不产生污染物。写出N2H4与铁锈反应的化学方程式为___________ 。
(2)NO和NO2是氮元素的两种常见的氧化物,它们之间可以相互转化。NOx会导致光化学烟雾的形成。
① 由以下反应复合而成。
由以下反应复合而成。
反应Ⅰ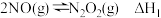
反应II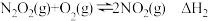
其反应进程与能量变化的关系示意图如所示。

NO氧化为NO2的总反应速率由反应Ⅱ控制,原因是___________ 。在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T1和T2(T1>T2),测得c(NO)随t(时间)的变化曲线如图所示。由图可知,转化相同量的NO,在温度T1下消耗的时间较长,其可能的原因是___________ 。
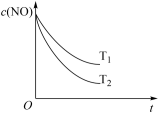
②光化学烟雾形成时,部分物质发生光化学反应的过程如图,虚线方框内的过程可描述为___________ 。

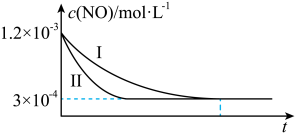
(3)含铈溶液可以处理大气中的氮氧化物,并可通过电解法再生。铈元素(Ce)常见的化合价有+3价、+4价。NO可以被含Ce4+的溶液吸收,生成 、
、 。可采用电解法将上述吸收液中的
。可采用电解法将上述吸收液中的 转化为无毒物质,同时再生Ce4+,其原理如图所示。阴极的电极反应式为
转化为无毒物质,同时再生Ce4+,其原理如图所示。阴极的电极反应式为___________ 。

(1)NH3和N2H4是氮元素的两种重要的氢化物。
①结合NH3分子的结构和性质,解释NH3常用作制冷剂的原因
②N2H4能使锅炉内壁的铁锈(Fe2O3·xH2O)变成磁性氧化层,减缓锅炉锈蚀,且不产生污染物。写出N2H4与铁锈反应的化学方程式为
(2)NO和NO2是氮元素的两种常见的氧化物,它们之间可以相互转化。NOx会导致光化学烟雾的形成。
①
 由以下反应复合而成。
由以下反应复合而成。反应Ⅰ
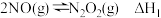
反应II
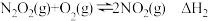
其反应进程与能量变化的关系示意图如所示。

NO氧化为NO2的总反应速率由反应Ⅱ控制,原因是

②光化学烟雾形成时,部分物质发生光化学反应的过程如图,虚线方框内的过程可描述为

(3)含铈溶液可以处理大气中的氮氧化物,并可通过电解法再生。铈元素(Ce)常见的化合价有+3价、+4价。NO可以被含Ce4+的溶液吸收,生成
 、
、 。可采用电解法将上述吸收液中的
。可采用电解法将上述吸收液中的 转化为无毒物质,同时再生Ce4+,其原理如图所示。阴极的电极反应式为
转化为无毒物质,同时再生Ce4+,其原理如图所示。阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】100℃时,将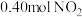 气体充入
气体充入 的真空密闭容器中发生反应:
的真空密闭容器中发生反应: ,每隔一段时间就对该容器内的物质进行测量,得到下表数据:
,每隔一段时间就对该容器内的物质进行测量,得到下表数据:
(1)从反应开始至 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为___________ 。
(2)100℃时,该反应的化学平衡常数的数值为___________ (保留两位有效数字)。
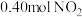 气体充入
气体充入 的真空密闭容器中发生反应:
的真空密闭容器中发生反应: ,每隔一段时间就对该容器内的物质进行测量,得到下表数据:
,每隔一段时间就对该容器内的物质进行测量,得到下表数据:| 时间/s | 0 | 20 | 40 | 60 | 80 |
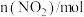 | 0.40 | a | 0.26 | b | c |
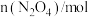 | 0.00 | 0.05 | d | 0.08 | 0.08 |
(1)从反应开始至
 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为(2)100℃时,该反应的化学平衡常数的数值为
您最近一年使用:0次
【推荐2】金、银是生活中常见的贵金属,用途非常广泛。从某矿渣(主要成分为:AgCl、 、
、 、
、 )中获取高纯银的流程如图所示:
)中获取高纯银的流程如图所示:

已知: ,
,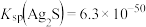 .
.
(1)“预处理”前需先将矿渣粉碎制浆的原因是_______ ;加入 溶液将
溶液将 转化为AgCl,该反应的化学方程式为
转化为AgCl,该反应的化学方程式为_______ .
(2)“分银”时AgCl与 反应生成
反应生成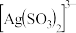 的离子方程式为
的离子方程式为_______ ,该反应的平衡常数
_______ 。(已知: ,
, )
)
(3)“分银渣”主要成分为 、
、 、
、_______ (填化学式)。
(4)“分银”时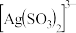 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液pH变化的关系如图2。
随溶液pH变化的关系如图2。

①“分银”pH应控制在_______ 范围。
②“沉银”时的终点pH需控制在3.5~5.5范围内,不能过低的原因是_______ .
 、
、 、
、 )中获取高纯银的流程如图所示:
)中获取高纯银的流程如图所示:
已知:
 ,
,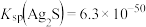 .
.(1)“预处理”前需先将矿渣粉碎制浆的原因是
 溶液将
溶液将 转化为AgCl,该反应的化学方程式为
转化为AgCl,该反应的化学方程式为(2)“分银”时AgCl与
 反应生成
反应生成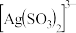 的离子方程式为
的离子方程式为
 ,
, )
)(3)“分银渣”主要成分为
 、
、 、
、(4)“分银”时
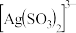 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液pH变化的关系如图2。
随溶液pH变化的关系如图2。
①“分银”pH应控制在
②“沉银”时的终点pH需控制在3.5~5.5范围内,不能过低的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲烷的转化和利用在天然气化工行业有非常重要的作用,用甲烷来处理一些工业废气就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(1)甲烷-水蒸气重整技术主要是制备合成气(CO和H2混合气体)。其反应为:CH4(g)+H2O (g) CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
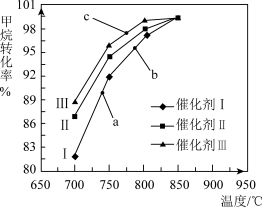
如图为反应压强为0.3MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,经过一定的反应时间,甲烷−水蒸气重整反应中CH4转化率随温度变化的关系。下列说法正确的是_______。
(2)CH4超干重整CO2技术也可得到富合CO的化工原料,CH4(g)+CO2 (g)  2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:

①据图可知, p1、p2、p3、p4由大到小的顺序为_______ ,理由是_______ 。
②在压为p4、950℃的条件下,X点平衡常数Kp=_______ 。(用含p4的代数式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)用甲烷燃料电池作为电化学降解NO 装置的直流电源时,应将A与
装置的直流电源时,应将A与_______ 相连(填a或b,下同),阴极反应式为_______ 。

(4)CH4在催化条件下可以将硝酸厂尾气NO2还原为N2,主要反应原理为:CH4(g)+2NO2 (g) CO2(g)+2H2O(g) +N2(g) △H=﹣868.7 kJ·mol-1,在体积为2L的密闭容器A(500℃,恒温)中加入2 molCH4、2 molNO2和催化剂。A容器中CH4的转化率a(CH4)随时间变化如下表所示。
CO2(g)+2H2O(g) +N2(g) △H=﹣868.7 kJ·mol-1,在体积为2L的密闭容器A(500℃,恒温)中加入2 molCH4、2 molNO2和催化剂。A容器中CH4的转化率a(CH4)随时间变化如下表所示。
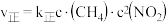 ,
,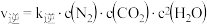 (
(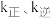 分别是正、逆反应速率常数),则A容器中平衡时
分别是正、逆反应速率常数),则A容器中平衡时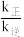 =
= _______ 。200s时
_______ 。
(1)甲烷-水蒸气重整技术主要是制备合成气(CO和H2混合气体)。其反应为:CH4(g)+H2O (g)
 CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
如图为反应压强为0.3MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,经过一定的反应时间,甲烷−水蒸气重整反应中CH4转化率随温度变化的关系。下列说法正确的是_______。
| A.在相同条件下,三种催化剂 Ⅰ、Ⅱ、Ⅲ 的催化效率由高到低的顺序是 Ⅰ>Ⅱ>Ⅲ |
| B.b点反应速率高于a点 |
| C.C 点一定未达到平衡状态 |
| D.催化剂只改变反应速率不改变平衡移动,所以在850∘C时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时 CH4的转化率相同 |
 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:
①据图可知, p1、p2、p3、p4由大到小的顺序为
②在压为p4、950℃的条件下,X点平衡常数Kp=
(3)用甲烷燃料电池作为电化学降解NO
 装置的直流电源时,应将A与
装置的直流电源时,应将A与
(4)CH4在催化条件下可以将硝酸厂尾气NO2还原为N2,主要反应原理为:CH4(g)+2NO2 (g)
 CO2(g)+2H2O(g) +N2(g) △H=﹣868.7 kJ·mol-1,在体积为2L的密闭容器A(500℃,恒温)中加入2 molCH4、2 molNO2和催化剂。A容器中CH4的转化率a(CH4)随时间变化如下表所示。
CO2(g)+2H2O(g) +N2(g) △H=﹣868.7 kJ·mol-1,在体积为2L的密闭容器A(500℃,恒温)中加入2 molCH4、2 molNO2和催化剂。A容器中CH4的转化率a(CH4)随时间变化如下表所示。| 时间(s/t) | 0 | 100 | 200 | 300 | 400 |
| A中a(CH4)(%) | 0 | 10 | 20 | 25 | 25 |
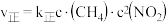 ,
,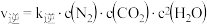 (
(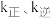 分别是正、逆反应速率常数),则A容器中平衡时
分别是正、逆反应速率常数),则A容器中平衡时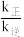 =
= 
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在一定条件下发生反应: 可以缓解大气中
可以缓解大气中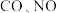 污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.
污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.
回答下列问题:
(1)控制变量是科学研究的重要方法,因此表中数据:a=_______ ,b=_______
(2)对比实验Ⅰ、Ⅲ的目的是_______
(3)实验Ⅰ和实验Ⅱ中, 的物质的量浓度
的物质的量浓度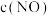 随时间t的变化曲线如图所示
随时间t的变化曲线如图所示
①根据图像可以得出的结论是_______ 。
②实验Ⅱ中, 平衡转化率为
平衡转化率为_______ %。
(4)瑞典ASES公司设计的常用于驱动潜艇的液氨-液氧环保燃料电池如图所示。该燃料电池工作时,正极为电极_______ (填“1”或“2”),负极的电极反应式为_______
 可以缓解大气中
可以缓解大气中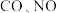 污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.
污染问题.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示.| 实验编号 | 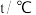 |  初始浓度/ 初始浓度/ |  初始浓度/ 初始浓度/ | 催化剂的比表面积/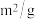 |
| Ⅰ | 280 | 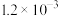 | 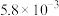 | 82 |
| Ⅱ | 280 | 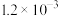 | b | 124 |
| Ⅲ | 350 | a | 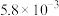 | 82 |
(1)控制变量是科学研究的重要方法,因此表中数据:a=
(2)对比实验Ⅰ、Ⅲ的目的是
(3)实验Ⅰ和实验Ⅱ中,
 的物质的量浓度
的物质的量浓度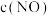 随时间t的变化曲线如图所示
随时间t的变化曲线如图所示
①根据图像可以得出的结论是
②实验Ⅱ中,
 平衡转化率为
平衡转化率为(4)瑞典ASES公司设计的常用于驱动潜艇的液氨-液氧环保燃料电池如图所示。该燃料电池工作时,正极为电极

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】为实现我国承诺的“碳达峰、碳中和”目标,中国科学院提出了“液态阳光”方案,即将工业生产过程中排放的二氧化碳转化为甲醇,其中反应之一是:CO(g)+2H2(g) CH3OH(g) ΔH。回答下列问题:
CH3OH(g) ΔH。回答下列问题:
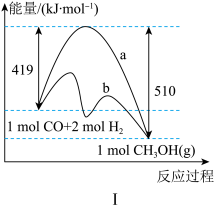
(1)该反应的能量变化如图Ⅰ所示,反应的ΔH=_______ ,曲线 _______ (填“a”或“b”)表示使用了催化剂。
(2)下列措施既能加快反应速率,又能提高CO转化率的是_______
(3)相同温度下,若已知反应CO2(g)+3H2(g) CH3OH(g)+H2O的平衡常数为K1,反应CO2(g)+H2(g)
CH3OH(g)+H2O的平衡常数为K1,反应CO2(g)+H2(g) CO(g)+H2O的平衡常数为K2,则反应CO(g)+2H2(g)
CO(g)+H2O的平衡常数为K2,则反应CO(g)+2H2(g) CH3OH(g)的化学平衡常数K=
CH3OH(g)的化学平衡常数K=_______ (用含K1和K2的代数式表示)。
(4)在恒温恒容密闭容器中按n(H2)/n(CO)=2加入反应起始物
Ⅰ.下列描述不能说明反应达到平衡状态的是_______ 。
A.容器内压强不再变化
B.氢气的转化率达到最大值
C.容器内CO与H2的浓度相等
D.容器内CO的体积分数不再变化
Ⅱ.若CO的平衡转化率[α(CO)]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:Kp(R)_______ Kp(S)(填“>”、“=”或“<”)。T1温度下,测得起始压强P0=102kPa,达平衡时P(CH3OH)=_______ kPa。
 CH3OH(g) ΔH。回答下列问题:
CH3OH(g) ΔH。回答下列问题:(1)该反应的能量变化如图Ⅰ所示,反应的ΔH=

(2)下列措施既能加快反应速率,又能提高CO转化率的是_______
| A.升高温度 | B.增大压强 | C.降低温度 | D.增加H2投料量 |
 CH3OH(g)+H2O的平衡常数为K1,反应CO2(g)+H2(g)
CH3OH(g)+H2O的平衡常数为K1,反应CO2(g)+H2(g) CO(g)+H2O的平衡常数为K2,则反应CO(g)+2H2(g)
CO(g)+H2O的平衡常数为K2,则反应CO(g)+2H2(g) CH3OH(g)的化学平衡常数K=
CH3OH(g)的化学平衡常数K=(4)在恒温恒容密闭容器中按n(H2)/n(CO)=2加入反应起始物
Ⅰ.下列描述不能说明反应达到平衡状态的是
A.容器内压强不再变化
B.氢气的转化率达到最大值
C.容器内CO与H2的浓度相等
D.容器内CO的体积分数不再变化
Ⅱ.若CO的平衡转化率[α(CO)]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:Kp(R)

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】我国力争于2030年前做到碳达峰,2060年前实现碳中和。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H,该反应一般认为通过如下步骤来实现:
CH3OH(g)+ H2O(g) △H,该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1 =+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
则总反应的△H=_______ 。
(2)一定温度下,下列措施既能加快反应CO2(g) +3H2(g) CH3OH(g)+ H2O(g) 的速率且能提高甲醇平衡产率的是_______ (填选项字母)。
CH3OH(g)+ H2O(g) 的速率且能提高甲醇平衡产率的是_______ (填选项字母)。
(3)如图为CO2平衡转化率和温度、压强的关系,其中压强为3.0 MPa、4.0 MPa和5.0 MPa。

①设CO2的初始浓度为c0,根据5.0MPa时的数据计算Kc(240K)=_______ (列计算式)。
②若在4.0MPa时减小进料浓度比c(CO2):c(H2),则CO2的平衡转化率曲线可能位于4.0MPa曲线的_______ (填“ 上方”或“下方”)。实际工业生产中往往按照化学计量比进料,原因是_______ 。(填两点)
(4)进一步研究合成总反应在起始物n(H2 )/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5 ×105Pa下的x(CH3OH)~t如图所示。
①图中对应等压过程的曲线是_______ , 判断的理由_______ 。
②当x(CH3OH)=0.10时,CO2的平衡转化率α=_______ % (保留一位小数),反应条件可能为_______ 或_______ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2(g)
 CH3OH(g)+ H2O(g) △H,该反应一般认为通过如下步骤来实现:
CH3OH(g)+ H2O(g) △H,该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g)=CO(g)+H2O(g) △H1 =+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
则总反应的△H=
(2)一定温度下,下列措施既能加快反应CO2(g) +3H2(g)
 CH3OH(g)+ H2O(g) 的速率且能提高甲醇平衡产率的是_______ (填选项字母)。
CH3OH(g)+ H2O(g) 的速率且能提高甲醇平衡产率的是_______ (填选项字母)。| A.及时移去甲醇 | B.加入催化剂 |
| C.提高反应物浓度 | D.减小容器体积 |

①设CO2的初始浓度为c0,根据5.0MPa时的数据计算Kc(240K)=
②若在4.0MPa时减小进料浓度比c(CO2):c(H2),则CO2的平衡转化率曲线可能位于4.0MPa曲线的
(4)进一步研究合成总反应在起始物n(H2 )/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5 ×105Pa下的x(CH3OH)~t如图所示。

①图中对应等压过程的曲线是
②当x(CH3OH)=0.10时,CO2的平衡转化率α=
您最近一年使用:0次



