元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)工业上利用铬铁矿(FeO·Cr2O3)冶炼铬的工艺流程如图所示:
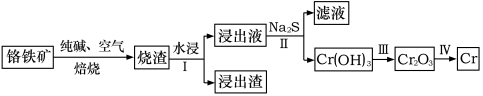
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___ 。
②“水浸Ⅰ”要获得“浸出液”的操作是____ 。已知“浸出液”的主要成分为Na2CrO4,则Cr2O3在高温焙烧时反应的化学方程式为___ 。
③若向“滤液”中加入盐酸酸化的氯化钡溶液有白色沉淀生成,则操作Ⅱ发生反应的离子方程式为___ 。
(2)含有Cr2O 的废水毒性较大,某工厂为了使废水的排放达标,进行如下处理:
的废水毒性较大,某工厂为了使废水的排放达标,进行如下处理:
Cr2O
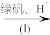 Cr3+、Fe3+
Cr3+、Fe3+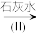 Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为___ 。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为____ 。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
(1)工业上利用铬铁矿(FeO·Cr2O3)冶炼铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是
②“水浸Ⅰ”要获得“浸出液”的操作是
③若向“滤液”中加入盐酸酸化的氯化钡溶液有白色沉淀生成,则操作Ⅱ发生反应的离子方程式为
(2)含有Cr2O
 的废水毒性较大,某工厂为了使废水的排放达标,进行如下处理:
的废水毒性较大,某工厂为了使废水的排放达标,进行如下处理:Cr2O

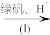 Cr3+、Fe3+
Cr3+、Fe3+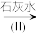 Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为
21-22高三上·山东滨州·阶段练习 查看更多[3]
更新时间:2021-09-30 16:33:43
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】氧化铋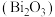 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有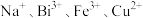 等。
等。
②盐酸羟胺常用作还原剂。
③ 在
在 时开始水解,
时开始水解,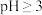 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。
④常温下部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
回答下列问题:
(1) 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为____________ 形。
(2)“滤渣1”的主要成分有 、
、____________ ,工业上以纯碱、石灰石、____________ (填化学式)为原料生产普通玻璃。
(3)写出“酸浸”步骤中 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:____________ 。
(4)“转化”步骤中加入盐酸羟胺 的目的是
的目的是____________ 。“调 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为____________ 。
(5)“滤液2”中主要的金属阳离子有____________ (填离子符号);流程中生成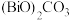 的化学方程式为
的化学方程式为____________ 。
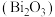 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有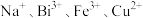 等。
等。②盐酸羟胺常用作还原剂。
③
 在
在 时开始水解,
时开始水解,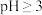 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。④常温下部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:| 金属离子 |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.7 |
| 完全沉淀 | 3.7 | 9.6 | 6.7 |
(1)
 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为(2)“滤渣1”的主要成分有
 、
、(3)写出“酸浸”步骤中
 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:(4)“转化”步骤中加入盐酸羟胺
 的目的是
的目的是 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为(5)“滤液2”中主要的金属阳离子有
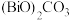 的化学方程式为
的化学方程式为
您最近一年使用:0次
【推荐2】某种废锂电池正极材料的主要成分是LiCoO2,含少量Al、Fe等,LiCoO2不溶于水。实验室回收废锂电池制备锂单质的流程如图所示:

(1)正极材料酸浸时发生主要反应的化学方程式为_______ 。某同学从环境保护的角度考虑上述做法不合理,理由是_______ ,于是提出可用酸化的双氧水代替盐酸,则反应的离子方程式为______ 。
(2)Li2CO3在高温焙烧时发生反应的化学方程式为______ 。
(3)固体C与焦炭的反应需在真空条件下进行的原因是_______ 。
(4)工业上采用熔融盐电解法制备金属锂,电解质为熔融的LiCl-KCl,采用石墨阳极和低碳钢阴极,则阴极的电极反应式为______ 。如果用LiCl的水溶液代替熔融的LiCl-KCl,则其后果是_____ 。

(1)正极材料酸浸时发生主要反应的化学方程式为
(2)Li2CO3在高温焙烧时发生反应的化学方程式为
(3)固体C与焦炭的反应需在真空条件下进行的原因是
(4)工业上采用熔融盐电解法制备金属锂,电解质为熔融的LiCl-KCl,采用石墨阳极和低碳钢阴极,则阴极的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】现有部分元素的性质与原子或分子结构的相关信息如表所示:
(1)T、X、Y、Z形成的简单离子半径由大到小的顺序是_______ 。(用离子符号表示)
(2)元素Y与元素Z相比,金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 填字母序号。
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应很剧烈,而Z单质与水很难反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式_______ 。请指出元素T在周期表中的位置_______ 。
(4)元素X与氢元素以原子个数比1∶2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32)。元素T和氢元素以原子个数比1:1化合形成化合物Q。Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式_______ 。
| 元素编号 | 元素性质与原子(或分子)结构的相关信息 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 其离子是第三周期金属元素的离子中半径最小的 |
(2)元素Y与元素Z相比,金属性较强的是
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应很剧烈,而Z单质与水很难反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式
(4)元素X与氢元素以原子个数比1∶2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32)。元素T和氢元素以原子个数比1:1化合形成化合物Q。Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】采用废铁屑还原软锰矿(软锰矿主要成分是 ,还含少量
,还含少量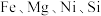 等元素的氧化物杂质)来制备
等元素的氧化物杂质)来制备 的工艺流程如图所示:
的工艺流程如图所示: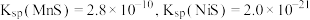 ;
;
②假设溶液中某离子浓度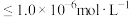 时,该离子沉淀完全;
时,该离子沉淀完全;
③室温时生成氢氧化物的 见下表。
见下表。
回答下列问题:
(1)“酸浸”时,为提高浸取效率,可采取的措施有_____ (任写一点)。
(2)在“浸出液”中加入 时发生反应的离子方程式为
时发生反应的离子方程式为_____ 。
(3)“除杂”过程中有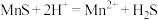 反应发生,其平衡常数
反应发生,其平衡常数 与
与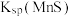 、
、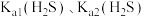 的代数关系式为
的代数关系式为
_____ 。加入 “除杂”后的滤渣为
“除杂”后的滤渣为_____ (填化学式),“除杂”后的滤液中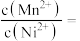
_____ 。
(4)“沉锰”过程中温度和 对
对 和
和 沉淀率的影响如图所示。则“沉锰”的合适条件是
沉淀率的影响如图所示。则“沉锰”的合适条件是_____ 。“沉锰”时发生反应的离子方程式为_____ 。
 ,还含少量
,还含少量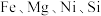 等元素的氧化物杂质)来制备
等元素的氧化物杂质)来制备 的工艺流程如图所示:
的工艺流程如图所示: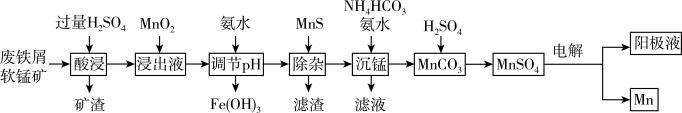
 ;
;②假设溶液中某离子浓度
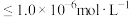 时,该离子沉淀完全;
时,该离子沉淀完全;③室温时生成氢氧化物的
 见下表。
见下表。| 离子 |  |  |  |  |  |
开始沉淀的 | 7.5 | 1.8 | 8.1 | 7.7 | 8.3 |
完全沉淀的 | 9.7 | 3 | 9.4 | 8.4 | 9.8 |
(1)“酸浸”时,为提高浸取效率,可采取的措施有
(2)在“浸出液”中加入
 时发生反应的离子方程式为
时发生反应的离子方程式为(3)“除杂”过程中有
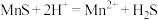 反应发生,其平衡常数
反应发生,其平衡常数 与
与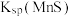 、
、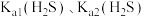 的代数关系式为
的代数关系式为
 “除杂”后的滤渣为
“除杂”后的滤渣为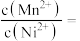
(4)“沉锰”过程中温度和
 对
对 和
和 沉淀率的影响如图所示。则“沉锰”的合适条件是
沉淀率的影响如图所示。则“沉锰”的合适条件是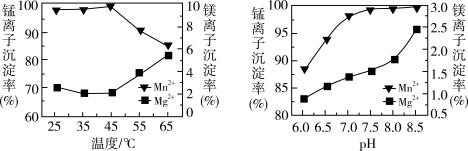
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】磷酸亚铁锂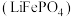 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
(1)操作1、操作2的实验名称为_______ 。
(2)加入 溶液的目的是
溶液的目的是_______ ,聚丙烯的作用是_______ 。
(3)向滤液2中加入 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为_______ ;反应生成 的离子方程式为
的离子方程式为_______ 。
(4)已知: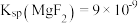 、
、 。若取
。若取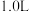 废液,测得
废液,测得 浓度为
浓度为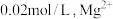 浓度为
浓度为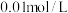 ,则至少需加入
,则至少需加入_______ 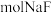 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
(5)锂离子电池充电时, 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成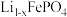 ,当
,当 时,则电极材料中
时,则电极材料中
_______ 。
(6)已知 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。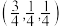 的
的 原子
原子_______ (在图中标出 ,可用头指明)。
,可用头指明)。
②距离 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为_______ 。
③该晶胞的密度为_______  (列出计算式即可)。
(列出计算式即可)。
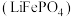 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
| 物质 |  |  |  |  |  |
 |  | 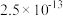 | 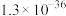 |  |  |
(1)操作1、操作2的实验名称为
(2)加入
 溶液的目的是
溶液的目的是(3)向滤液2中加入
 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为 的离子方程式为
的离子方程式为(4)已知:
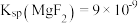 、
、 。若取
。若取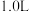 废液,测得
废液,测得 浓度为
浓度为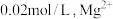 浓度为
浓度为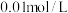 ,则至少需加入
,则至少需加入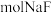 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。(5)锂离子电池充电时,
 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成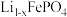 ,当
,当 时,则电极材料中
时,则电极材料中
(6)已知
 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
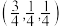 的
的 原子
原子 ,可用头指明)。
,可用头指明)。②距离
 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为③该晶胞的密度为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:

回答下列问题:
(1)“碱浸”的目的是___________ 。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________ 。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有___________ 。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择在___________ 。

(5)“沉锂”中Li2CO3溶解度随温度变化曲线如图所示:

①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因___________ 。
②若“沉锂”中c(Li+)=1.0 mol·L-1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为______ 。(已知Li2CO3的Ksp为9.0×10-4)

回答下列问题:
(1)“碱浸”的目的是
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:
(3)“萃取净化”除去的杂质离子有Ni2+外,还有
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择在

(5)“沉锂”中Li2CO3溶解度随温度变化曲线如图所示:

①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因
②若“沉锂”中c(Li+)=1.0 mol·L-1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】三氯化六氨合钴(III){[Co(NH3)6]Cl3}是合成其他含钴配合物的重要原料。工业上以水钴矿(主要成分为Co2O3,还含有少量的Fe2O3、Al2O3、MgO、CaO、SiO2)为原料制备三氯化六氨合钴晶体。

已知:①Co2O3具有很强的氧化性,其产物为Co(II);碱性条件下,Co(II)能被O2氧化;[Co(NH3)6]Cl3易溶于热水,难溶于冷水;
②25℃时相关物质的Ksp如表:
请回答下列问题:
(1)“浸取”时,能提高浸取速率的措施是____ (写出一条即可),Co2O3发生反应的离子方程式为____ 。
(2)滤渣II的成分是Al(OH)3和Fe(OH)3,“氧化”时,NaClO3溶液的作用是____ 。
(3)“除杂”时,CoF2可将Ca2+、Mg2+转化为沉淀过滤除去,若所得滤液中Mg2+刚好沉淀完全,则此时滤液中c(Ca2+)=____ mol·L-1(通常认为溶液中离子浓度≤10-5mol·L-1时沉淀完全)。
(4)“转化”时,Co2+转化为[Co(NH3)6]3+,需水浴控温在50~60℃,温度不能过高的原因是____ ,其反应的离子方程式为____ ,“系列操作”为____ 、洗涤、干燥。
(5)为测定产品中钴元素的含量,取ag样品于烧杯中,加水溶解,加入足量的NaOH溶液,加热至沸腾,将[Co(NH3)6]Cl3完全转化为Co(OH)3,冷却后加足量KI固体和HCl溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,定容。取25.00mL试样加入到锥形瓶中,加入淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,滴定至终点消耗Na2S2O3溶液的体积为VmL(已知:2Co3++2I-=2Co2++I2,I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
①滴定终点的现象是____ 。
②该产品中钴元素的质量分数为____ (用含a、V的式子表示)。

已知:①Co2O3具有很强的氧化性,其产物为Co(II);碱性条件下,Co(II)能被O2氧化;[Co(NH3)6]Cl3易溶于热水,难溶于冷水;
②25℃时相关物质的Ksp如表:
| 物质 | Co(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH) | Ca(OH)2 | MgF2 | CaF2 |
| Ksp | 1×10-13.8 | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-11.2 | 1×10-7.8 | 1×10-10 | 5×10-11 |
(1)“浸取”时,能提高浸取速率的措施是
(2)滤渣II的成分是Al(OH)3和Fe(OH)3,“氧化”时,NaClO3溶液的作用是
(3)“除杂”时,CoF2可将Ca2+、Mg2+转化为沉淀过滤除去,若所得滤液中Mg2+刚好沉淀完全,则此时滤液中c(Ca2+)=
(4)“转化”时,Co2+转化为[Co(NH3)6]3+,需水浴控温在50~60℃,温度不能过高的原因是
(5)为测定产品中钴元素的含量,取ag样品于烧杯中,加水溶解,加入足量的NaOH溶液,加热至沸腾,将[Co(NH3)6]Cl3完全转化为Co(OH)3,冷却后加足量KI固体和HCl溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,定容。取25.00mL试样加入到锥形瓶中,加入淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,滴定至终点消耗Na2S2O3溶液的体积为VmL(已知:2Co3++2I-=2Co2++I2,I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。①滴定终点的现象是
②该产品中钴元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氨基钠是制取靛青染料、肼和氰化钠等工业品的原料,能与空气中的水、氧气发生剧烈反应,实验室制备少量氨基钠的反应原理为: 。回答下列问题:
。回答下列问题:

(1)仪器B的名称为_______ ,物质A的名称为_______ 。
(2)欲制备氨基钠。从上图中选择装置(部分装置可重复使用),连接顺序为:a→_______,_______→b,c→_______,_______→_______,_______→h。__________
(3)实验时,应先打开分液漏斗的活塞,一段时间后再点燃酒精灯,目的是_______ 。
(4)如果没有装置3,装置2中可能发生的副反应是_______ 、_______ 。
(5)装置4中稀硫酸的作用是_______ ,f端导管口位于液面上方的目的是_______ 。
 。回答下列问题:
。回答下列问题:
(1)仪器B的名称为
(2)欲制备氨基钠。从上图中选择装置(部分装置可重复使用),连接顺序为:a→_______,_______→b,c→_______,_______→_______,_______→h。
(3)实验时,应先打开分液漏斗的活塞,一段时间后再点燃酒精灯,目的是
(4)如果没有装置3,装置2中可能发生的副反应是
(5)装置4中稀硫酸的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是_______ 。
A.②⑤④③① B.④⑤②①③
C.⑤②④①③ D.⑤④②①③
(2)步骤①中所用的玻璃仪器有烧杯、______________ 、_____________ 。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是__________
Ⅱ.碘是人体所需的必需元素,海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海洋植物中提取碘的流程如下:











 ―→
―→
(1)上述过程灼烧海藻是在____________ (填仪器名称)中进行。
(2)上述步骤②中是加入了氯水,利用氯水中的Cl2把I-氧化为I2,请写出该反应的离子方程式_____________ 。
(3)上述步骤③中加入了CCl4后进行振荡,振荡后静置分层,上层______ 色,下层_______ 色。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是
A.②⑤④③① B.④⑤②①③
C.⑤②④①③ D.⑤④②①③
(2)步骤①中所用的玻璃仪器有烧杯、
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是
Ⅱ.碘是人体所需的必需元素,海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海洋植物中提取碘的流程如下:











 ―→
―→
(1)上述过程灼烧海藻是在
(2)上述步骤②中是加入了氯水,利用氯水中的Cl2把I-氧化为I2,请写出该反应的离子方程式
(3)上述步骤③中加入了CCl4后进行振荡,振荡后静置分层,上层
您最近一年使用:0次



