由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素同时生成液态水的热化学反应方程式:___________ 。
(2)某密闭容器中存在反应:CO(g)+2H2(g) CH3OH(g),起始时容器中只有a mol/LCO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有a mol/LCO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
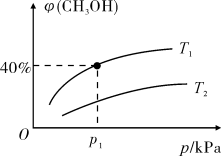
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1___________ K2(填“>”“<”或“=”);
②若恒温恒容条件下,起始时充入1 mol CO和2 mol H2,达平衡后,CO的转化率为α1,此时,若再充入1 mol CO和2 mol H2,再次达平衡后,CO的转化率为α2,则α1___________ α2(填“>”“<”“=”或“无法确定”)。
(3)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
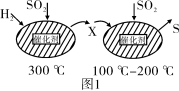
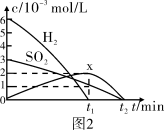
①分析可知X为___________ (写化学式),0~t1时间段的温度为___________ ,0~t1时间段用SO2表示的化学反应速率为___________ 。
②总反应的化学方程式为___________ 。
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素同时生成液态水的热化学反应方程式:
(2)某密闭容器中存在反应:CO(g)+2H2(g)
 CH3OH(g),起始时容器中只有a mol/LCO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有a mol/LCO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1
②若恒温恒容条件下,起始时充入1 mol CO和2 mol H2,达平衡后,CO的转化率为α1,此时,若再充入1 mol CO和2 mol H2,再次达平衡后,CO的转化率为α2,则α1
(3)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:


①分析可知X为
②总反应的化学方程式为
更新时间:2021-10-18 20:46:04
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】反应① Fe(s)+CO2(g) FeO(s)+CO(g) +akJ;反应② CO(g)+1/2O2(g)
FeO(s)+CO(g) +akJ;反应② CO(g)+1/2O2(g) CO2(g) +bkJ
CO2(g) +bkJ
测得在不同温度下,反应①的平衡常数K值随温度的变化如下:
(1)反应①的化学平衡常数表达式为________ ,a________ 0(填“大于”、“小于”或“等于”)。 在500℃2L密闭容器中进行反应①,CO2起始量为4mol,其转化率为50%,则CO的平衡浓度为________ 。
(2)700℃反应①达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有______ (填序号)。
A 缩小反应器体积 B 通入CO2 C 升高温度到900℃ D 使用合适的催化剂
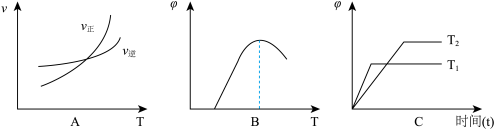
(3)下列图象符合反应①的是________ (填序号)(图中v是速率、 为混合物中CO含量,T为温度且T1>T2)。
为混合物中CO含量,T为温度且T1>T2)。
(4)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)+Q 的Q=
2FeO(s)+Q 的Q=__________ 。
 FeO(s)+CO(g) +akJ;反应② CO(g)+1/2O2(g)
FeO(s)+CO(g) +akJ;反应② CO(g)+1/2O2(g) CO2(g) +bkJ
CO2(g) +bkJ测得在不同温度下,反应①的平衡常数K值随温度的变化如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)反应①的化学平衡常数表达式为
(2)700℃反应①达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
A 缩小反应器体积 B 通入CO2 C 升高温度到900℃ D 使用合适的催化剂
(3)下列图象符合反应①的是
 为混合物中CO含量,T为温度且T1>T2)。
为混合物中CO含量,T为温度且T1>T2)。
(4)由反应①和②可求得,反应2Fe(s)+O2(g)
 2FeO(s)+Q 的Q=
2FeO(s)+Q 的Q=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢气的热化学方程式分别为______________________________ 、__________________________________ ,制得等量H2所需能量较少的是系统______ 。(填Ⅰ或Ⅱ)
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ⇌COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
①H2S的平衡转化率α=_______ %,反应平衡常数K=________ 。(用分数表示)
②在620 K重复上述试验,平衡后水的物质的量分数为0.05,H2S的转化率α2______ α1,该反应的△H_____ 0。(填“>”“<”或“=”)
③向上述反应器中再分别充入下列气体,能使H2S转化率增大的是________ 。(填标号)
A. H2S B. CO2 C.COS D.N2

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢气的热化学方程式分别为
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ⇌COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
①H2S的平衡转化率α=
②在620 K重复上述试验,平衡后水的物质的量分数为0.05,H2S的转化率α2
③向上述反应器中再分别充入下列气体,能使H2S转化率增大的是
A. H2S B. CO2 C.COS D.N2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
(1) 的VSEPR模型是
的VSEPR模型是______ 。已知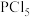 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为______ (填标号)。 B.
B. C.
C. D.
D.
(2)已知,①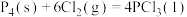
 kJ⋅mol
kJ⋅mol ,
,
②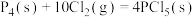
 kJ⋅mol
kJ⋅mol (
(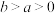 )。
)。
则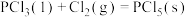

______ (用含a、b、c的式子表示)kJ⋅mol 。
。
(3)实验测得 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为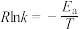 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下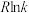 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是______ (填“Cat1”或“Cat2”),判断依据是____________ 。
②将2n mol 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为______ (填标号)。
A. mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol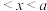 mol
mol
(4)向恒容密闭容器中投入0.2 mol 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。____________ ;曲线c改变的条件可能是____________ 。
②曲线b条件下,该反应平衡常数( )为
)为______ 。[提示:用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:(1)
 的VSEPR模型是
的VSEPR模型是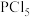 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为
 B.
B. C.
C. D.
D.
(2)已知,①
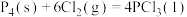
 kJ⋅mol
kJ⋅mol ,
,②
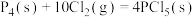
 kJ⋅mol
kJ⋅mol (
(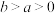 )。
)。则
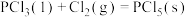

 。
。(3)实验测得
 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。
 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下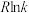 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是②将2n mol
 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为A.
 mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol mol
mol(4)向恒容密闭容器中投入0.2 mol
 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
②曲线b条件下,该反应平衡常数(
 )为
)为 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)已知:
①N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ•mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H2=-905 kJ•mol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJ•mol-1
请写出N2和H2在高温、高压、催化剂条件下生成NH3的热化学方程式________________ 。
(2)在一定温度下,某恒容密闭容器中,发生反应:2X(g)+Y(g) 2Z(g) △H<0,各物质的浓度随时间变化如图所示。
2Z(g) △H<0,各物质的浓度随时间变化如图所示。

①从反应开始到4min时平衡,Y的平均反应速率为____________________ ;
②根据图中数据,4min时的平衡常数K=______________________ ;
③若使重新平衡时体系中c(X)=c(Z),则改变的条件为_____________________ (只写一项)。
④若某时刻,V正(Y)=2V逆(Z),则反应_____ 达到平衡(填“已”或“未”)。
⑤图中a、b点对应的正反应速率大小关系为Va________ Vb(填“大于”、“小于”或“等于”)。
①N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ•mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H2=-905 kJ•mol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJ•mol-1
请写出N2和H2在高温、高压、催化剂条件下生成NH3的热化学方程式
(2)在一定温度下,某恒容密闭容器中,发生反应:2X(g)+Y(g)
 2Z(g) △H<0,各物质的浓度随时间变化如图所示。
2Z(g) △H<0,各物质的浓度随时间变化如图所示。
①从反应开始到4min时平衡,Y的平均反应速率为
②根据图中数据,4min时的平衡常数K=
③若使重新平衡时体系中c(X)=c(Z),则改变的条件为
④若某时刻,V正(Y)=2V逆(Z),则反应
⑤图中a、b点对应的正反应速率大小关系为Va
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】科研、生产中常涉及碳的化合物。回答下列问题:
(1) 时,向容积为
时,向容积为 的恒容密闭容器中充入一定量的
的恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: ,反应过程中测定的部分数据见下表:
,反应过程中测定的部分数据见下表:
①反应前 内的平均反应速率
内的平均反应速率
_________ ;表中 的值为
的值为___________ 。
②判定 时达到平衡状态的理由是
时达到平衡状态的理由是___________ 。
(2)工业上可利用煤的气化产物(水煤气)合成二甲醚: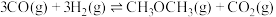
 。一定条件下的密闭容器中,该反应达到平衡,要提高
。一定条件下的密闭容器中,该反应达到平衡,要提高 的转化率,可以采取的措施是___________(填字母)。
的转化率,可以采取的措施是___________(填字母)。
(3)高炉炼铁中发生的主要反应为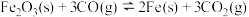 。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式
。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式
___________ ,
___________ 0(填“>”“<”或“=”)。

(4) 和
和 通入聚焦太阳能反应器中,发生反应:
通入聚焦太阳能反应器中,发生反应:
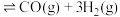 ,将等物质的量的
,将等物质的量的 和
和 充入
充入 恒容密闭反应器中,某温度下反应达到平衡,平衡常数
恒容密闭反应器中,某温度下反应达到平衡,平衡常数 ,此时测得
,此时测得 ,则
,则 的平衡转化率为
的平衡转化率为___________ (保留两位有效数字)。
(1)
 时,向容积为
时,向容积为 的恒容密闭容器中充入一定量的
的恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: ,反应过程中测定的部分数据见下表:
,反应过程中测定的部分数据见下表:反应时间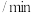 | 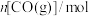 |  |
| 0 | 1.8 | 0.9 |
| 2 | 1.2 |  |
| 4 |  | 0.3 |
 内的平均反应速率
内的平均反应速率
 的值为
的值为②判定
 时达到平衡状态的理由是
时达到平衡状态的理由是(2)工业上可利用煤的气化产物(水煤气)合成二甲醚:
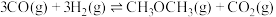
 。一定条件下的密闭容器中,该反应达到平衡,要提高
。一定条件下的密闭容器中,该反应达到平衡,要提高 的转化率,可以采取的措施是___________(填字母)。
的转化率,可以采取的措施是___________(填字母)。| A.升高温度 | B.加入催化剂 |
C.减小 的浓度 的浓度 | D.增大压强(缩小容器体积) |
(3)高炉炼铁中发生的主要反应为
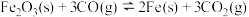 。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式
。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式


(4)
 和
和 通入聚焦太阳能反应器中,发生反应:
通入聚焦太阳能反应器中,发生反应:
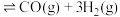 ,将等物质的量的
,将等物质的量的 和
和 充入
充入 恒容密闭反应器中,某温度下反应达到平衡,平衡常数
恒容密闭反应器中,某温度下反应达到平衡,平衡常数 ,此时测得
,此时测得 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氮气分子在催化剂作用下发生的一系列转化如下:

反应①属于工业固氮,为可逆反应。反应②可用于工业制硝酸。完成下列填空:
(1)氮原子的核外电子排布式是___________ ,氧原子最外层有_____ 种运动状态不同的电子。反应②的化学反应方程式是_____ 。
(2)为模拟反应①,T℃时,在2L恒容密闭容器中加入2molN2和2molH2,其中n(NH3)随时间的变化见图。

氮气在前2分钟内的平均反应速率v(N2)=______ mol/(L·min),达平衡时N2和H2的浓度之比为____ 。
(3)能说明上题所述反应在T℃下已达平衡状态的是_________ (选填序号)。
A.混合气体的密度不再变化
B.3v正(H2)=2v逆(NH3)
C.容器内的总压强不再变化
D.各物质的浓度相等
E.氮气物质的量不再变化
请提出一条既能提高氢气的转化率,又能加快反应速率的措施______________ 。
(4)一氧化二氮俗名笑气,250℃时硝酸铵固体在密闭容器中加热分解可得N2O和H2O,该可逆反应的平衡常数表达式为________ 。

反应①属于工业固氮,为可逆反应。反应②可用于工业制硝酸。完成下列填空:
(1)氮原子的核外电子排布式是
(2)为模拟反应①,T℃时,在2L恒容密闭容器中加入2molN2和2molH2,其中n(NH3)随时间的变化见图。

氮气在前2分钟内的平均反应速率v(N2)=
(3)能说明上题所述反应在T℃下已达平衡状态的是
A.混合气体的密度不再变化
B.3v正(H2)=2v逆(NH3)
C.容器内的总压强不再变化
D.各物质的浓度相等
E.氮气物质的量不再变化
请提出一条既能提高氢气的转化率,又能加快反应速率的措施
(4)一氧化二氮俗名笑气,250℃时硝酸铵固体在密闭容器中加热分解可得N2O和H2O,该可逆反应的平衡常数表达式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】酿酒和造醋是古代劳动人民的智慧结晶,白酒和醋也是日常生活中常见的有机物。
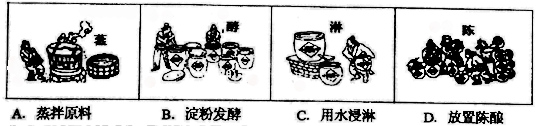
(1)上述以高粱为主要原料的酿醋工艺中,利用醋酸溶解性的是_________ (填选项)。
(2)写出乙酸在水溶液中的电离平衡常数的表达式________ 。
(3)已知25℃下,CH3COOH在水中电离的电离常数Ka=2×10-5,则25℃时CH5COONa水解平衡常数Kh=_________ (填数值)。
(4)近年来,研究者利用乙酸开发出新工艺合成乙酸乙酯,使产品成本明显降低,其主要反应为: CH2=CH2 (g)+CH3COOH(l) CH3COOC2H5(l)。
CH3COOC2H5(l)。
①该反应属于有机反应类型中的___________ 。
②下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是_________ (填选项)。
A 乙烯、乙酸、乙酸乙酯的浓度相同
B 酯化合成反应的速率与酯分解反应的速率相等
C 乙烯断开l mol碳碳双键的同时乙酸恰好消耗l mol
D 体系中乙酸的百分含量一定
(5)下图为n(乙烯)与n(乙酸)物料比为1时,在不同压强下进行了乙酸乙酯的产率随温度变化的测定实验,在相同时间点的实验结果如图所示。回答下列问题:
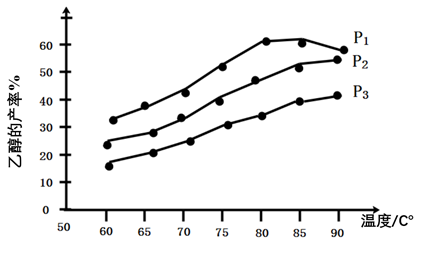
①温度在60-80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是_______ [用v(P1)、v(P2)、v(P3)分别表示不同压强下的反应速率]。
②压强为P1 MPa、温度60℃时,若乙酸乙酯的产率为30%,则此时乙烯的转化率为_______ 。
③压强为P1 MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________ 。

(1)上述以高粱为主要原料的酿醋工艺中,利用醋酸溶解性的是
(2)写出乙酸在水溶液中的电离平衡常数的表达式
(3)已知25℃下,CH3COOH在水中电离的电离常数Ka=2×10-5,则25℃时CH5COONa水解平衡常数Kh=
(4)近年来,研究者利用乙酸开发出新工艺合成乙酸乙酯,使产品成本明显降低,其主要反应为: CH2=CH2 (g)+CH3COOH(l)
 CH3COOC2H5(l)。
CH3COOC2H5(l)。①该反应属于有机反应类型中的
②下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是
A 乙烯、乙酸、乙酸乙酯的浓度相同
B 酯化合成反应的速率与酯分解反应的速率相等
C 乙烯断开l mol碳碳双键的同时乙酸恰好消耗l mol
D 体系中乙酸的百分含量一定
(5)下图为n(乙烯)与n(乙酸)物料比为1时,在不同压强下进行了乙酸乙酯的产率随温度变化的测定实验,在相同时间点的实验结果如图所示。回答下列问题:

①温度在60-80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是
②压强为P1 MPa、温度60℃时,若乙酸乙酯的产率为30%,则此时乙烯的转化率为
③压强为P1 MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①

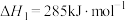
②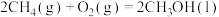

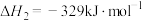
反应③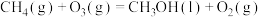 的
的
______  ,平衡常数
,平衡常数
______ (用 、
、 表示)。
表示)。
(2)电喷雾电离等方法得到的 (
( 、
、 、
、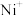 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应
反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应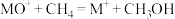 ,结果如下图所示。图中300K的曲线是
,结果如下图所示。图中300K的曲线是______ (填“a”或“b”)。300K、60s时 的转化率为
的转化率为______ (列出算式)。 分别与
分别与 、
、 反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以
反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 示例)。
示例)。______ (填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线______ (填“c”或“d”)。
(ⅲ) 与
与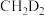 反应,氘代甲醇的产量
反应,氘代甲醇的产量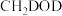
______ 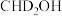 (填“>”“<”或“=”)。若
(填“>”“<”或“=”)。若 与
与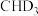 反应,生成的氘代甲醇可能为
反应,生成的氘代甲醇可能为______ 或______ (写结构简式)。
(1)已知下列反应的热化学方程式:
①


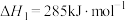
②
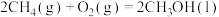

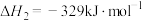
反应③
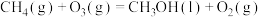 的
的
 ,平衡常数
,平衡常数
 、
、 表示)。
表示)。(2)电喷雾电离等方法得到的
 (
( 、
、 、
、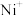 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应
反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应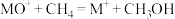 ,结果如下图所示。图中300K的曲线是
,结果如下图所示。图中300K的曲线是 的转化率为
的转化率为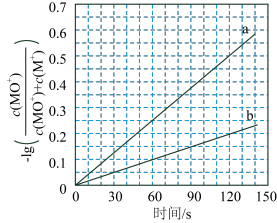
 分别与
分别与 、
、 反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以
反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 示例)。
示例)。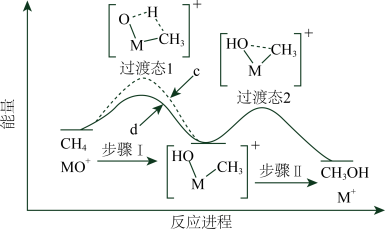
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则
 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线(ⅲ)
 与
与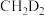 反应,氘代甲醇的产量
反应,氘代甲醇的产量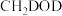
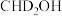 (填“>”“<”或“=”)。若
(填“>”“<”或“=”)。若 与
与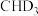 反应,生成的氘代甲醇可能为
反应,生成的氘代甲醇可能为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】高纯硅用途广泛,SiHCl3是制备高纯硅的主要原料,制备SiHCl3主要有以下工艺。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是___________ (填“a”或“b”)。 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。
(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是___________ (填字母)。
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g) 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1
ⅱ.2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2
ⅲ.SiHCl3(g)+H2(g) Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3
ⅳ.SiCl4(g)+Si(s)+2H2(g) 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4
(3)ΔH4=___________ (写出代数式)。
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。___________ (填序号)。
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=___________ MPa-1(已知压强平衡常数的表达式为各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是
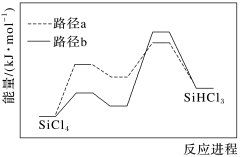
 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g)
 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1ⅱ.2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2ⅲ.SiHCl3(g)+H2(g)
 Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3ⅳ.SiCl4(g)+Si(s)+2H2(g)
 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4(3)ΔH4=
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。
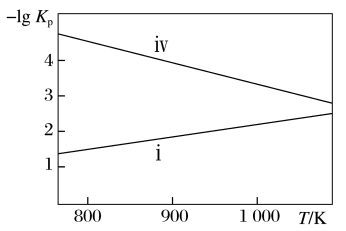
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】2021年3月全国两会期间,政府工作报告中提到的“碳达峰”“碳中和”成为热词。“碳中和”指的是测算在一定时间内直接或间接产生的二氧化碳或温室气体排放总量,通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放,实现二氧化碳的“零排放”。温室气体二氧化碳与氢气反应制备燃料甲醇的技术,能促进“碳中和”。请完成下列问题:
 加氢制甲醇的总反应可表示为:
加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①
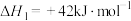
②
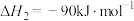
(1)若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)合成总反应在起始物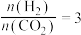 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为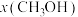 ,在
,在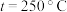 下的
下的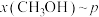 、在
、在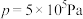 下的
下的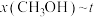 如图所示。
如图所示。
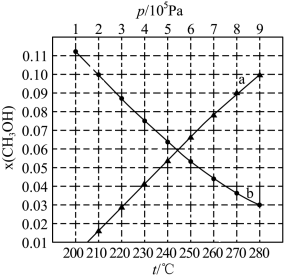
①图中对应等温过程的曲线是___________ ,判断的理由是___________ 。
②当 时,
时, 的平衡转化率
的平衡转化率
___________ (保留三位有效数字),反应条件可能为___________ 或___________ 。
 加氢制甲醇的总反应可表示为:
加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

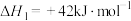
②

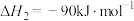
(1)若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A. | B.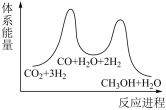 |
C.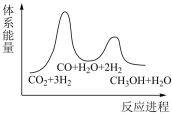 | D.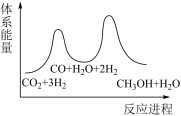 |
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为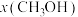 ,在
,在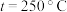 下的
下的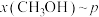 、在
、在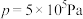 下的
下的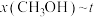 如图所示。
如图所示。
①图中对应等温过程的曲线是
②当
 时,
时, 的平衡转化率
的平衡转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇是一种重要的可再生能源。已知:①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=akJ/mol,②CO(g)+2H2(g)=CH3OH(g)△H=bkJ/mol。
(1)写出由CH4和O2制取CH3OH(g)的热化学方程式:__ 。
(2)在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。该反应的化学方程式为N2O4 2NO2。
2NO2。
①0→20s内N2O4的平均反应速率为___ 。
②该反应的平衡时的N2O4转化率为___ ,在80℃时该反应的平衡常数K值为___ (保留2位小数)。
③下列说法正确的是___ 。
A.温度越高,K值越大,N2O4的转化率越高
B.加压,平衡逆向移动,气体颜色变浅
C.增大N2O4的浓度,新平衡建立过程中正反应速率不断加快
D.起始条件相同,将等物质的量的N2O4分别在A、B两个相同的容器中反应建立平衡,A保持恒温、恒容;B保持恒温、恒压,达到平衡后,A中的N2O4平衡转化率小于B
④反应平衡后压强是反应开始压强的__ 倍、与反应开始相比,到平衡时容器中平均相对分子质量___ 。(填增大或减小或不变)
(1)写出由CH4和O2制取CH3OH(g)的热化学方程式:
(2)在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.10 | c | d | e |
| c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
 2NO2。
2NO2。①0→20s内N2O4的平均反应速率为
②该反应的平衡时的N2O4转化率为
③下列说法正确的是
A.温度越高,K值越大,N2O4的转化率越高
B.加压,平衡逆向移动,气体颜色变浅
C.增大N2O4的浓度,新平衡建立过程中正反应速率不断加快
D.起始条件相同,将等物质的量的N2O4分别在A、B两个相同的容器中反应建立平衡,A保持恒温、恒容;B保持恒温、恒压,达到平衡后,A中的N2O4平衡转化率小于B
④反应平衡后压强是反应开始压强的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________ 。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________ 。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________ 。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________ (填正向,逆向,不)移动,正反应速率将________ (增大,减小,不变)。
 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:(1)若1 mol氮气完全反应生成氨气可放出的能量为
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡
您最近一年使用:0次



