稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
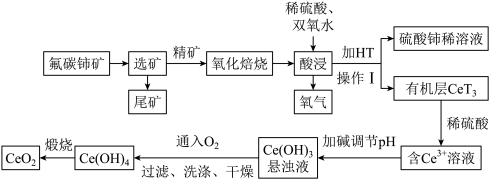
(1)选矿是整个矿产品生产过程中的重要环节。一般可采用重选法、浮选法、磁选法、电选法等方法,将有用矿物与脉石矿物(无用矿物)分离。氟碳铈矿浮选过程中采用不同捕收剂BHA和SHA(浓度均为2×10-4mol/L)时,pH值对氟碳铈矿浮选回收率的影响如图所示。浮选时应选择的最佳捕收剂是___________ (填“BHA”或“SHA”),其对应的最佳pH值为___________ 。
(2)CeFCO3中Ce的化合价为___________ 。
(3)在空气中进行氧化焙烧时由于水蒸气的参与,可产生一种有毒并对陶瓷设备有腐蚀作用的气体,其化学式为____ 。
(4)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为___________ 。
(5)为了提高酸浸率,可以适当提高反应温度,但若温度偏高浸出率反而会减小,其原因是___________ 。
(6)HT是一种有机萃取剂,则操作I的名称为___________ 。
(7)写出向Ce(OH)3悬浊液中通入氧气得到Ce(OH)4的化学方程式:___________ 。
(8)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2⇌CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。利用CeO2消除CO尾气后,CeO2(1-x)中Ce的化合价为+3价、+4价。若x=0.2,则Ce(III)与Ce(IV)的原子个数比为___________ 。

(1)选矿是整个矿产品生产过程中的重要环节。一般可采用重选法、浮选法、磁选法、电选法等方法,将有用矿物与脉石矿物(无用矿物)分离。氟碳铈矿浮选过程中采用不同捕收剂BHA和SHA(浓度均为2×10-4mol/L)时,pH值对氟碳铈矿浮选回收率的影响如图所示。浮选时应选择的最佳捕收剂是

(2)CeFCO3中Ce的化合价为
(3)在空气中进行氧化焙烧时由于水蒸气的参与,可产生一种有毒并对陶瓷设备有腐蚀作用的气体,其化学式为
(4)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为
(5)为了提高酸浸率,可以适当提高反应温度,但若温度偏高浸出率反而会减小,其原因是
(6)HT是一种有机萃取剂,则操作I的名称为
(7)写出向Ce(OH)3悬浊液中通入氧气得到Ce(OH)4的化学方程式:
(8)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2⇌CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。利用CeO2消除CO尾气后,CeO2(1-x)中Ce的化合价为+3价、+4价。若x=0.2,则Ce(III)与Ce(IV)的原子个数比为
更新时间:2021-12-30 20:04:31
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上有多种脱硫、脱硝的方法,具体如下:
Ⅰ、二氧化氯(ClO2)是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中SO2和NO的脱除。研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
已知基元反应:aA(g)+bB(g)=cC(g)+dD(g),其速率方程表达式为v=k·ca(A)·cb(B)
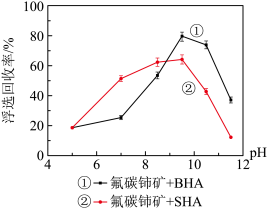
实验测得:ClO2分别对纯SO2、纯NO以及同时氧化的氧化率随时间(t)的变化情况如图所示。据此分析:
(1)其它因素都相同,判断ClO2氧化SO2的活化能___________ (填“>”或“<”)ClO2氧化NO的活化能;
(2)NO的存在___________ (填“会”或“不会”)影响ClO2氧化SO2的速率。请结合①、③、④的速率常数分析原因___________ 。
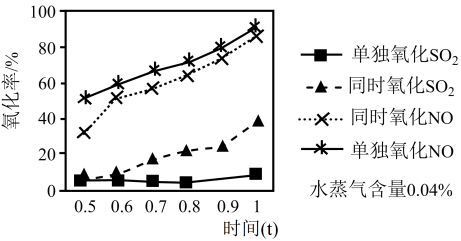
Ⅱ、NaClO溶液在不同温度下也可对硫、硝脱除,一定时间内,其脱除率如图所示。
(3)SO2脱除率高于NO,可能的原因是___________ (写两点)。
(4)烟气中SO2和NO体积比为4:1,烟气与50℃时的吸收液转化生成的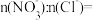
___________ 。
Ⅲ、CO也可以与NO反应生成无污染物:2CO(g)+2NO(g) N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。
N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。
(5)以下物理量不再发生变化时,能说明反应达平衡的是___________ 。
a.CO与NO转化率之比 b.混合气体的密度
c.混合气体的平均相对分子质量 d.v(CO):v(N2)=2:1
(6)体系达到平衡时N2的分压为20KPa,则该反应的相对压力平衡常数
___________ 。
Ⅰ、二氧化氯(ClO2)是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中SO2和NO的脱除。研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
| 序号 | 反应机理(基元反应) | 反应热 | 速率常数 | |
| 脱硝 | ① | NO(g)+ClO2(g)=NO2(g)+ClO(g) | ΔH1 | k1=1.7×1011mL·mol-1·s-1 |
| ② | NO(g)+ClO(g)=NO2(g)+Cl(g) | ΔH2 | k2=8.8×1012mL·mol-1·s-1 | |
| 脱硫 | ③ | SO2(g)+ClO2(g)=SO3(g)+ClO(g) | ΔH3 | k3=2.1×10-4mL·mol-1·s-1 |
| ④ | SO2(g)+ClO(g)=SO3(g)+Cl(g) | ΔH4 | k4=6.9×1011mL·mol-1·s-1 |
已知基元反应:aA(g)+bB(g)=cC(g)+dD(g),其速率方程表达式为v=k·ca(A)·cb(B)
实验测得:ClO2分别对纯SO2、纯NO以及同时氧化的氧化率随时间(t)的变化情况如图所示。据此分析:

(1)其它因素都相同,判断ClO2氧化SO2的活化能
(2)NO的存在
Ⅱ、NaClO溶液在不同温度下也可对硫、硝脱除,一定时间内,其脱除率如图所示。

(3)SO2脱除率高于NO,可能的原因是
(4)烟气中SO2和NO体积比为4:1,烟气与50℃时的吸收液转化生成的
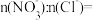
Ⅲ、CO也可以与NO反应生成无污染物:2CO(g)+2NO(g)
 N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。
N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。(5)以下物理量不再发生变化时,能说明反应达平衡的是
a.CO与NO转化率之比 b.混合气体的密度
c.混合气体的平均相对分子质量 d.v(CO):v(N2)=2:1
(6)体系达到平衡时N2的分压为20KPa,则该反应的相对压力平衡常数

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】研究硝酸工业尾气的处理对环境保护和资源的开发利用有重要意义。一种利用硝酸尾气初步处理后获得的高浓度NOx(NO、NO2)烟气制备NaNO2、NaNO3的工艺流程如下:
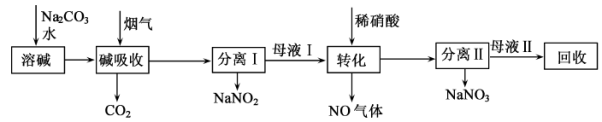
回答下列问题:
(1)NH3是工业上制备硝酸的原料,工业上NH3的催化氧化反应的化学方程式为_______ 。
(2)NaNO2中N元素的化合价为____ ,“碱吸收”过程中发生反应的离子方程式为______ 。
(3)母液I“转化”时生成NO的化学方程式为_______ ,“转化”时产生的气体应导入_______ (填操作单元的名称)循环利用。
(4)工业制硝酸尾气中的NOx(NO、NO2)常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O。硝酸尾气中的NOx,通入足量NaOH溶液中充分反应后气体没有剩余,则:
①NOx中x的取值范围为_______ ;
②反应后溶液中n( ):n(
):n( )=
)=_______ (用含x的代数式表示)。

回答下列问题:
(1)NH3是工业上制备硝酸的原料,工业上NH3的催化氧化反应的化学方程式为
(2)NaNO2中N元素的化合价为
(3)母液I“转化”时生成NO的化学方程式为
(4)工业制硝酸尾气中的NOx(NO、NO2)常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O。硝酸尾气中的NOx,通入足量NaOH溶液中充分反应后气体没有剩余,则:
①NOx中x的取值范围为
②反应后溶液中n(
 ):n(
):n( )=
)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
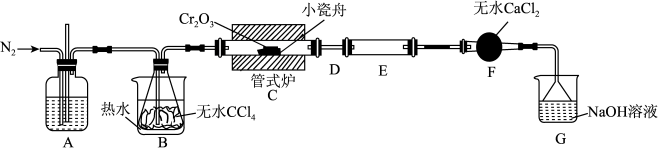
已知:① (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: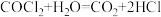 ;
;
②碱性条件下, 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
(1)A装置用于干燥 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是_______ ;无水 的作用是
的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)尾气与装置G中过量的 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是_______ 。
(4)测定产品中 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:
Ⅰ.取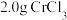 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量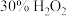 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使 转化为
转化为 。
。
Ⅲ.在溶液中加入适量浓 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗 标准溶液
标准溶液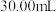 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。
①计算产品中 质量分数为
质量分数为_______ 。
②下列操作将导致产品中 质量分数测定值偏低的是
质量分数测定值偏低的是_______ (填字母标号)。
A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中 溶液部分变质
溶液部分变质
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:①
 (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: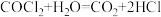 ;
;②碱性条件下,
 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。(1)A装置用于干燥
 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是 的作用是
的作用是(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是
(3)尾气与装置G中过量的
 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是(4)测定产品中
 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:Ⅰ.取
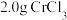 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量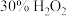 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使
 转化为
转化为 。
。Ⅲ.在溶液中加入适量浓
 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗 标准溶液
标准溶液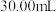 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。①计算产品中
 质量分数为
质量分数为②下列操作将导致产品中
 质量分数测定值偏低的是
质量分数测定值偏低的是A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中
 溶液部分变质
溶液部分变质D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】 超干重整CO2技术
超干重整CO2技术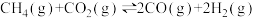 可得到富含CO的气体,用于生产多种化工产品。
可得到富含CO的气体,用于生产多种化工产品。
(1) 超干重整CO2的催化转化原理示意图如下:
超干重整CO2的催化转化原理示意图如下:
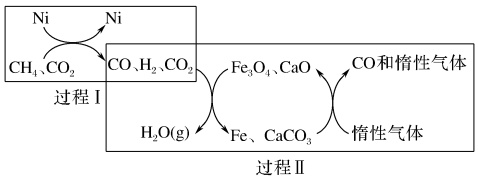
关于上述过程Ⅱ的说法正确的是___________(填序号)。
(2)已知:①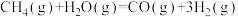

②
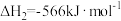
③
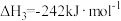
相关化学键的键能数据如下:
由此计算 =
=___________ kJ/mol,CH4超干重整CO2技术得到CO和H2的反应的热化学方程式为___________ 。
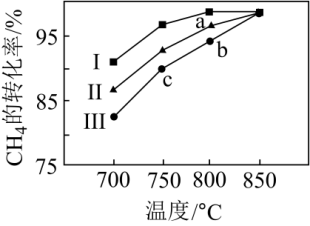
(3)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应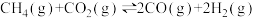 进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态
进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态___________ (填“是”、“不是”或“不确定是”)平衡状态;b点CH4的转化率高于c点,原因是___________ 。
(4)下图表示初始投料比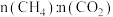 为1:3或1:4,CH4的平衡转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用α1、α2表示]
为1:3或1:4,CH4的平衡转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用α1、α2表示]

①α2=___________ 。
②判断T1与T2的大小关系,并说明理由:___________ 。
(5)工业上将CO2转化为燃料CH4,可发生反应有:
反应Ⅰ: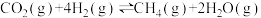

反应Ⅱ: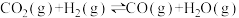
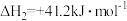
 和
和 充入3L刚性密闭容器中,反应相同时间,温度对CO2转化率和催化剂选择性的影响如图所示。(注:催化剂的选择性是指发生反应的CO2转化为CH4或CO的百分比)
充入3L刚性密闭容器中,反应相同时间,温度对CO2转化率和催化剂选择性的影响如图所示。(注:催化剂的选择性是指发生反应的CO2转化为CH4或CO的百分比)


___________ 0(填“>”、“<”或“=”)。不改变投料,若容器体积可变化,为同时提高CO2的平衡转化率和CH4的平衡产率,选择最佳反应条件为___________ (填标号)。
A.350℃、高压 B.350℃、低压
C.500℃、低压 D.500℃、高压
 超干重整CO2技术
超干重整CO2技术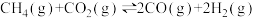 可得到富含CO的气体,用于生产多种化工产品。
可得到富含CO的气体,用于生产多种化工产品。(1)
 超干重整CO2的催化转化原理示意图如下:
超干重整CO2的催化转化原理示意图如下:
关于上述过程Ⅱ的说法正确的是___________(填序号)。
| A.CO未参与反应 |
B.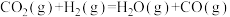 |
| C.实现了含碳物质与含氢物质的分离 |
D. 、CaO为催化剂,降低了反应的 、CaO为催化剂,降低了反应的 |
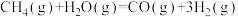

②

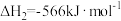
③

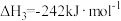
相关化学键的键能数据如下:
| 共价键 | H-O | C O O | H-H | C-H |
| 键能/(kJ/mol) | 463 | 1076 | 436 | 413 |
 =
=(3)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应
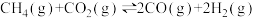 进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态
进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态
(4)下图表示初始投料比
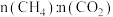 为1:3或1:4,CH4的平衡转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用α1、α2表示]
为1:3或1:4,CH4的平衡转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用α1、α2表示]
①α2=
②判断T1与T2的大小关系,并说明理由:
(5)工业上将CO2转化为燃料CH4,可发生反应有:
反应Ⅰ:
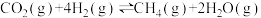

反应Ⅱ:
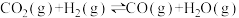
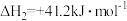
 和
和 充入3L刚性密闭容器中,反应相同时间,温度对CO2转化率和催化剂选择性的影响如图所示。(注:催化剂的选择性是指发生反应的CO2转化为CH4或CO的百分比)
充入3L刚性密闭容器中,反应相同时间,温度对CO2转化率和催化剂选择性的影响如图所示。(注:催化剂的选择性是指发生反应的CO2转化为CH4或CO的百分比)

A.350℃、高压 B.350℃、低压
C.500℃、低压 D.500℃、高压
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟 氧化结合
氧化结合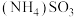 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。
①已知: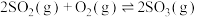
 ,则
,则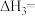
_______ 。
②其他条件不变时,高于150℃,在相同时间内 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是_______ 。
③其他条件不变, 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因_______ 。 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:_______ 。
② 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是_______ 。
③在吸收器中, 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是_______ 。
④在吸收器中,随着吸收过程的进行,部分 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是_______ 。
 氧化结合
氧化结合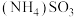 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。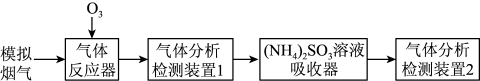
| 反应 | 平衡常数(25℃) | 活化能/(kJ/mol) |
反应a: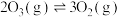 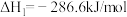 |  | 24.6 |
反应b: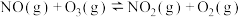 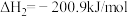 | 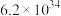 | 3.17 |
反应c:  | 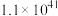 | 58.17 |
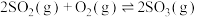
 ,则
,则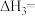
②其他条件不变时,高于150℃,在相同时间内
 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是③其他条件不变,
 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因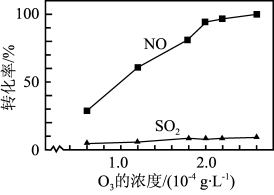
 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。
 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:②
 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是③在吸收器中,
 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是④在吸收器中,随着吸收过程的进行,部分
 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g) H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1
H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1
CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0kJ/mol-1
CH3OH(g) ΔH2=-90.0kJ/mol-1
写出CO2催化氢化合成甲醇的热化学方程式:__ 。
(2)为提高CH3OH转化率,理论上应采用的条件是__ (填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[ ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
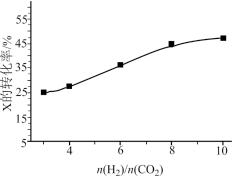
反应物X是__ (填“CO2”或“H2”),理由是___ 。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol。
①前10min的平均反应速率v(H2)=__ mol·L-1·min -1。
②化学平衡常数K=__ 。
③催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
根据上表所给数据,用CO2生产甲醇的最优选项为__ (填字母)。
(1)已知:CO2(g)+H2(g)
 H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1
H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.0kJ/mol-1
CH3OH(g) ΔH2=-90.0kJ/mol-1写出CO2催化氢化合成甲醇的热化学方程式:
(2)为提高CH3OH转化率,理论上应采用的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[
 ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
反应物X是
(4)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol。
①前10min的平均反应速率v(H2)=
②化学平衡常数K=
③催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
| 实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。

(1)指出提取碘的过程中有关的实验操作名称___ 、___ 。
(2)写出流程图中氧化②的离子反应议程式___ 。
(3)提取碘的过程中,可供选择的有机试剂是___ 。
A.酒精 B.四氯化碳 C.醋酸 D.水
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的玻璃仪器是___ 。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出图中实验装置中的错误之处。
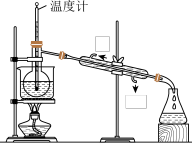
①____ ;
②____ ;
③____ 。

(1)指出提取碘的过程中有关的实验操作名称
(2)写出流程图中氧化②的离子反应议程式
(3)提取碘的过程中,可供选择的有机试剂是
A.酒精 B.四氯化碳 C.醋酸 D.水
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的玻璃仪器是
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出图中实验装置中的错误之处。

①
②
③
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】孔雀石是一种古老的玉料,常与其它含铜矿物共生(蓝铜矿、辉铜矿、赤铜矿、自然铜等),主要成分是Cu(OH)2•CuCO3,含少量FeCO3及硅的氧化物。实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
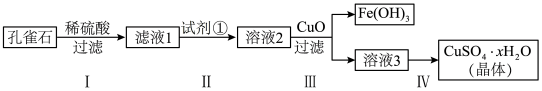
已知:Fe3+在水溶液中存在Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
Fe(OH)3开始沉淀的pH=2.7,沉淀完全的pH=3.7。
(1)为了提高原料的浸出速率,可采取的措施有________ 。
(2)步骤I所得沉淀主要成分的用途为________ 。
(3)步骤Ⅱ中试剂①是____________ (填代号)
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
加入试剂①反应的离子方程式为:________ 。
(4)请设计实验检验溶液3中是否存在Fe3+:___________ 。
(5)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.4500g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6000g。则计算得x=______ (计算结果精确到0.1)。

已知:Fe3+在水溶液中存在Fe3++3H2O
 Fe(OH)3+3H+
Fe(OH)3+3H+Fe(OH)3开始沉淀的pH=2.7,沉淀完全的pH=3.7。
(1)为了提高原料的浸出速率,可采取的措施有
(2)步骤I所得沉淀主要成分的用途为
(3)步骤Ⅱ中试剂①是
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
加入试剂①反应的离子方程式为:
(4)请设计实验检验溶液3中是否存在Fe3+:
(5)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.4500g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6000g。则计算得x=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是 ,铝、炭黑及其他杂质,回收利用的流程如图1:
,铝、炭黑及其他杂质,回收利用的流程如图1:

已知A溶液主要的金属离子是 、
、 ,还含有少量
,还含有少量 、
、 、
、 .
.
 步骤
步骤 中铝溶解的离子方程式为
中铝溶解的离子方程式为 ______ ,固体X的成分是 ______ ;
 步骤
步骤 中
中 固体溶解的化学方程式为
固体溶解的化学方程式为 ______ ,该反应的还原剂是 ______ ;
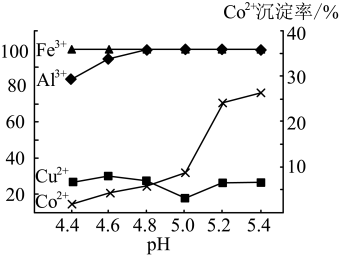
 实验表明溶液A中各种金属离子的沉淀率随pH的变化如图2,除杂时加入氨水调节溶液的pH,可除去杂质离子是
实验表明溶液A中各种金属离子的沉淀率随pH的变化如图2,除杂时加入氨水调节溶液的pH,可除去杂质离子是 ______ ;
 母液中含量最大三种离子是
母液中含量最大三种离子是 ______ ;
 从1000g锂离子电池正极材料
从1000g锂离子电池正极材料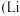 元素含量为
元素含量为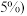 中可回收
中可回收 质量为
质量为 ______ 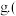 已知回收率为
已知回收率为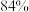 ,
, 的化学式量为74).
的化学式量为74).
 ,铝、炭黑及其他杂质,回收利用的流程如图1:
,铝、炭黑及其他杂质,回收利用的流程如图1: 
图1

图2
已知A溶液主要的金属离子是
 、
、 ,还含有少量
,还含有少量 、
、 、
、 .
.  步骤
步骤 中铝溶解的离子方程式为
中铝溶解的离子方程式为  步骤
步骤 中
中 固体溶解的化学方程式为
固体溶解的化学方程式为  实验表明溶液A中各种金属离子的沉淀率随pH的变化如图2,除杂时加入氨水调节溶液的pH,可除去杂质离子是
实验表明溶液A中各种金属离子的沉淀率随pH的变化如图2,除杂时加入氨水调节溶液的pH,可除去杂质离子是  母液中含量最大三种离子是
母液中含量最大三种离子是  从1000g锂离子电池正极材料
从1000g锂离子电池正极材料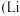 元素含量为
元素含量为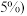 中可回收
中可回收 质量为
质量为 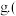 已知回收率为
已知回收率为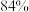 ,
, 的化学式量为74).
的化学式量为74).
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
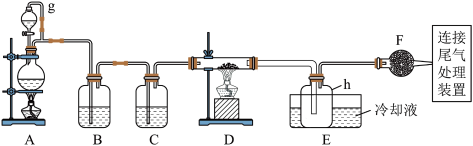
请回答下列问题:
(1)写出装置A中发生反应的离子方程式___ 。
(2)装置A中g管的作用是___ ;装置C中的试剂是___ ;装置E中的h瓶需要冷却理由是___ 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:___ ;
②滴定前是否要滴加指示剂?___ (填“是”或“否”),判断滴定终点的方法是___ 。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是___ 。
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | — | 315 | — |
| 熔点/℃ | -70.0 | — | — | — |
| 升华温度/℃ | — | 180 | 300 | 162 |

请回答下列问题:
(1)写出装置A中发生反应的离子方程式
(2)装置A中g管的作用是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:
②滴定前是否要滴加指示剂?
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】湿法炼铅可用铅精矿(主要成分为 )作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:
)作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:

已知: 是一种难溶于冷水,易溶于热水的弱电解质。在
是一种难溶于冷水,易溶于热水的弱电解质。在 浓度较大的溶液中,存在平衡:
浓度较大的溶液中,存在平衡: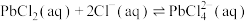 。回答下列问题:
。回答下列问题:
(1)写出铅精矿在浸取液中溶解并生成硫单质的离子方程式______ 。
(2)操作a是______ 。
(3)操作b为加适量水稀释并冷却,该操作有利于滤液1中 的析出,从平衡移动的角度分析可能的原因是
的析出,从平衡移动的角度分析可能的原因是______ 。
(4)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的 再生。
再生。
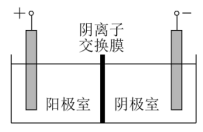
①溶液3应置于_______ (填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为 的原理:
的原理:_______ 。
③若铅精矿的质量为 ,铅浸出率为b,当电解池中通过
,铅浸出率为b,当电解池中通过 电子时,金属铅全部析出,铅精矿中
电子时,金属铅全部析出,铅精矿中 的质量分数为
的质量分数为_______ (用含a、b、c的代数式表示)。
 )作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:
)作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:
已知:
 是一种难溶于冷水,易溶于热水的弱电解质。在
是一种难溶于冷水,易溶于热水的弱电解质。在 浓度较大的溶液中,存在平衡:
浓度较大的溶液中,存在平衡: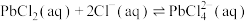 。回答下列问题:
。回答下列问题:(1)写出铅精矿在浸取液中溶解并生成硫单质的离子方程式
(2)操作a是
(3)操作b为加适量水稀释并冷却,该操作有利于滤液1中
 的析出,从平衡移动的角度分析可能的原因是
的析出,从平衡移动的角度分析可能的原因是(4)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的
 再生。
再生。
①溶液3应置于
②简述滤液2电解后再生为
 的原理:
的原理:③若铅精矿的质量为
 ,铅浸出率为b,当电解池中通过
,铅浸出率为b,当电解池中通过 电子时,金属铅全部析出,铅精矿中
电子时,金属铅全部析出,铅精矿中 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为 ,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下,其中植物粉的作用是作还原剂。
,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下,其中植物粉的作用是作还原剂。
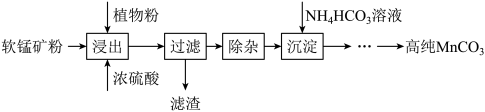
(1)浸出:漫出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是_______ 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5-5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作②中加入双氧水不仅能将 氧化为
氧化为 ,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式
,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_______ 。
(3)制备:①在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到 沉淀。该反应的化学方程式为
沉淀。该反应的化学方程式为_______ 。
②生成的 沉淀需经充分洗涤,洗涤
沉淀需经充分洗涤,洗涤 沉淀的实验操作是:
沉淀的实验操作是:_______ 。
③检验沉淀是否洗涤干净的方法是_______ 。
(4)计算:室温下,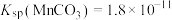 ,
,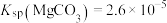 ,已知离子浓度小于
,已知离子浓度小于 mol·L
mol·L 时,表示该离子沉淀完全。若净化液中的
时,表示该离子沉淀完全。若净化液中的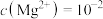 mol/L,试计算说明
mol/L,试计算说明 的存在是否会影响
的存在是否会影响 的纯度
的纯度_________ 。
 ,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下,其中植物粉的作用是作还原剂。
,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下,其中植物粉的作用是作还原剂。
(1)浸出:漫出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5-5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作②中加入双氧水不仅能将
 氧化为
氧化为 ,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式
,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式(3)制备:①在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到
 沉淀。该反应的化学方程式为
沉淀。该反应的化学方程式为②生成的
 沉淀需经充分洗涤,洗涤
沉淀需经充分洗涤,洗涤 沉淀的实验操作是:
沉淀的实验操作是:③检验沉淀是否洗涤干净的方法是
(4)计算:室温下,
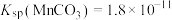 ,
,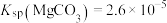 ,已知离子浓度小于
,已知离子浓度小于 mol·L
mol·L 时,表示该离子沉淀完全。若净化液中的
时,表示该离子沉淀完全。若净化液中的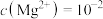 mol/L,试计算说明
mol/L,试计算说明 的存在是否会影响
的存在是否会影响 的纯度
的纯度
您最近一年使用:0次



