研究减少CO2排放是一项重要课题,CO2经催化加氢可以生成多种低碳有机物。
途径一:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=—49.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=—49.5kJ·mol-1
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+40.9kJ·mol-1
CO(g)+H2O(g) ΔH2=+40.9kJ·mol-1
III.CO(g)+2H2(g) CH3OH(g)ΔH3
CH3OH(g)ΔH3
回答下列问题:
(1)反应III的ΔH3为___________ 。
(2)在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1:3投料发生反应I,下列不能说明反应已达平衡的是___________(填序号)。
途径二:
I.2CO2(g)+2H2O(l) CH2=CH2(g)+3O2(g)
CH2=CH2(g)+3O2(g)
II.CH2=CH2(g)+H2O(1) C2H5OH(l)
C2H5OH(l)
III.2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
回答下列问题:
(3)当反应I达到平衡后,若减小压强,则CO2的转化率_______ (填“增大”减小”或“不变”)。
(4)反应III,在某铁系催化剂催化下,温度、氢碳比[ =x]对CO2平衡转化率的影响以及温度对催化效率影响如图所示,其中曲线a、b、c为二氧化碳的平衡转化率,曲线d为催化效率。
=x]对CO2平衡转化率的影响以及温度对催化效率影响如图所示,其中曲线a、b、c为二氧化碳的平衡转化率,曲线d为催化效率。

①下列有关说法正确的是___________ (填字母)。
A.反应III是一个放热反应
B.增大氢碳比,可以提高H2的平衡转化率
C.温度低于300°C时,随温度升高乙烯的平衡产率增大
D.平衡常数:K(N)<K(M)
②在总压为1MPa的恒压条件下,M点时,CO2的平衡转化率为 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)为:Kp=
,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)为:Kp=______ MPa-3(只需列出计算式)。[已知:各气体分压=平衡体系中各气体的体积分数×总压]
(5)反应III进行时,往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯的选择性,应当______ 。
途径一:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=—49.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=—49.5kJ·mol-1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+40.9kJ·mol-1
CO(g)+H2O(g) ΔH2=+40.9kJ·mol-1III.CO(g)+2H2(g)
 CH3OH(g)ΔH3
CH3OH(g)ΔH3回答下列问题:
(1)反应III的ΔH3为
(2)在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1:3投料发生反应I,下列不能说明反应已达平衡的是___________(填序号)。
| A.体系的温度保持不变 |
| B.CO2和H2的转化率相等 |
| C.单位时间内体系中减少3molH2的同时有lmolH2O增加 |
| D.合成CH3OH的反应限度达到最大 |
途径二:
I.2CO2(g)+2H2O(l)
 CH2=CH2(g)+3O2(g)
CH2=CH2(g)+3O2(g)II.CH2=CH2(g)+H2O(1)
 C2H5OH(l)
C2H5OH(l)III.2CO2(g)+6H2(g)
 CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)回答下列问题:
(3)当反应I达到平衡后,若减小压强,则CO2的转化率
(4)反应III,在某铁系催化剂催化下,温度、氢碳比[
 =x]对CO2平衡转化率的影响以及温度对催化效率影响如图所示,其中曲线a、b、c为二氧化碳的平衡转化率,曲线d为催化效率。
=x]对CO2平衡转化率的影响以及温度对催化效率影响如图所示,其中曲线a、b、c为二氧化碳的平衡转化率,曲线d为催化效率。
①下列有关说法正确的是
A.反应III是一个放热反应
B.增大氢碳比,可以提高H2的平衡转化率
C.温度低于300°C时,随温度升高乙烯的平衡产率增大
D.平衡常数:K(N)<K(M)
②在总压为1MPa的恒压条件下,M点时,CO2的平衡转化率为
 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)为:Kp=
,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)为:Kp=(5)反应III进行时,往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯的选择性,应当
更新时间:2021-12-31 16:33:44
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。甲烷干重整反应(DRM)可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为CO和
)直接转化为合成气(主要成分为CO和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。
(1)已知: 、CO和
、CO和 的燃烧热(ΔH)分别为
的燃烧热(ΔH)分别为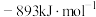 、
、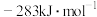 和
和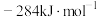 。写出甲烷干重整反应的热化学方程式:
。写出甲烷干重整反应的热化学方程式:___________ 。
(2)甲烷干重整过程中可能存在反应:
R1: (主反应)
(主反应)
R2:
R3:
R4: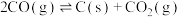
R5: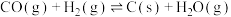
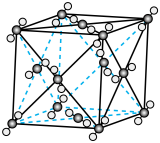
①下图表示R1反应中___________ (填化学式)固体的晶胞结构。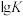 (K为各反应的平衡常数)与温度的关系如图所示。
(K为各反应的平衡常数)与温度的关系如图所示。___________ (填“升高温度”或“降低温度”),简述判断的理由:___________ 。
(3)在 、进料配比
、进料配比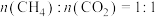 、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、
、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。___________ ℃。
②在最佳温度、p压强下,向某2L的恒容密闭容器中加入2mol 和2mol
和2mol  ,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4
,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4 ,
, 的转化率为90%,则此时R1反应的压强平衡常数
的转化率为90%,则此时R1反应的压强平衡常数
___________ (保留两位有效数字,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压=物质的量分数×平衡总压强)。
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol 和1mol CO,发生反应
和1mol CO,发生反应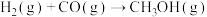 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。
___________  ;15min时改变的条件不可能是
;15min时改变的条件不可能是___________ (填标号)。
A.充入 B.充入CO C.通入惰性气体
B.充入CO C.通入惰性气体
 和
和 )直接转化为合成气(主要成分为CO和
)直接转化为合成气(主要成分为CO和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。(1)已知:
 、CO和
、CO和 的燃烧热(ΔH)分别为
的燃烧热(ΔH)分别为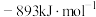 、
、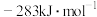 和
和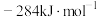 。写出甲烷干重整反应的热化学方程式:
。写出甲烷干重整反应的热化学方程式:(2)甲烷干重整过程中可能存在反应:
R1:
 (主反应)
(主反应)R2:

R3:

R4:
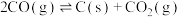
R5:
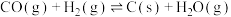
①下图表示R1反应中
 (K为各反应的平衡常数)与温度的关系如图所示。
(K为各反应的平衡常数)与温度的关系如图所示。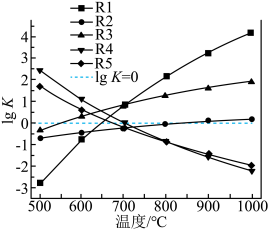
(3)在
 、进料配比
、进料配比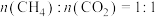 、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、
、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。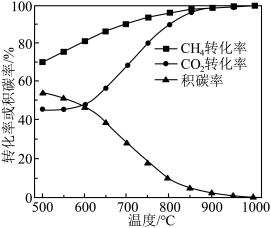
②在最佳温度、p压强下,向某2L的恒容密闭容器中加入2mol
 和2mol
和2mol  ,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4
,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4 ,
, 的转化率为90%,则此时R1反应的压强平衡常数
的转化率为90%,则此时R1反应的压强平衡常数
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
A. 和 和 的转化率相等 的转化率相等 | B.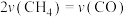 |
C. 的体积分数保持不变 的体积分数保持不变 | D.体系的温度不再变化 |
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol
 和1mol CO,发生反应
和1mol CO,发生反应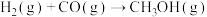 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。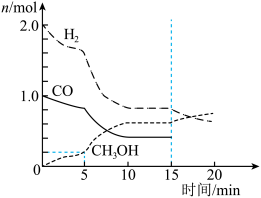

 ;15min时改变的条件不可能是
;15min时改变的条件不可能是A.充入
 B.充入CO C.通入惰性气体
B.充入CO C.通入惰性气体
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。
(1)纯碱法。以纯碱为原料吸收SO2可制备无水NaHSO3,主要流程如下:

室温下,已知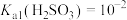 ,
,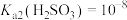 ,
, ,
,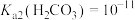 。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
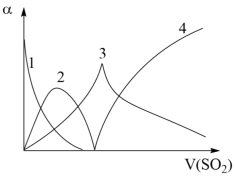
①曲线3代表的组分化学式为___________ 。
②室温下,纯碱溶液和母液恰好中和所得混合溶液的pH___________ (填“<”、“=”、“>”)7。
③“吸收”过程中发生反应的离子方程式为___________ 、___________ 。
(2)石灰石法:其中涉及的主要反应如下:
Ⅰ. ;
;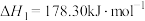
Ⅱ.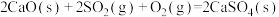 ;
;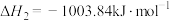
Ⅲ.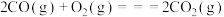 ;
;
Ⅳ. ;
;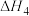
①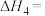
___________ 。
②在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),分析其原因:___________ 。
③利用 和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向
和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向 中加入适量浓氨水的目的是
中加入适量浓氨水的目的是___________ ;浸取温度控制在60∼70℃的原因是___________ 。
(1)纯碱法。以纯碱为原料吸收SO2可制备无水NaHSO3,主要流程如下:

室温下,已知
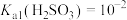 ,
,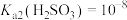 ,
, ,
,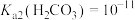 。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
①曲线3代表的组分化学式为
②室温下,纯碱溶液和母液恰好中和所得混合溶液的pH
③“吸收”过程中发生反应的离子方程式为
(2)石灰石法:其中涉及的主要反应如下:
Ⅰ.
 ;
;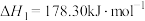
Ⅱ.
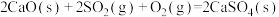 ;
;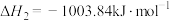
Ⅲ.
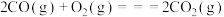 ;
;
Ⅳ.
 ;
;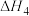
①
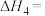
②在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),分析其原因:
③利用
 和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向
和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向 中加入适量浓氨水的目的是
中加入适量浓氨水的目的是
您最近一年使用:0次
【推荐3】研究 的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。
的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。
(1)在 加氢合成
加氢合成 体系中,同时发生以下反应:
体系中,同时发生以下反应:
反应I.
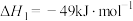
反应Ⅱ.

反应Ⅲ.

①反应Ⅲ的
_______ 。
② 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。 为0.61eV。写出该历程的化学方程式:
为0.61eV。写出该历程的化学方程式:_____ 。
(2)向体积为1L的密闭容器中,投入 和
和 ,平衡时CO或
,平衡时CO或 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: ,
,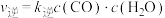 ,
, 、
、 为速率常数,c为物质的量浓度。
为速率常数,c为物质的量浓度。
①在p点时,若反应Ⅱ的 ,此时该反应的
,此时该反应的
_______ 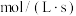 。
。
②p点时体系总压强为 ,反应Ⅱ的
,反应Ⅱ的
_______ (保留2位有效数字)。
③由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态,原因是_______ 。
(3)可通过电解法用 制备
制备 ,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为
,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为_______ g(保留小数点后1位)。 的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为
的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为 ,
, 。
。
_______ ;当 时,1mol晶胞可以俘获
时,1mol晶胞可以俘获_______ mol苯分子。
 的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。
的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。(1)在
 加氢合成
加氢合成 体系中,同时发生以下反应:
体系中,同时发生以下反应:反应I.

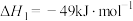
反应Ⅱ.


反应Ⅲ.


①反应Ⅲ的

②
 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
 为0.61eV。写出该历程的化学方程式:
为0.61eV。写出该历程的化学方程式:(2)向体积为1L的密闭容器中,投入
 和
和 ,平衡时CO或
,平衡时CO或 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
 ,
,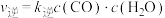 ,
, 、
、 为速率常数,c为物质的量浓度。
为速率常数,c为物质的量浓度。①在p点时,若反应Ⅱ的
 ,此时该反应的
,此时该反应的
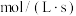 。
。②p点时体系总压强为
 ,反应Ⅱ的
,反应Ⅱ的
③由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态,原因是
(3)可通过电解法用
 制备
制备 ,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为
,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为
 的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为
的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为 ,
, 。
。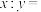
 时,1mol晶胞可以俘获
时,1mol晶胞可以俘获
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,.发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g)。回答下列问题:
CS2(g)+2H2S(g)。回答下列问题:
(1)CH4的电子式为___ 。
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___ 。
②当以下数值不变时.能说明该反应达到平衡的是___ (填字母标号)。
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___ (填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___ 。

(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单质硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式___ 。
 CS2(g)+2H2S(g)。回答下列问题:
CS2(g)+2H2S(g)。回答下列问题:(1)CH4的电子式为
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时.能说明该反应达到平衡的是
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为

(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单质硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式
您最近一年使用:0次
【推荐2】甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________ (填“>”或“<”)0,△H1=________ (用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
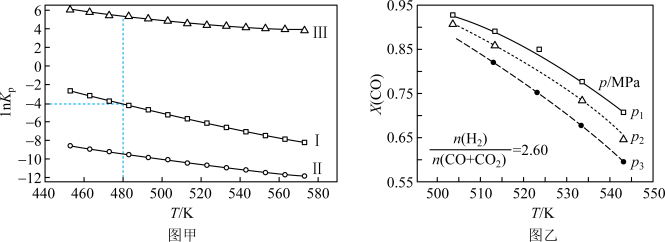
①反应(Ⅱ)的△H________ (填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________ 。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________ (KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制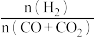 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____ (填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大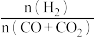 ,X(CO)增大
,X(CO)增大
Ⅰ.CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1Ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2Ⅲ.CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3回答下列问题
(1)反应(Ⅰ)的△S
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示

①反应(Ⅱ)的△H
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=
(3)若用CO和CO2混合气体合成甲醇,起始时均控制
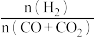 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大
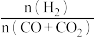 ,X(CO)增大
,X(CO)增大
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】含氮物质被广泛应用于化肥、制药、合成纤维等化工行业造福人类,但如果使用或处理不当,也会对环境造成影响。如何合理地使用含氮物质,是化学学科肩负的重要社会责任。请根据所学知识解答下列问题:
(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ.

Ⅱ.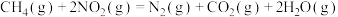

则 将
将 还原为
还原为 的热化学方程式为
的热化学方程式为_______ 。
(2)在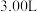 密闭容器中通入
密闭容器中通入 和
和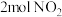 ,在一定温度下进行反应Ⅱ,反应时间
,在一定温度下进行反应Ⅱ,反应时间 与容器内气体总压强的数据见下表:
与容器内气体总压强的数据见下表:
由表中数据计算, 内
内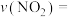
_______ 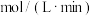 ,该温度下的平衡常数
,该温度下的平衡常数
_______ 。
(3)在一密闭的恒容容器中,若按 投料进行反应Ⅱ,下列说法正确的是_______(填字母)。
投料进行反应Ⅱ,下列说法正确的是_______(填字母)。
(4)工业合成尿素的反应如下: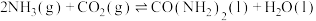 ,在恒定温度下,将
,在恒定温度下,将 和
和 按2∶1的物质的量之比充入一体积为
按2∶1的物质的量之比充入一体积为 的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经
的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经 达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,
达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,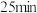 时再向容器中充入
时再向容器中充入 的
的 和
和 ,在
,在 时重新达到平衡,请在图中画出
时重新达到平衡,请在图中画出 内
内 的浓度变化曲线
的浓度变化曲线_______ 。

(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ.


Ⅱ.
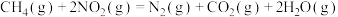

则
 将
将 还原为
还原为 的热化学方程式为
的热化学方程式为(2)在
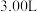 密闭容器中通入
密闭容器中通入 和
和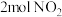 ,在一定温度下进行反应Ⅱ,反应时间
,在一定温度下进行反应Ⅱ,反应时间 与容器内气体总压强的数据见下表:
与容器内气体总压强的数据见下表:反应时间 | 0 | 2 | 4 | 6 | 8 | 10 |
总压强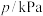 | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 内
内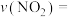
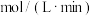 ,该温度下的平衡常数
,该温度下的平衡常数
(3)在一密闭的恒容容器中,若按
 投料进行反应Ⅱ,下列说法正确的是_______(填字母)。
投料进行反应Ⅱ,下列说法正确的是_______(填字母)。A.使用催化剂可以提高 的平衡转化率 的平衡转化率 |
B.若反应Ⅱ在400℃和500℃的平衡常数分别为 和 和 ,则 ,则 |
C.若 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
D.投料比不变,增加反应物的浓度,达到新平衡后 的转化率减小 的转化率减小 |
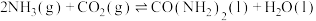 ,在恒定温度下,将
,在恒定温度下,将 和
和 按2∶1的物质的量之比充入一体积为
按2∶1的物质的量之比充入一体积为 的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经
的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经 达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,
达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,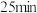 时再向容器中充入
时再向容器中充入 的
的 和
和 ,在
,在 时重新达到平衡,请在图中画出
时重新达到平衡,请在图中画出 内
内 的浓度变化曲线
的浓度变化曲线
您最近一年使用:0次
【推荐1】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
II.CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
(1)在恒容密闭容器进行反应I,测得其化学平衡常数K和温度t的关系如表:
①ΔH1___________ 0,其理由是___________ 。
②能判断该反应达到化学平衡状态的依据是___________ 。
A.c(CO)=c(CO2) B.容器内CO2的体积分数保持不变
C.容器内气体密度保持不变 D.容器中压强保持不变
③图甲、图乙分别表示反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。图甲中t2时刻发生改变的条件是___________ ,图乙中t2时刻发生改变的条件是___________ 。

④若1200℃时,在某时刻平衡体系中CO2(g)、H2(g)、CO(g)、H2O(g)的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,此时v(正)___________ v(逆)(填大于、小于或等于)。
(2)某温度时另一恒容容器中进行反应II,若开始时按n(CO)∶n(H2)=1∶2通入CO和H2,测得容器中总压强为pkPa,5min时反应达到平衡,测得容器内气体总压强为p0kPa。
①v(H2)=___________ kPa·min−1。
②该温度下反应的平衡常数Kp=___________ (Kp是用分压表示的平衡常数)。
I.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1II.CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2(1)在恒容密闭容器进行反应I,测得其化学平衡常数K和温度t的关系如表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②能判断该反应达到化学平衡状态的依据是
A.c(CO)=c(CO2) B.容器内CO2的体积分数保持不变
C.容器内气体密度保持不变 D.容器中压强保持不变
③图甲、图乙分别表示反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。图甲中t2时刻发生改变的条件是

④若1200℃时,在某时刻平衡体系中CO2(g)、H2(g)、CO(g)、H2O(g)的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,此时v(正)
(2)某温度时另一恒容容器中进行反应II,若开始时按n(CO)∶n(H2)=1∶2通入CO和H2,测得容器中总压强为pkPa,5min时反应达到平衡,测得容器内气体总压强为p0kPa。
①v(H2)=
②该温度下反应的平衡常数Kp=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】碘微溶于水,若水中含I﹣,碘溶解度增大,因为存在平衡: 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:
(1)反应 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:
I.将一定质量的单质Ⅰ2完全溶于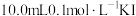 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
Ⅱ.实验测得上层溶液中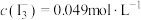 ;
;
Ⅲ.滴定下层溶液至终点时,消耗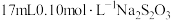 溶液
溶液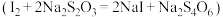 。
。
已知: 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即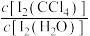 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
①分液时,使用的玻璃仪器有___________ 。
②该条件下反应 的平衡常数K=
的平衡常数K=___________ (保留三位有效数字)。
(2)某废碘液(含有Ⅰ2、 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:
i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为 ;
;
ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、 全部还原为
全部还原为 的实验现象是
的实验现象是___________ 。
②还原和浓缩的顺序不能交换,可能原因是___________ 。
③氧化时发生反应的离子方程式为___________ 。
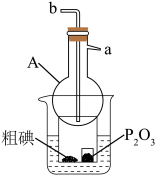
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是___________ ,进水口为___________ (填“a”或“b”),小烧杯中放置P2O5的作用是___________ 。
⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
由此得出的结论是___________ 。
 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:(1)反应
 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:I.将一定质量的单质Ⅰ2完全溶于
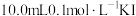 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;Ⅱ.实验测得上层溶液中
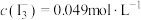 ;
;Ⅲ.滴定下层溶液至终点时,消耗
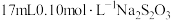 溶液
溶液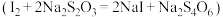 。
。已知:
 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即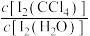 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。①分液时,使用的玻璃仪器有
②该条件下反应
 的平衡常数K=
的平衡常数K=(2)某废碘液(含有Ⅰ2、
 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为
 ;
;ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、
 全部还原为
全部还原为 的实验现象是
的实验现象是②还原和浓缩的顺序不能交换,可能原因是
③氧化时发生反应的离子方程式为
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是

⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
| 比例 | 1:0 | 1:1 | 1:2 | 1:3 | 1:4 | 1:5 |
| 萃取后碘水 | 红 | 浅黄红 | 浅黄 | 浅黄红 | 较浅黄色 | 接近无色 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】O2对人类有着重要的作用。请回答下列问题:
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=___ 。
(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=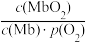 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
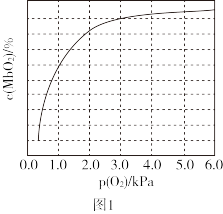
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=___ kPa。
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g) HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压___ (填“较高”或“较低”)有利于CO2排出体外。请你从平衡移动的角度解释原因___ 。
(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作析氯电极 ,本身不参与电解。已知:3NaClO+CO(NH2)2=3NaCl+2H2O+N2↑+CO2↑。

①氮原子的核外电子排布式___ 。
②电解过程中钌钛电极上发生反应为___ 。
③电解过程中不锈钢电极附近pH___ (填“降低”“升高”或“不变”)。
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目___ 。
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g)
 MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=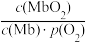 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作

①氮原子的核外电子排布式
②电解过程中钌钛电极上发生反应为
③电解过程中不锈钢电极附近pH
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目
您最近一年使用:0次



