常温下,将NaOH溶液滴加到某二元弱酸 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
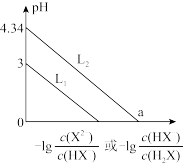
 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是
A.NaHX溶液中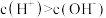 |
B.当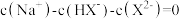 时, 时, |
C.水的电离程度: 上的点大于 上的点大于 上的点 上的点 |
D.a点溶液中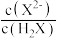 的数量级为 的数量级为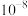 |
更新时间:2022-01-17 09:58:48
|
相似题推荐
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】25oC时,用1.00 mol·L-1的NaOH溶液滴定100 mL某二元弱酸H2A,滴定过程中溶液的pH及H2A、HA-及A2-的物质的量浓度变化如图所示,下列说法不正确的是


| A.H2A的Kal=l×10-4 |
| B.在Y点时,c (Na+)<3c(A2-) |
| C.水的电离程度:Z<X |
| D.0.01 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c (H2 A) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向20mL 0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是


| A.从a到d,HA的电离先促进再抑制 |
| B.c、e两点溶液对应的pH=7 |
| C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1 |
| D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐1】常温下,Ka1 (H2SO3)=1.5×10-2,Ka2=1.0×10-7,Kb (NH3·H2O) =1.76×10-5,设H2SO3溶液中c(总)=c( )+c(
)+c( )+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L−1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
)+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L−1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
 )+c(
)+c( )+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L−1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
)+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L−1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是A.溶液中始终存在:c( )+c(H+ )=c( )+c(H+ )=c( )+c( )+c( )+c(OH−) )+c(OH−) |
B.在NH4HSO3溶液中:c( )>c( )>c( )>c(NH3·H2O)>c(H2SO3) )>c(NH3·H2O)>c(H2SO3) |
C.pH=7的溶液:c( )=2c( )=2c( )+c( )+c( ) ) |
D.c( )=2c(总)的溶液中:c(NH3·H2O)+c(OH−)=c(H+ )+c( )=2c(总)的溶液中:c(NH3·H2O)+c(OH−)=c(H+ )+c( )+2c(H2SO3) )+2c(H2SO3) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】向某 和
和 的混合溶液中逐滴加入某浓度的
的混合溶液中逐滴加入某浓度的 溶液,测得溶液中离子浓度的关系如图所示,下列说法正确的是
溶液,测得溶液中离子浓度的关系如图所示,下列说法正确的是

 和
和 的混合溶液中逐滴加入某浓度的
的混合溶液中逐滴加入某浓度的 溶液,测得溶液中离子浓度的关系如图所示,下列说法正确的是
溶液,测得溶液中离子浓度的关系如图所示,下列说法正确的是
A.溶液中pH由小到大的顺序是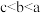 |
B.b点溶液中存在: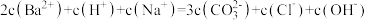 |
| C.向b点溶液中加入NaOH可使b点溶液向c点溶液转化 |
D.滴加过程中溶液存在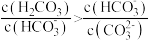 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐1】常温下,向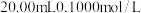 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中,
溶液,溶液中,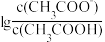 随pH的变化关系如图所示(取
随pH的变化关系如图所示(取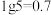 )。
)。
下列说法正确的是
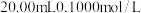 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中,
溶液,溶液中,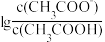 随pH的变化关系如图所示(取
随pH的变化关系如图所示(取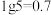 )。
)。
下列说法正确的是
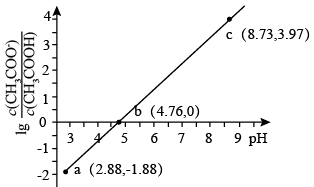
A.常温下, 的电离常数为 的电离常数为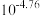 |
B.当溶液的 时,消耗 时,消耗 溶液 溶液 |
| C.溶液中水的电离程度大小:a>b>c |
D.c点溶液中: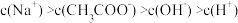 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】已知 25℃下时,NH3·H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11。 25℃时有关NH4HCO3溶液的说法中正确的是
| A.呈弱酸性 |
| B.c(OH-)+c(NH3·H2O)=c(H+)+c(H2CO3) |
| C.滴入NaOH 溶液发生反应:NH4++OH-=NH3·H2O和HCO3-+OH-=H2O+CO32- |
D.滴入NaOH溶液,则 增大 增大 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
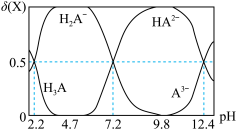
【推荐3】室温下,在0.1mol/L三元弱酸H2A溶液中,微粒 、
、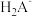 、
、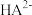 、
、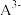 的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是
的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是
[已知:δ(X)=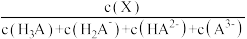 ]
]
 、
、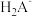 、
、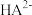 、
、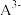 的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是
的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是[已知:δ(X)=
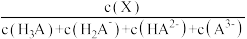 ]
]
A.反应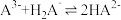 的平衡常数的值为105.2 的平衡常数的值为105.2 |
| B.物质的量浓度均为0.1 mol/L的KH2A、K2HA混合溶液中:c(K+)>c(HA2-)>c(H2A-)>c(H+)>c(OH-) |
| C.欲用H3A和K2HA配制pH=7.2的缓冲溶液(KH2A和K2HA的混合溶液),则需n(H3A):n(K2HA)=1:2 |
| D.将KOH溶液滴加到H3A溶液中,反应H2A-+OH-=HA2-+H2O发生的pH范围是4.7~9.8 |
您最近一年使用:0次

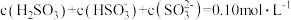 的
的 和
和 、
、 随
随 的分布如题图所示,下列指定溶液中微粒物质的量浓度关系正确的是
的分布如题图所示,下列指定溶液中微粒物质的量浓度关系正确的是
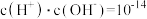
 时:
时: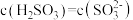
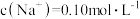 时:
时: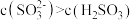
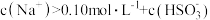

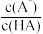 =5.24
=5.24

