在29种生命必需的元素中,按体内含量的高低可分为常量元素(如:氧、碳、氢、氮、磷等)和微量元素(如:钒、锰、钴等),回答下列问题:
(1)胞嘧啶(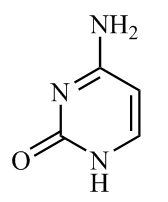 )是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为
)是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为_______ (填元素符号)。基态N原子核外电子的运动状态有_______ 种,1 mol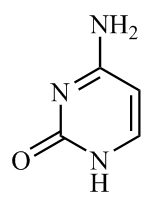 中含有
中含有 键的数目为
键的数目为_______ mol。
(2) 与
与 分子结构相似,键角
分子结构相似,键角
_______  (填“>”“<”或“=”),其原因为
(填“>”“<”或“=”),其原因为_______ 。
(3)锰在人体代谢、骨骼的形成和维生素C的合成过程中必不可少;钴是维生素B12组成部分;钒能降低血液中胆固醇的含量,还具有胰岛素的作用。基态Co原子核外电子排布式为_______ ,基态 价电子排布式为
价电子排布式为_______ , 的空间结构为
的空间结构为_______ 。
(1)胞嘧啶(
 )是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为
)是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为 中含有
中含有 键的数目为
键的数目为(2)
 与
与 分子结构相似,键角
分子结构相似,键角
 (填“>”“<”或“=”),其原因为
(填“>”“<”或“=”),其原因为(3)锰在人体代谢、骨骼的形成和维生素C的合成过程中必不可少;钴是维生素B12组成部分;钒能降低血液中胆固醇的含量,还具有胰岛素的作用。基态Co原子核外电子排布式为
 价电子排布式为
价电子排布式为 的空间结构为
的空间结构为
更新时间:2022/01/17 09:58:48
|
相似题推荐
【推荐1】元素及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)砷在元素周期表中位于___________ 区,其基态价电子排布式为___________
(2)烟火燃放过程中会产生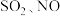 等有毒气体。硫原子最高能级电子云轮廓图的形状是
等有毒气体。硫原子最高能级电子云轮廓图的形状是___________ ,N、O、S原子的第一电离能由大到小的顺序是___________
(3)向 溶液中通入过量氨气可以生成
溶液中通入过量氨气可以生成 ,
, 电子式为
电子式为___________ 比较 键中键角大小,
键中键角大小,
___________  (填“<,>或=”),
(填“<,>或=”), 与
与 均为三角锥形分子,
均为三角锥形分子, 分子中的氮原子不易与
分子中的氮原子不易与 形成配离子,从电负性角度分析其原因是
形成配离子,从电负性角度分析其原因是___________
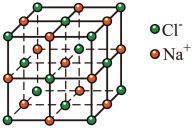
(4)已知 (晶胞如图所示)晶胞的密度为
(晶胞如图所示)晶胞的密度为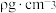 ,
, 的摩尔质量为
的摩尔质量为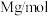 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在
,则在 晶体里
晶体里 和
和 的最短距离为
的最短距离为___________ pm。
(1)砷在元素周期表中位于
(2)烟火燃放过程中会产生
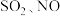 等有毒气体。硫原子最高能级电子云轮廓图的形状是
等有毒气体。硫原子最高能级电子云轮廓图的形状是(3)向
 溶液中通入过量氨气可以生成
溶液中通入过量氨气可以生成 ,
, 电子式为
电子式为 键中键角大小,
键中键角大小,
 (填“<,>或=”),
(填“<,>或=”), 与
与 均为三角锥形分子,
均为三角锥形分子, 分子中的氮原子不易与
分子中的氮原子不易与 形成配离子,从电负性角度分析其原因是
形成配离子,从电负性角度分析其原因是(4)已知
 (晶胞如图所示)晶胞的密度为
(晶胞如图所示)晶胞的密度为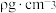 ,
, 的摩尔质量为
的摩尔质量为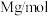 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在
,则在 晶体里
晶体里 和
和 的最短距离为
的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】Ⅰ.钒( )泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
)泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
(1)基态钒原子的价电子排布式为___________ ;与钒同周期的所有元素的基态原子中,未成对电子数最多的是___________ (填元素符号)。
Ⅱ. 为两性氧化物。
为两性氧化物。 溶解在稀硫酸中时,生成强氧化性的
溶解在稀硫酸中时,生成强氧化性的 ;
; 溶解在NaOH溶液中时,可得到
溶解在NaOH溶液中时,可得到 ,其空间构型与
,其空间构型与 相同。
相同。
(2)写出稀硫酸溶解 的化学方程式:
的化学方程式:___________ 。
(3) 中心原子价层孤电子对数目为___________。
中心原子价层孤电子对数目为___________。
(4)在碱性环境中,溶液中 与
与 可以相互转化。
可以相互转化。
① 转化为
转化为 的离子方程式为:
的离子方程式为:___________ 。
②室温下,当 时,1.0 mol⋅L-1
时,1.0 mol⋅L-1 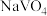 溶液中
溶液中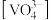 为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为
为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为___________ 。
Ⅲ.用活化后的 作催化剂,在有氧条件下氨气将NO还原成
作催化剂,在有氧条件下氨气将NO还原成 的一种反应历程如图所示。
的一种反应历程如图所示。
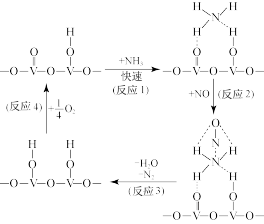
(5)上述历程中,钒元素被氧化的过程是反应___________ (填序号);写出总反应的化学方程式:___________ 。
(6)按上述图中 、NO和
、NO和 的比例进行催化脱硝反应。反应一定的时间,
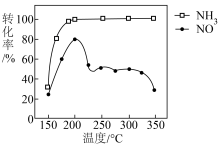
的比例进行催化脱硝反应。反应一定的时间, 和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而
和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而 仍维持较高,原因可能是:
仍维持较高,原因可能是:___________ 。
 )泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
)泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。(1)基态钒原子的价电子排布式为
Ⅱ.
 为两性氧化物。
为两性氧化物。 溶解在稀硫酸中时,生成强氧化性的
溶解在稀硫酸中时,生成强氧化性的 ;
; 溶解在NaOH溶液中时,可得到
溶解在NaOH溶液中时,可得到 ,其空间构型与
,其空间构型与 相同。
相同。(2)写出稀硫酸溶解
 的化学方程式:
的化学方程式:(3)
 中心原子价层孤电子对数目为___________。
中心原子价层孤电子对数目为___________。| A.0 | B.1 | C.2 | D.3 |
(4)在碱性环境中,溶液中
 与
与 可以相互转化。
可以相互转化。①
 转化为
转化为 的离子方程式为:
的离子方程式为:②室温下,当
 时,1.0 mol⋅L-1
时,1.0 mol⋅L-1 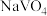 溶液中
溶液中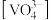 为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为
为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为Ⅲ.用活化后的
 作催化剂,在有氧条件下氨气将NO还原成
作催化剂,在有氧条件下氨气将NO还原成 的一种反应历程如图所示。
的一种反应历程如图所示。
(5)上述历程中,钒元素被氧化的过程是反应
(6)按上述图中
 、NO和
、NO和 的比例进行催化脱硝反应。反应一定的时间,
的比例进行催化脱硝反应。反应一定的时间, 和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而
和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而 仍维持较高,原因可能是:
仍维持较高,原因可能是:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为___________ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___________ I1(Cu)(填“大于”或“小于”)。原因是___________ 。
(3)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___________ ,提供孤电子对的成键原子是___________ 。
(1)Zn原子核外电子排布式为
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)
(3)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
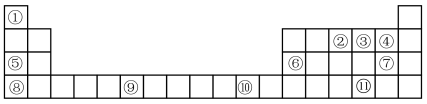
【推荐1】表格为门捷列夫元素周期表的一部分,其中的编号代表对应的元素。用元素符号回答下列问题:
(1)基态F原子有___________ 种运动状态的电子。
(2)元素③⑪电负性较大的是___________ ;Se的原子结构示意图为___________ 。
(3)元素铬的基态原子的价电子排布图为:___________ 。
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为___________ 。
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为________ 。
(6)②③的简单气态氢化物中较稳定的是___________ (填化学式),元素⑥⑦的最高价氧化物的水化物相互反应的离子方程式为___________ 。
(1)基态F原子有
(2)元素③⑪电负性较大的是
(3)元素铬的基态原子的价电子排布图为:
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为
(6)②③的简单气态氢化物中较稳定的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硫及其化合物种类繁多,应用广泛。请回答:
(1)基态硫原子的价层电子排布图是_______ 。
(2)下列有关说法正确的是_______。
(3) 中的O-O比H2O2中的更
中的O-O比H2O2中的更_______ (填“难”或“易”)断裂。其原因是_______ 。
(4)锌与硫形成的化合物晶体的晶胞如图所示。_______ 。
②设 为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度_______ 。
(1)基态硫原子的价层电子排布图是
(2)下列有关说法正确的是_______。
| A.同周期元素中,第一电离能大于硫元素的有3种 |
| B.SO2的VSEPR模型和空间结构均为V形 |
C.甲基磺酸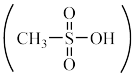 中S原子采取sp杂化 中S原子采取sp杂化 |
D. 的发射光谱不止1条谱线 的发射光谱不止1条谱线 |
(3)
 中的O-O比H2O2中的更
中的O-O比H2O2中的更(4)锌与硫形成的化合物晶体的晶胞如图所示。
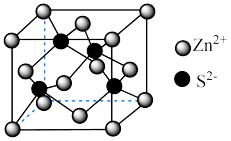
②设
 为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
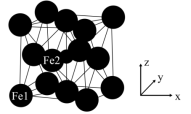
【推荐3】科学研究发现铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,因此受到研究人员的广泛关注。γ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去_______ 轨道电子。
(2)NH3中H−N−H的键角比NH 中H−N−H的键角
中H−N−H的键角_______ (填“大”或“小”)。
(3)羰基铁粉[Fe(CO)5]中配位原子为_______ 。
(4)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为_______ 。
(5)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为_______ 。已知该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为_______ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)NH3中H−N−H的键角比NH
 中H−N−H的键角
中H−N−H的键角(3)羰基铁粉[Fe(CO)5]中配位原子为
(4)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(5)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为_______ ;单晶硅的晶体类型为_______ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______ 。SiCl4可发生水解反应,机理如图:
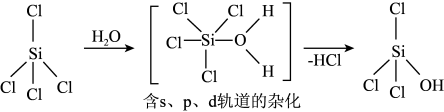
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______ (填序号)。
(2)CO2分子中存在_______ 个 键和
键和_______ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是_______ 。
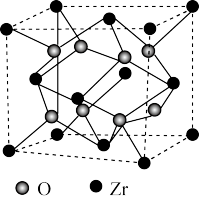
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是_______ ,晶胞参数为a pm、a pm、c pm,该晶体密度为_______ g·cm-3(写出表达式)。提示:1 pm=1.0×10-1 0cm
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】第Ⅷ族元素铁、钴、镍的单质及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为____ 。
(2)Fe、Co的第四电离能分别为5290kJ·mol-1、4950kJ·mol-1,铁的第四电离能大于钴的第四电离能的主要原因是___ 。
(3)维生素B12的结构如图所示。
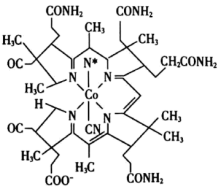
①钴的配位数为___ 。
②CN-与Co3+形成配位键时CN-中C提供孤电子对,而不是N提供孤电子对,其主要原因可能是___ 。
(4)Ni(NH3)2Cl2有两种空间结构,中心离子为___ (填离子符号),则[Ni(CN)4]2-立体结构为___ (填“正四面体”或“平面正方形)。
(5)Fe2+与环戊二烯基形成化合物Fe(C5H5)2,称为二茂铁,二茂铁为橙黄色固体,易溶于乙醚、苯、乙醇等有机溶剂,其熔点为446K。由此推知,二茂铁晶体类型是___ (填“离子晶体”或“分子晶体”)。
(6)由K+、Fe2+、Fe3+、CN-组成的一种立方晶胞如图所示(K+未画出)。
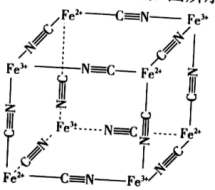
①在该晶胞中碳原子杂化类型为___ 。
②该晶胞内含有的K+数目为___ 。
③已知NA代表阿伏加德罗常数的值,晶胞边长为anm,则该晶体密度为__ g·cm-3。(只列计算式)
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为(2)Fe、Co的第四电离能分别为5290kJ·mol-1、4950kJ·mol-1,铁的第四电离能大于钴的第四电离能的主要原因是
(3)维生素B12的结构如图所示。

①钴的配位数为
②CN-与Co3+形成配位键时CN-中C提供孤电子对,而不是N提供孤电子对,其主要原因可能是
(4)Ni(NH3)2Cl2有两种空间结构,中心离子为
(5)Fe2+与环戊二烯基形成化合物Fe(C5H5)2,称为二茂铁,二茂铁为橙黄色固体,易溶于乙醚、苯、乙醇等有机溶剂,其熔点为446K。由此推知,二茂铁晶体类型是
(6)由K+、Fe2+、Fe3+、CN-组成的一种立方晶胞如图所示(K+未画出)。

①在该晶胞中碳原子杂化类型为
②该晶胞内含有的K+数目为
③已知NA代表阿伏加德罗常数的值,晶胞边长为anm,则该晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2024年2月24日,中国载人月球探测任务新飞行器命名为“梦舟”,月面着陆器命名为“揽月”,登陆月球成为中国人探索太空的下一个目标。月壤中存在天然的铜、锌、铁等矿物颗粒,回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2)配合物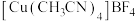 中,
中,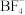 的空间构型是
的空间构型是___________ 。
(3) 与
与 形成的某种晶体的晶胞如下图所示,该晶胞中
形成的某种晶体的晶胞如下图所示,该晶胞中 微粒的配位数为
微粒的配位数为___________ ,该化合物的化学式为___________ 。
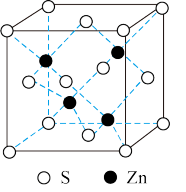
写出该化合物与稀硫酸反应的离子方程式___________ 。
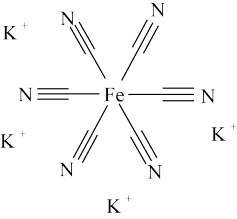
(4)亚铁氰化钾别名黄血盐,化学式: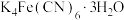 ,加入食盐中可防止食盐板结。其中
,加入食盐中可防止食盐板结。其中 三种元素的电负性由小到大顺序为
三种元素的电负性由小到大顺序为___________ ,其不含结晶水的盐结构如下图所示,其中 原子的杂化轨道类型为
原子的杂化轨道类型为___________ 杂化。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)配合物
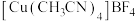 中,
中,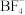 的空间构型是
的空间构型是(3)
 与
与 形成的某种晶体的晶胞如下图所示,该晶胞中
形成的某种晶体的晶胞如下图所示,该晶胞中 微粒的配位数为
微粒的配位数为
写出该化合物与稀硫酸反应的离子方程式
(4)亚铁氰化钾别名黄血盐,化学式:
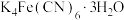 ,加入食盐中可防止食盐板结。其中
,加入食盐中可防止食盐板结。其中 三种元素的电负性由小到大顺序为
三种元素的电负性由小到大顺序为 原子的杂化轨道类型为
原子的杂化轨道类型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铁能形成多种化合物,如Fe(SCN)3,[Fe(CO)5](羰基铁),它们在生活生产中有广泛应用。
(1)Fe3+基态核外电子排布式为_____ 。
(2)实验室用KSCN溶液、苯酚溶液检验Fe3+.N、O、S的第一电离能由大到小的顺序为____ 。SCN﹣中的碳原子的杂化轨道类型为_____ 。与SCN﹣互为等电子体的分子是_____ 。
(3)羰基铁[Fe(CO)5]可用作催化剂。1mol[Fe(CO)5]分子中含σ键数目为_____ 。
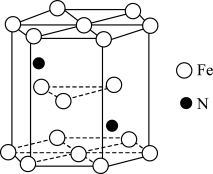
(4)某种氮化铁晶胞的晶体如图所示,该氮化铁晶体的化学式为_____ 。
(1)Fe3+基态核外电子排布式为
(2)实验室用KSCN溶液、苯酚溶液检验Fe3+.N、O、S的第一电离能由大到小的顺序为
(3)羰基铁[Fe(CO)5]可用作催化剂。1mol[Fe(CO)5]分子中含σ键数目为
(4)某种氮化铁晶胞的晶体如图所示,该氮化铁晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】现今世界,新药物、新材料层出不穷。
(1)香料材料苯丙烯醇(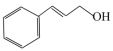 )中可能共面的碳原子数最多有
)中可能共面的碳原子数最多有______ 个。苯丙酮(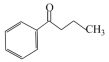 )不溶于水,苯丙烯醇(
)不溶于水,苯丙烯醇( )溶于水,二者溶解度相差较大的主要原因是
)溶于水,二者溶解度相差较大的主要原因是______ 。
(2)纳米二氧化钛 是一种光催化剂,常用于污水处理。其中一个实例如图所示。
是一种光催化剂,常用于污水处理。其中一个实例如图所示。
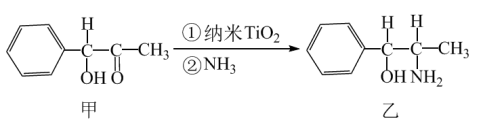
①化合物乙的分子中采取 杂化方式的原子有C和
杂化方式的原子有C和______ 。(填元素符号)
②碳原子连接4个不同的原子或原子团时,称为手性碳原子。一个化合物乙分子中含有______ 个手性碳原子。
③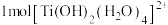 中
中 键的数目为
键的数目为______ 。
(3)砷化镓属于第三代半导体,晶胞结构与金刚石相似,如图所示。
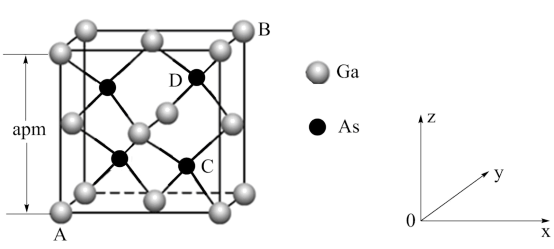
①砷化镓晶胞中镓原子的配位数为______ 。
② 原子占据的是
原子占据的是 原子围成的
原子围成的______ 空隙(填几何空间构型)。
③晶胞中原子坐标参数A为 ,B为
,B为 ,C
,C ,则D为
,则D为______ 。
④阿伏加 德罗常数的值为 ,砷化镓的密度为
,砷化镓的密度为______ 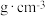 (列出计算式)
(列出计算式)
(1)香料材料苯丙烯醇(
 )中可能共面的碳原子数最多有
)中可能共面的碳原子数最多有 )不溶于水,苯丙烯醇(
)不溶于水,苯丙烯醇( )溶于水,二者溶解度相差较大的主要原因是
)溶于水,二者溶解度相差较大的主要原因是(2)纳米二氧化钛
 是一种光催化剂,常用于污水处理。其中一个实例如图所示。
是一种光催化剂,常用于污水处理。其中一个实例如图所示。
①化合物乙的分子中采取
 杂化方式的原子有C和
杂化方式的原子有C和②碳原子连接4个不同的原子或原子团时,称为手性碳原子。一个化合物乙分子中含有
③
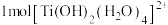 中
中 键的数目为
键的数目为(3)砷化镓属于第三代半导体,晶胞结构与金刚石相似,如图所示。

①砷化镓晶胞中镓原子的配位数为
②
 原子占据的是
原子占据的是 原子围成的
原子围成的③晶胞中原子坐标参数A为
 ,B为
,B为 ,C
,C ,则D为
,则D为④阿伏加 德罗常数的值为
 ,砷化镓的密度为
,砷化镓的密度为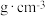 (列出计算式)
(列出计算式)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____ 区,其基态原子的价电子排布图为_________ 。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________ 。
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为______ ,提供孤电子对的成键原子是_________ 。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________ 。
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为_________ 。但NF3不易与Cu2+形成化学键,其原因是_______________ 。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。
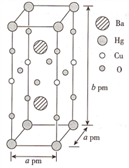
①该物质的化学式为__________ 。
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为_____ 个,二者的最短距离为_______ pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为______ g·cm-3。
(1)铜元素位于元素周期表中的
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次



