我国科学家已经成功地利用二氧化碳催化氢化获得甲酸,利用化合物1催化氢化二氧化碳的反应过程如图甲所示,其中化合物2与水反应变成化合物3与HCOO-的反应历程如图乙所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是




| A.从平衡移动的角度看,升高温度可促进化合物2与水反应变成化合物3与HCOO- |
| B.该历程中最大能垒(活化能)E正=16.87kcal/mol |
| C.使用更高效的催化剂可以降低反应所需的活化能,最终提高二氧化碳的转化率 |
| D.化合物1到化合物2的过程中存在碳氧键的断裂和碳氢键的形成 |
更新时间:2022-03-05 12:00:04
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】以甲醇为原料,采用钴碘催化法循环制醋酸,过程如图所示。下列说法正确的是

A.总反应的原子利用率为 |
B. 和 和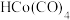 可降低该反应的活化能及反应热 可降低该反应的活化能及反应热 |
C. 与CH4为等电子体 与CH4为等电子体 |
D. 中 中 键数目 键数目 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】某反应过程中体系的能量变化如图所示,下列说法错误的是


A.反应过程可表示为     |
| B.E1为反应物的能量与过渡态的能量差,称为正反应的活化能 |
| C.正反应的热效应为ΔH=E1−E2,且E2>E1,所以正反应为放热反应 |
| D.此图中逆反应的热效应为ΔH=E1−E2,逆反应为吸热反应 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是


| A.图1中可以通过测定相同状况下反应产生的气体体积及反应时间比较反应速率的大小 |
| B.用图1装置进行实验时,关闭A处活塞,将注射器活塞向外拉,松开后活塞复原说明装置气密性良好 |
| C.图2实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| D.若图2所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解反应的催化效果好 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】研究发现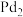 团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法正确的是
团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法正确的是
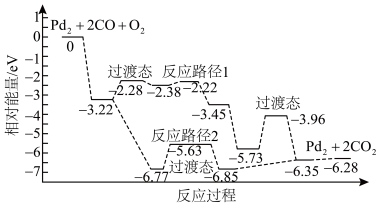
 团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法正确的是
团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法正确的是
| A.该过程中有极性键和非极性键的断裂和生成 |
| B.路径1中最大能垒(活化能)E正=1.77eV,为路径1的决速步 |
C. 团簇可有效提高CO的平衡转化率 团簇可有效提高CO的平衡转化率 |
| D.反应路径1的催化效果更好 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】对可逆反应 ,下列叙述正确的是
,下列叙述正确的是
 ,下列叙述正确的是
,下列叙述正确的是A.若单位时间内生成 的同时,消耗 的同时,消耗 ,则反应达到平衡状态 ,则反应达到平衡状态 |
B.达到平衡后,保持温度不变,减小容器体积增大压强,平衡逆向移动, 减小 减小 |
| C.降低温度,正反应速率增大,逆反应速率减少,平衡正向移动 |
D.其它条件不变,若增加 的量,可以提高 的量,可以提高 的转化率 的转化率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】下列事实中,不能能用勒夏特列原理解释的是
| A.实验室可用浓氨水和氢氧化钠固体快速制取氨气 |
| B.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 |
C.对于2HI(g)  H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
您最近一年使用:0次

 、
、 和
和 的溶液中,发生反应:
的溶液中,发生反应: ,其分解机理及反应进程中的能量变化如下:
,其分解机理及反应进程中的能量变化如下:

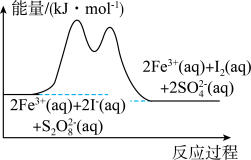

 Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是(
Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是(

