氯锆(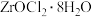 )是生产硫酸锆的前驱体。一种利用锆英砂(主要成分为
)是生产硫酸锆的前驱体。一种利用锆英砂(主要成分为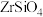 )制备氯锆的过程如下:
)制备氯锆的过程如下:
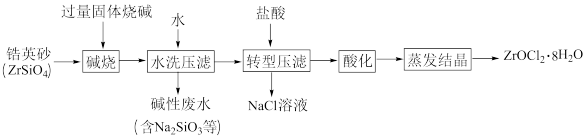
已知: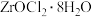 能溶于水,溶解时发生电离:
能溶于水,溶解时发生电离: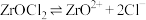 。
。
(1)“碱烧”时应先将锆英砂粉碎,其目的是___________ 。
(2)“转型压滤”发生的主要反应为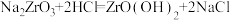 。“转型压滤”和“酸化”时都要加入盐酸,但不能将这两步操作合并进行的原因是
。“转型压滤”和“酸化”时都要加入盐酸,但不能将这两步操作合并进行的原因是___________ 。
(3)“酸化”时加入的盐酸需过量的原因是___________ 。
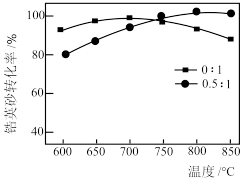
(4)与NaOH相比,CaO更易获得且价格低康。其他条件相同时,控制“碱烧”过程中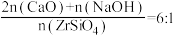 ,测得不同
,测得不同 时,锆英砂转化率随温度变化的关系如图所示。实际工业生产中选择
时,锆英砂转化率随温度变化的关系如图所示。实际工业生产中选择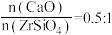 、温度为800℃,而不选择
、温度为800℃,而不选择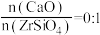 、温度为700℃的原因是
、温度为700℃的原因是___________ 。
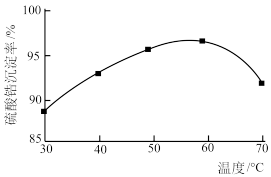
(5)向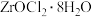 浓溶液中加入稀硫酸,会很快析出白色硫酸锆沉淀,且反应明显放热。硫酸锆沉淀率随温度变化的曲线如图所示。30~60℃时,随温度升高硫酸锆沉淀率上升的原因是
浓溶液中加入稀硫酸,会很快析出白色硫酸锆沉淀,且反应明显放热。硫酸锆沉淀率随温度变化的曲线如图所示。30~60℃时,随温度升高硫酸锆沉淀率上升的原因是___________ 。
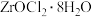 )是生产硫酸锆的前驱体。一种利用锆英砂(主要成分为
)是生产硫酸锆的前驱体。一种利用锆英砂(主要成分为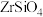 )制备氯锆的过程如下:
)制备氯锆的过程如下:
已知:
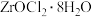 能溶于水,溶解时发生电离:
能溶于水,溶解时发生电离: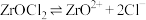 。
。(1)“碱烧”时应先将锆英砂粉碎,其目的是
(2)“转型压滤”发生的主要反应为
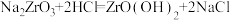 。“转型压滤”和“酸化”时都要加入盐酸,但不能将这两步操作合并进行的原因是
。“转型压滤”和“酸化”时都要加入盐酸,但不能将这两步操作合并进行的原因是(3)“酸化”时加入的盐酸需过量的原因是
(4)与NaOH相比,CaO更易获得且价格低康。其他条件相同时,控制“碱烧”过程中
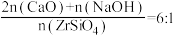 ,测得不同
,测得不同 时,锆英砂转化率随温度变化的关系如图所示。实际工业生产中选择
时,锆英砂转化率随温度变化的关系如图所示。实际工业生产中选择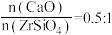 、温度为800℃,而不选择
、温度为800℃,而不选择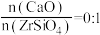 、温度为700℃的原因是
、温度为700℃的原因是
(5)向
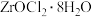 浓溶液中加入稀硫酸,会很快析出白色硫酸锆沉淀,且反应明显放热。硫酸锆沉淀率随温度变化的曲线如图所示。30~60℃时,随温度升高硫酸锆沉淀率上升的原因是
浓溶液中加入稀硫酸,会很快析出白色硫酸锆沉淀,且反应明显放热。硫酸锆沉淀率随温度变化的曲线如图所示。30~60℃时,随温度升高硫酸锆沉淀率上升的原因是
更新时间:2022-03-09 19:48:33
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
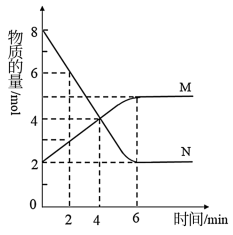
(1)反应的化学方程式为___ 。
(2)反应达到最大限度的时间是__ min,该时间内的平均反应速率υ(N)=__ 。
(3)反应达到平衡状态时,放出6QkJ的热量。若容器开始时充入lmolN,反应放出的热量为__ 。
A.等于QkJ B.小于QkJ C.大于QkJ D.等于2QkJ
(4)判断该反应达到平衡状态的依据是___ 。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的平均摩尔质量不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是___ 。
①升高温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④使用催化剂
(6)一定温度下,将一定量的N2和H2充入2L固定体积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2mol•L﹣1。10min时N2的转化率为
2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2mol•L﹣1。10min时N2的转化率为___ ;平衡时的压强和起始时的压强之比为___ 。

(1)反应的化学方程式为
(2)反应达到最大限度的时间是
(3)反应达到平衡状态时,放出6QkJ的热量。若容器开始时充入lmolN,反应放出的热量为
A.等于QkJ B.小于QkJ C.大于QkJ D.等于2QkJ
(4)判断该反应达到平衡状态的依据是
①该条件下,正逆反应速率都为零
②该条件下,混合气体的平均摩尔质量不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是
①升高温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④使用催化剂
(6)一定温度下,将一定量的N2和H2充入2L固定体积的密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2mol•L﹣1。10min时N2的转化率为
2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2mol•L﹣1。10min时N2的转化率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL0.1mol·L-1KClO3溶液和10mL0.3mol·L-1NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=_______ mol·L-1·min-1。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
ⅰ.探究化学反应速率增大的影响因素:
已知: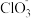 +3
+3 =Cl-+3
=Cl-+3 +3H+。
+3H+。
问题与思考:
①方案Ⅲ烧杯①中加入1mL水的作用是_______ 。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案Ⅲ实验操作设计不严谨,改进措施为_______ 。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设:_______ 。
ⅱ.反应后期,化学反应速率降低的主要原因是_______ 。

(1)根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
ⅰ.探究化学反应速率增大的影响因素:
已知:
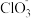 +3
+3 =Cl-+3
=Cl-+3 +3H+。
+3H+。| 方案 | 假设 | 具体实验操作 |
| Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液, |
| Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL0.1moL/LKClO3溶液于烧杯中,先加入 |
| Ⅲ | 反应中溶液酸性增强,加快了化学反应速率 | 分别向2个烧杯中加入10mL0.1mol/LKClO3溶液,烧杯①中加入1mL水,烧杯②中加入1mL0.2mol/L盐酸,再分别向烧杯中加入10mL0.3mol/LNaHSO3溶液 |
①方案Ⅲ烧杯①中加入1mL水的作用是
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案Ⅲ实验操作设计不严谨,改进措施为
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设:
ⅱ.反应后期,化学反应速率降低的主要原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】碘化钠在有机合成、医疗及食品等方面用途广泛,有多种制备方法,下图是“水合肼还原法”制备碘化钠的一种方案。

已知:①3I 2+ 6NaOH =5NaI+ NaIO3 + 3H2O。
②水合肼(N2H4·H2O)有还原性,沸点118°C,100°C开始分解。
回答下列问题:
(1)装置图中仪器a的名称为___________ 。若要使分液漏斗中的水合肼顺利流入三颈烧瓶中,具体的操作是___________ 。
(2)实验过程中需控制反应温度在70°C左右,原因是___________ 。装置图中加热的方式最好选用___________ 。
(3)肼(N2H4)的电子式为___________ 。制备过程中,N2H4· H2O参与反应的离子方程式为___________ 。工业上也可用其他方法制备NaI,但“水合肼还原法”的优点是___________ 。
(4)测定产品中NaI的含量,采用电位滴定法测定,实验步骤如下:

产品中NaI的质量分数是___________ 。

已知:①3I 2+ 6NaOH =5NaI+ NaIO3 + 3H2O。
②水合肼(N2H4·H2O)有还原性,沸点118°C,100°C开始分解。
回答下列问题:
(1)装置图中仪器a的名称为
(2)实验过程中需控制反应温度在70°C左右,原因是
(3)肼(N2H4)的电子式为
(4)测定产品中NaI的含量,采用电位滴定法测定,实验步骤如下:

产品中NaI的质量分数是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________ (至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________ 。
(2)以甲烷为原料可制得氢气。图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量(KJ)变化示意图,写出该反应的热化学方程式_______________ (△H用E1、E2、E3表示)。

(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
(4)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH- FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在__________ (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____________ 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:_____________ 。
(5)在容积可变的密闭容器中充入10molCO和20molH2,发生CO ( g ) + 2H2( g ) CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)=
CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)=___________ L。

(1)与汽油相比,氢气作为燃料的优点是
(2)以甲烷为原料可制得氢气。图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量(KJ)变化示意图,写出该反应的热化学方程式

(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)
 MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。| A.容器内气体压强保持不变 |
| B.吸收ymol H2只需1 mol MHx |
| C.若降温,该反应的平衡常数增大 |
| D.若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
 FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在
②电解过程中,须将阴极产生的气体及时排出,其原因是
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:
(5)在容积可变的密闭容器中充入10molCO和20molH2,发生CO ( g ) + 2H2( g )
 CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)=
CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用如下反应合成甲醇:CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
下表所列数据是该反应在不同温度下的化学平衡常数(K):
①由表中数据判断ΔH_____ (填“>”“<”或“=”)0。
②若容器容积不变,下列措施可增大甲醇产率的是_____ (填字母)。
A.升高温度B.将CH3OH(g)从体系中分离
C.使用合适的催化剂D.充入He,使体系总压强增大
E.按原比例再充入CO和H2
③某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为_____ 。
④恒温恒压下,1molCO和nmolH2在一个容积可变的密闭容器中反应达到平衡后,生成amolCH3OH。若起始时充入3molCO、3nmolH2,则达平衡时生成CH3OH的物质的量为_____ mol。
Ⅱ.25℃时,CH3COOH、H2CO3、HClO的电离平衡常数如下:
(2)下列四种离子结合H+的能力由强到弱的顺序是_____ (填字母,下同)。
A. B.ClO-C.CH3COO-D.
B.ClO-C.CH3COO-D.
(3)下列反应不能 发生的是_____ 。
A. +2CH3COOH
+2CH3COOH 2CH3COO-+CO2↑+H2OB.ClO-+CH3COOH
2CH3COO-+CO2↑+H2OB.ClO-+CH3COOH CH3COO-+HClO
CH3COO-+HClO
C. +2HClO
+2HClO CO2↑+H2O+2ClO-D.2ClO-+CO2+H2O
CO2↑+H2O+2ClO-D.2ClO-+CO2+H2O
 +2HClO
+2HClO
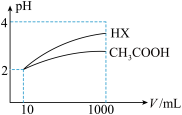
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH的变化如图,则HX的电离平衡常数_____ 醋酸的电离平衡常数(填“大于”“等于”或“小于”),稀释后,HX溶液中水电离出来的c(H+)_____ 醋酸溶液中水电离出来的c(H+)(填“大于”“等于”或“小于”)。
(1)工业上一般采用如下反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)ΔH
CH3OH(g)ΔH下表所列数据是该反应在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH
②若容器容积不变,下列措施可增大甲醇产率的是
A.升高温度B.将CH3OH(g)从体系中分离
C.使用合适的催化剂D.充入He,使体系总压强增大
E.按原比例再充入CO和H2
③某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为
④恒温恒压下,1molCO和nmolH2在一个容积可变的密闭容器中反应达到平衡后,生成amolCH3OH。若起始时充入3molCO、3nmolH2,则达平衡时生成CH3OH的物质的量为
Ⅱ.25℃时,CH3COOH、H2CO3、HClO的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(2)下列四种离子结合H+的能力由强到弱的顺序是
A.
 B.ClO-C.CH3COO-D.
B.ClO-C.CH3COO-D.
(3)下列反应
A.
 +2CH3COOH
+2CH3COOH 2CH3COO-+CO2↑+H2OB.ClO-+CH3COOH
2CH3COO-+CO2↑+H2OB.ClO-+CH3COOH CH3COO-+HClO
CH3COO-+HClOC.
 +2HClO
+2HClO CO2↑+H2O+2ClO-D.2ClO-+CO2+H2O
CO2↑+H2O+2ClO-D.2ClO-+CO2+H2O
 +2HClO
+2HClO(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH的变化如图,则HX的电离平衡常数

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】一定温度下,在容积固定的V L密闭容器中加入1 mol A、2 mol B,发生反应:A(g)+2B(g)⇌ 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________ (填字母)。
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=______________ 。达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是____________ (填字母序号)。
A.c(A)减少 B.正反应速率加快,逆反应速率减慢
C.C的物质的量增加 D.重新平衡时c(B)/c(C)减小
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件: t2时____________________________ ; t8时______________________________ 。
②t2时平衡向________ (填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。____________
(1)一段时间后上述反应达到平衡。则下列说法中正确的是
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=
A.c(A)减少 B.正反应速率加快,逆反应速率减慢
C.C的物质的量增加 D.重新平衡时c(B)/c(C)减小
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件: t2时
②t2时平衡向
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
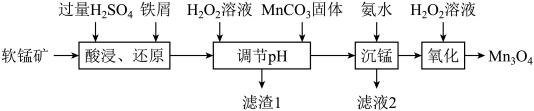
25℃时,相关金属离子 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“酸浸、还原”时,为提高酸浸速率,可采取的措施有_______ (举1例)。
(2)“酸浸、还原”后溶液中含有的金属阳离子有 、
、_______ (填离子符号),铁屑、 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(3)“调节pH”时,加入 溶液的目的是
溶液的目的是_______ ,“调节pH”的范围为_______ 。滤渣1的主要成分是 、
、 和
和_______ 。
(4)“沉锰”时发生反应的离子方程式为_______ 。
(5)“氧化”时一般控制温度在80℃~85℃,可采取的加热方法是_______ 。
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
25℃时,相关金属离子
 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 3.4 | 8.1 |
| 沉淀完全的pH | 2.8 | 8.3 | 4.7 | 10.1 |
(1)“酸浸、还原”时,为提高酸浸速率,可采取的措施有
(2)“酸浸、还原”后溶液中含有的金属阳离子有
 、
、 与
与 反应的离子方程式为
反应的离子方程式为(3)“调节pH”时,加入
 溶液的目的是
溶液的目的是 、
、 和
和(4)“沉锰”时发生反应的离子方程式为
(5)“氧化”时一般控制温度在80℃~85℃,可采取的加热方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
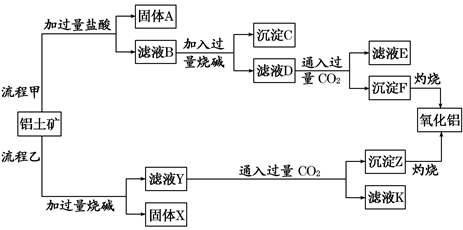
【推荐2】从铝土矿(主要成分是 ,含
,含 ,
, ,
, 等杂质)中提取氧化铝的两种工艺流程如图:
等杂质)中提取氧化铝的两种工艺流程如图:
请回答下列问题:
(1)固体 的主要成分是
的主要成分是_______ (写名称)。
(2)铝土矿与过量烧碱反应的离子方程式为_______ 、_______ 。
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式_______ 。
(4)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料 与一种中学常见气体
与一种中学常见气体 ,已知每转移
,已知每转移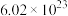 个电子,有
个电子,有 化合物
化合物 生成,此反应的化学方程式
生成,此反应的化学方程式_______ 。
 ,含
,含 ,
, ,
, 等杂质)中提取氧化铝的两种工艺流程如图:
等杂质)中提取氧化铝的两种工艺流程如图:
请回答下列问题:
(1)固体
 的主要成分是
的主要成分是(2)铝土矿与过量烧碱反应的离子方程式为
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式
(4)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料
 与一种中学常见气体
与一种中学常见气体 ,已知每转移
,已知每转移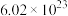 个电子,有
个电子,有 化合物
化合物 生成,此反应的化学方程式
生成,此反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】电子工业常用30%的FeCl3溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的离子方程式:_________________________ 。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备用如图所示步骤:
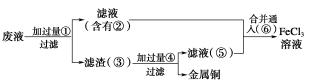
A.写出上述实验中加入或生成的有关物质的化学式:
①________ ;②________ ;③________ ;④________ ;⑤________ ;⑥________ 。
B.写出下列过程中的离子方程式:
①→②___________________________________ ;
⑤+⑥_______________________________________________________ 。
(1)写出FeCl3溶液与金属铜发生反应的离子方程式:
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备用如图所示步骤:

A.写出上述实验中加入或生成的有关物质的化学式:
①
B.写出下列过程中的离子方程式:
①→②
⑤+⑥
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以铝土矿(主要成分为 ,少量
,少量 等杂质)为原料冶炼金属铝的工艺流程如下:
等杂质)为原料冶炼金属铝的工艺流程如下:
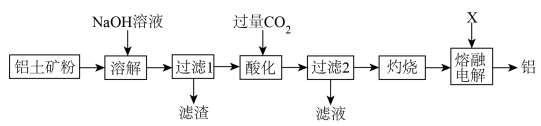
(1)铝土矿预先粉碎的目的是___________ 。
(2)“过滤1”时,滤渣的主要成分为___________ 。
(3)“酸化”过程中发生反应的离子方程式为___________ 。
(4)“灼烧”时,反应的化学方程式为___________ 。
(5)“熔融电解”时需要加入X作助熔剂,X为___________ 。
(6)某原电池用铝、石墨作电极,电解质溶液为KOH溶液。该电池的负极电极反应式为___________ ,电池总反应式为___________ 。
 ,少量
,少量 等杂质)为原料冶炼金属铝的工艺流程如下:
等杂质)为原料冶炼金属铝的工艺流程如下:
(1)铝土矿预先粉碎的目的是
(2)“过滤1”时,滤渣的主要成分为
(3)“酸化”过程中发生反应的离子方程式为
(4)“灼烧”时,反应的化学方程式为
(5)“熔融电解”时需要加入X作助熔剂,X为
(6)某原电池用铝、石墨作电极,电解质溶液为KOH溶液。该电池的负极电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】硫化亚铁(FeS)是一种常见的还原剂。用FeS处理模拟含铬废水的流程如下:

(1)“还原”过程发生反应的离子方程式为______ 。
(2)为测定模拟废水中铬元素的去除率,进行如下实验:将滤渣用蒸馏水洗净后,在低温条件下干燥,称得质量为2.210 0 g。将上述2.210 0 g固体在空气中加热,测得固体质量随温度的变化如图所示。
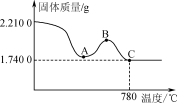
说明:(Ⅰ)780℃以上的残留固体为Fe2O3、Cr2O3的混合物。
(Ⅱ)有关物质的摩尔质量如下表:
①A→B固体质量增加是由滤渣中_____ (填化学式)发生反应引起的。
②根据以上实验数据计算上述模拟废水中铬元素的去除率(写出计算过程)。____________

(1)“还原”过程发生反应的离子方程式为
(2)为测定模拟废水中铬元素的去除率,进行如下实验:将滤渣用蒸馏水洗净后,在低温条件下干燥,称得质量为2.210 0 g。将上述2.210 0 g固体在空气中加热,测得固体质量随温度的变化如图所示。

说明:(Ⅰ)780℃以上的残留固体为Fe2O3、Cr2O3的混合物。
(Ⅱ)有关物质的摩尔质量如下表:
| 物质 | K2CrO4 | Cr(OH)3 | Cr2O3 | FeS | FeOOH | Fe2O3 |
| M/(g·mol-1) | 194 | 103 | 152 | 88 | 89 | 160 |
②根据以上实验数据计算上述模拟废水中铬元素的去除率(写出计算过程)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:0.5 ℃,有毒)常温下是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在温常压下合成,并以液态储存。

(1)甲组的同学拟制备原料气 NO 和 Cl2,均采用上图制备装置:为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上)
(2)乙组同学利用甲组制得的 NO 和 Cl2制备 NOCl,装置如图所示:

①装置连接顺序为 a→_____ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥 NO、Cl2 外,另一个作用是_____
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?_____
④装置Ⅷ中吸收尾气时,NOCl 发生的非氧化还原反应的化学方程式为______

(1)甲组的同学拟制备原料气 NO 和 Cl2,均采用上图制备装置:为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上)
实验项目 | 装置Ⅰ | 装置Ⅱ | |
制备的气体 | 烧瓶中 | 分液漏斗中 | |
| a.制备纯净干燥的 Cl2 | MnO2 | ① | ② |
| b.制备纯净干燥的 NO | Cu | ③ | ④ |

①装置连接顺序为 a→
②装置Ⅳ、Ⅴ除可进一步干燥 NO、Cl2 外,另一个作用是
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?
④装置Ⅷ中吸收尾气时,NOCl 发生的非氧化还原反应的化学方程式为
您最近一年使用:0次



