回答下列问题:
(1)Pt的电子排布式为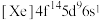 ,则Pt在元素周期表中的位置是
,则Pt在元素周期表中的位置是_______ ,处于_______ 区。
(2) 中阴离子的立体构型名称是
中阴离子的立体构型名称是_______ ,B、N、H的电负性由大到小的顺序为_______ 。
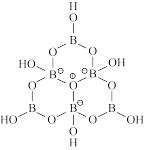
(3)科学家合成了一种含硼阴离子[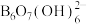 ],其结构如下图所示。其中硼原子的杂化方式为
],其结构如下图所示。其中硼原子的杂化方式为_______ ,该结构中共有_______ 种不同化学环境的氧原子。
(4)金属硼氢化物可用作储氢材料。如图是一种金属硼氢化物氨合物的晶体结构示意图。图中八面体的中心代表金属M原子,顶点代表氨分子;四面体的中心代表硼原子,顶点代表氢原子。该晶体属立方晶系,晶胞棱边夹角均为90,棱长为apm,密度为3 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。

①该晶体的化学式为_______ 。
②金属M原子与硼原子间最短距离为_______ pm。
③金属M的相对原子质量为_______ (列出表达式)。
(1)Pt的电子排布式为
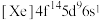 ,则Pt在元素周期表中的位置是
,则Pt在元素周期表中的位置是(2)
 中阴离子的立体构型名称是
中阴离子的立体构型名称是(3)科学家合成了一种含硼阴离子[
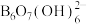 ],其结构如下图所示。其中硼原子的杂化方式为
],其结构如下图所示。其中硼原子的杂化方式为
(4)金属硼氢化物可用作储氢材料。如图是一种金属硼氢化物氨合物的晶体结构示意图。图中八面体的中心代表金属M原子,顶点代表氨分子;四面体的中心代表硼原子,顶点代表氢原子。该晶体属立方晶系,晶胞棱边夹角均为90,棱长为apm,密度为3
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
①该晶体的化学式为
②金属M原子与硼原子间最短距离为
③金属M的相对原子质量为
更新时间:2022-04-01 16:27:44
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为_______ ,基态铝原子比基态镁原子的第一电离能小,其原因是_______ 。
(2)通常情况下, 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,同时还生成
受热分解制得,同时还生成 和氨气,请写出该反应的化学方程式:
和氨气,请写出该反应的化学方程式:_______ 。(方程式一定要标明反应条件“ ”和生成物状态“↑”)
”和生成物状态“↑”)
(3) 具有较高的熔点
具有较高的熔点 ,属于
,属于_______ (填“分子”或“离子”)晶体。
(4) 在水溶液中实际上是以
在水溶液中实际上是以 的形式存在。其中
的形式存在。其中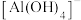 为配离子,
为配离子, 原子的杂化方式为
原子的杂化方式为_______ (填“ 或者
或者 ”))杂化,该阴离子中存在的化学键有
”))杂化,该阴离子中存在的化学键有_______ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石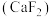 晶体的晶胞如图所示,已知立方体边长为
晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)通常情况下,
 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,同时还生成
受热分解制得,同时还生成 和氨气,请写出该反应的化学方程式:
和氨气,请写出该反应的化学方程式: ”和生成物状态“↑”)
”和生成物状态“↑”)(3)
 具有较高的熔点
具有较高的熔点 ,属于
,属于(4)
 在水溶液中实际上是以
在水溶液中实际上是以 的形式存在。其中
的形式存在。其中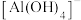 为配离子,
为配离子, 原子的杂化方式为
原子的杂化方式为 或者
或者 ”))杂化,该阴离子中存在的化学键有
”))杂化,该阴离子中存在的化学键有A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石
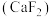 晶体的晶胞如图所示,已知立方体边长为
晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。
(列出计算式)。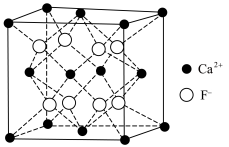
您最近一年使用:0次
【推荐2】软锰矿的主要成分MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如图
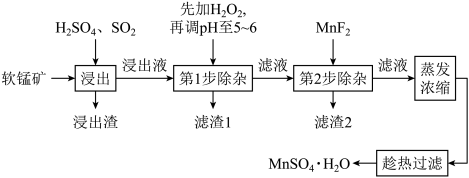
已知:部分金属阳离子完全沉淀时的pH如下表
(1)Mn的价层电子排布式为_______ 。
(2)“浸出”过程中MnO2转化为Mn2+的离子方程式为_______ 。
(3)第1步除杂中H2O2涉及的离子方程式_______ ;形成滤渣1的主要成分为_______ (填化学式),调pH至5~6所加的试剂,可选择_______ (填字母)。
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:_______ ,该反应的平衡常数为_______ (结果保留一位小数)(已知:MnF2的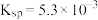 ;CaF2的
;CaF2的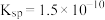 ;MgF2的
;MgF2的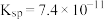 。)
。)
(5)取少量MnSO4∙H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是_______ (用离子方程式表示)。

已知:部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
(1)Mn的价层电子排布式为
(2)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(3)第1步除杂中H2O2涉及的离子方程式
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:
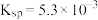 ;CaF2的
;CaF2的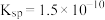 ;MgF2的
;MgF2的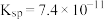 。)
。)(5)取少量MnSO4∙H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】一种新型钙钛矿太阳能电池具有较高的能量转化率,其组成有多种,主要由 、
、 、
、 、
、 ,
, 、
、 、
、 等离子中的某几种组成。
等离子中的某几种组成。

(1) 中运动在能量最高的能级上的电子自旋方向有
中运动在能量最高的能级上的电子自旋方向有_____ 种;氮与左右相邻的两种元素第一电离能由大到小的顺序为_______ 。
(2)基态铁原子的核外电子排布式为________ ,铅元素的电子由________  填“激发态”或“基态”
填“激发态”或“基态” 跃迁到另一状态时会产生绿色的焰色反应。
跃迁到另一状态时会产生绿色的焰色反应。
(3) 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为_______ ,以N原子为中心的几个微粒的空间构型为_________ ,该离子中 键之间的键角
键之间的键角________  中
中 间键角
间键角 填“
填“ ”或“
”或“ ”
” 。
。
(4)常温下, 、
、 、
、 分别为气体、液体、固体。则
分别为气体、液体、固体。则 的晶体类型为
的晶体类型为_________ ,从结构角度解释上述三种物质状态的变化:___________________________ 。
(5)某钙钛矿太阳能电池材料的晶胞如图所示,其晶胞参数为 、密度为
、密度为 。
。

则该晶体中
_________ ,该晶体的摩尔质量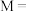
_____  (用含d、
(用含d、 等符号的式子表示,用
等符号的式子表示,用 表示阿伏加 德罗常数的值)。
表示阿伏加 德罗常数的值)。
 、
、 、
、 、
、 ,
, 、
、 、
、 等离子中的某几种组成。
等离子中的某几种组成。 
(1)
 中运动在能量最高的能级上的电子自旋方向有
中运动在能量最高的能级上的电子自旋方向有(2)基态铁原子的核外电子排布式为
 填“激发态”或“基态”
填“激发态”或“基态” 跃迁到另一状态时会产生绿色的焰色反应。
跃迁到另一状态时会产生绿色的焰色反应。(3)
 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为 键之间的键角
键之间的键角 中
中 间键角
间键角 填“
填“ ”或“
”或“ ”
” 。
。(4)常温下,
 、
、 、
、 分别为气体、液体、固体。则
分别为气体、液体、固体。则 的晶体类型为
的晶体类型为(5)某钙钛矿太阳能电池材料的晶胞如图所示,其晶胞参数为
 、密度为
、密度为 。
。 
则该晶体中

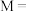
 (用含d、
(用含d、 等符号的式子表示,用
等符号的式子表示,用 表示阿伏加 德罗常数的值)。
表示阿伏加 德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】物质结构决定物质性质。回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________ (填元素符号),其中C原子的核外电子排布式为__________ 。
(2)单质A有两种同素异形体,其中沸点高的是__________ (填分子式);B的氢化物所属的晶体类型为_________ 。

(3)化合物D2A的立体构型为________ 中心原子的杂化轨道类型为_______ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______ :列式计算晶体F的密度(g.cm-3)___________ 。
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是

(3)化合物D2A的立体构型为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)基态铜原子价电子排布式为_______ 。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)_______ I2(Cu) (填“>”“<”或“=”),并解释有关原因_______ 。
(2) 的空间构型为
的空间构型为_______ 。
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是_______ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为_______ 。
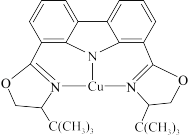
(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
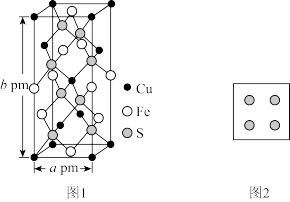
①Fe3+周围距离最近的S2-的个数为_______ 。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为_______ mol-1(用a、b、ρ表示,并化成最简)。
(1)基态铜原子价电子排布式为
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐3】已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与p电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为___________ ,E在___________ 区。
(2)A、B、C的电负性大小顺序(填元素符号,下同)___________ ,第一电离能大小顺序为___________ 。
(3)D的核外电子排布式为___________ ,价电子排布图为___________ 。
(1)基态E原子的价电子排布式为
(2)A、B、C的电负性大小顺序(填元素符号,下同)
(3)D的核外电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】磷、碳、氢等非金属及其化合物用途广泛。试回答下列问题。
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为___________ 。
②研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为___________ ,产生的阳离子的空间结构为___________ ;N和P都有+5价,但NCl5不存在,从原子结构的角度分析其原因:___________ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为  )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为___________ ,一定在同一平面上的原子有___________ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,___________ 。
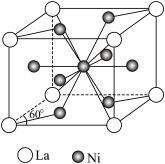
(3)镍镧合金(LaNin)具有很强的储氢能力,其晶胞结构如图所示,其中n=___________ 。 已知晶胞体积为9.0 ×10 -29 m3,若储氢后形成LaNinH5.5(氢进入晶胞空隙,晶胞体积不变),则氢在合金中的密度为___________ g·cm-3(保留1位小数)。
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
②研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为  )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)镍镧合金(LaNin)具有很强的储氢能力,其晶胞结构如图所示,其中n=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】钒(23V)广泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
(1)基态钒原子的价电子排布式为___________ ,与钒同周期的所有元素的基态原子中,未成对电子数最多的是___________ (填元素符号)。
(2)V2O5 溶解在 NaOH 溶液中,可得到钒酸钠(Na3VO4),已知 空间构型与
空间构型与 相同。
相同。
① 中心原子价层孤电子对数目为
中心原子价层孤电子对数目为______ 。
A.0 B.1 C.2 D.3
②短周期元素形成的各微粒中,与 空间构型相同的正离子有
空间构型相同的正离子有______ (任写一种)。
(3)V2O5 常用作 SO2 转化为 SO3 的催化剂。一定条件下,在固定容积的密闭容器中充入 SO2与空气的混合气体,加入一定量 V2O5,反应 t min 后,容器中 SO2 和 SO3 物质的量浓度分别为 a mol·L-1 和 b mol·L-1。
①SO2 起始物质的量浓度为______ mol·L-1(用含 a、b 的代数式表示)。
②这段时间内用 O2 表示的平均化学反应速率为______ mol/(L·min)-1(用含 a、b、t的代数式表示)。
③在未使用催化剂时,SO2 氧化反应的能量变化如图所示。加入 V2O5 后,会使图中______ 。

A.E1 增大、E3 减小 B.E1减小、E2增大
C.E2 减小、E3不变 D.E2减小、E3 增大
(4)用活化后的 V2O5 作催化剂,在有氧条件下氨气将 NO 还原成 N2 的一种反应历程如图所示。
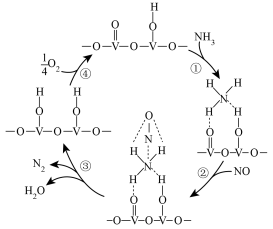
①上述历程中,钒元素被氧化的过程有______ (填序号);写出总反应的化学方程式:___________ 。
②按上述图中 NH3、NO 和 O2 的比例进行催化脱硝反应。反应一定的时间,NH3 和 NO 的转化率与温度的关系如图所示。超过 200℃后,NO 转化率急剧下降,而 NH3 仍维持较高,原因可能是:___________ 。

(1)基态钒原子的价电子排布式为
(2)V2O5 溶解在 NaOH 溶液中,可得到钒酸钠(Na3VO4),已知
 空间构型与
空间构型与 相同。
相同。①
 中心原子价层孤电子对数目为
中心原子价层孤电子对数目为A.0 B.1 C.2 D.3
②短周期元素形成的各微粒中,与
 空间构型相同的正离子有
空间构型相同的正离子有(3)V2O5 常用作 SO2 转化为 SO3 的催化剂。一定条件下,在固定容积的密闭容器中充入 SO2与空气的混合气体,加入一定量 V2O5,反应 t min 后,容器中 SO2 和 SO3 物质的量浓度分别为 a mol·L-1 和 b mol·L-1。
①SO2 起始物质的量浓度为
②这段时间内用 O2 表示的平均化学反应速率为
③在未使用催化剂时,SO2 氧化反应的能量变化如图所示。加入 V2O5 后,会使图中

A.E1 增大、E3 减小 B.E1减小、E2增大
C.E2 减小、E3不变 D.E2减小、E3 增大
(4)用活化后的 V2O5 作催化剂,在有氧条件下氨气将 NO 还原成 N2 的一种反应历程如图所示。

①上述历程中,钒元素被氧化的过程有
②按上述图中 NH3、NO 和 O2 的比例进行催化脱硝反应。反应一定的时间,NH3 和 NO 的转化率与温度的关系如图所示。超过 200℃后,NO 转化率急剧下降,而 NH3 仍维持较高,原因可能是:

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】X、Y、Z、W、Q五种元素的原子序数依次增大且分别位于周期表的二、三、四周期,X和Y的原子序数相差1,基态Y原子中有3个未成对电子:基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素;Q位于周期表的第12列。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。
(2)基态X 原子的价层电子排布图为____________ 。基态W原子中有___________ 对自旋方向相反的电子。
(3)基态Y原子和基态Z原子的第一电离能:Y___________ (填“>”或“<")Z。
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为__________ (填分子式)。
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为__________ ;其酸根离子的空间构型为______ 。
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为_______________ 。
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为_____________ 。若晶体密度为ρg·cm-1,阿伏伽德罗常数的值为NA,则晶胞参数为____________ nm(用含ρ、NA的代数式表示)。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)基态X 原子的价层电子排布图为
(3)基态Y原子和基态Z原子的第一电离能:Y
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】过渡金属及其化合物在生产、生活中有重要的应用。回答下列问题:
(1)基态 的价电子轨道表达式为
的价电子轨道表达式为_______ 。
(2)一种含 的催化剂
的催化剂 能催化乙烯、丙烯等的聚合,其结构如图甲所示。
能催化乙烯、丙烯等的聚合,其结构如图甲所示。 中,
中, 原子的杂化类型有
原子的杂化类型有_______ , 中含有的作用力类型有
中含有的作用力类型有_______ (填序号),非金属元素电负性由大到小的顺序为_______ 。
A.π键 B. 氢键 C. 配位键 D.σ键 E. 离子键

(3)分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数。
键的电子数。 离子由
离子由 、
、 、
、 三种元素组成,其结构如图乙所示,则
三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为_______ 。
(4) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为_______ 。
(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图。

① 周围距离最近的
周围距离最近的 数为
数为_______ 。
②黄铜矿炼铜过程中会产生硫的氧化物废气,其中 分子空间构型为
分子空间构型为_______ ,与 互为等电子体的阴离子有
互为等电子体的阴离子有_______ (写一种即可)。
③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设 为阿伏加德罗常数的值,请计算该晶体的密度
为阿伏加德罗常数的值,请计算该晶体的密度
_______  。
。
(1)基态
 的价电子轨道表达式为
的价电子轨道表达式为(2)一种含
 的催化剂
的催化剂 能催化乙烯、丙烯等的聚合,其结构如图甲所示。
能催化乙烯、丙烯等的聚合,其结构如图甲所示。 中,
中, 原子的杂化类型有
原子的杂化类型有 中含有的作用力类型有
中含有的作用力类型有A.π键 B. 氢键 C. 配位键 D.σ键 E. 离子键

(3)分子中的大
 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数。
键的电子数。 离子由
离子由 、
、 、
、 三种元素组成,其结构如图乙所示,则
三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为(4)
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图。

①
 周围距离最近的
周围距离最近的 数为
数为②黄铜矿炼铜过程中会产生硫的氧化物废气,其中
 分子空间构型为
分子空间构型为 互为等电子体的阴离子有
互为等电子体的阴离子有③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设
 为阿伏加德罗常数的值,请计算该晶体的密度
为阿伏加德罗常数的值,请计算该晶体的密度
 。
。
您最近一年使用:0次
【推荐2】N、Cu等元素的化合物在工农业生产中有着广泛的应用。
(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为___ 。
(2) 存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为
存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为___ ;___ 。
(3)基态Cu2+价电子的空间运动状态有___ 种。
(4)Cu元素与Br元素形成的化合物的晶胞结构如图所示,该晶胞沿z轴在平面的投影图中,Cu原子构成的几何图形是___ ,若晶胞的密度为dg·cm-3,则Cu原子与Br原子之间的最短距离为___ μm(列出计算式即可,NA表示阿伏加德罗常数的值)。

(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为
A.1s22s22p 2p 2p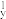 2p 2p | B.1s22s22p 2p 2p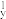 3s1 3s1 |
C.1s22s22p 2p 2p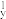 | D.1s22s22p 3s1 3s1 |
 存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为
存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为(3)基态Cu2+价电子的空间运动状态有
(4)Cu元素与Br元素形成的化合物的晶胞结构如图所示,该晶胞沿z轴在平面的投影图中,Cu原子构成的几何图形是

您最近一年使用:0次
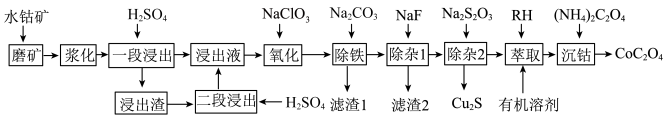
【推荐3】钴广泛用于航空、航天、机械制造、电气仪表等领域,被誉为战略物资。某水钴矿中,Co以+2、+3价的氧化物和氢氧化物存在,还含有NiO、CuO及Fe、Mg、Ca的氧化物等杂质。采用以下工艺流程可从钴矿石中制备 。
。
已知:①酸性介质中氧化性:Co(Ⅲ)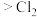
②RH为有机物,可用RH、有机溶剂萃取出溶液中的
③ 、
、
按要求回答下列问题:
(1)基态 与
与 中未成对的电子数之比为
中未成对的电子数之比为___________ 。
(2)“二段浸出”的目的是___________ 。
(3)不用盐酸浸出水钴矿中的钴的主要原因是___________ 。
(4) 的作用是将浸出液中的
的作用是将浸出液中的 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(5)“除铁”中加入适量的 调节pH,同时可获得较为纯净的黄钠铁矾
调节pH,同时可获得较为纯净的黄钠铁矾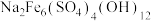 沉淀,写出该反应的化学方程式:
沉淀,写出该反应的化学方程式:___________ ,pH常控制在4.0~4.5之间的原因是___________ 。
(6)“除杂1”所得滤液中若 ,则
,则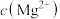 为
为___________ 。
(7)利用 制备的
制备的 可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,若该立方晶胞参数为apm,设
可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,若该立方晶胞参数为apm,设 为阿伏加德罗常数的值,该钛酸钴晶体的密度为
为阿伏加德罗常数的值,该钛酸钴晶体的密度为___________  (列出计算式)。
(列出计算式)。

 。
。
已知:①酸性介质中氧化性:Co(Ⅲ)
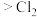
②RH为有机物,可用RH、有机溶剂萃取出溶液中的

③
 、
、
按要求回答下列问题:
(1)基态
 与
与 中未成对的电子数之比为
中未成对的电子数之比为(2)“二段浸出”的目的是
(3)不用盐酸浸出水钴矿中的钴的主要原因是
(4)
 的作用是将浸出液中的
的作用是将浸出液中的 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为(5)“除铁”中加入适量的
 调节pH,同时可获得较为纯净的黄钠铁矾
调节pH,同时可获得较为纯净的黄钠铁矾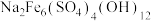 沉淀,写出该反应的化学方程式:
沉淀,写出该反应的化学方程式:(6)“除杂1”所得滤液中若
 ,则
,则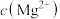 为
为(7)利用
 制备的
制备的 可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,若该立方晶胞参数为apm,设
可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,若该立方晶胞参数为apm,设 为阿伏加德罗常数的值,该钛酸钴晶体的密度为
为阿伏加德罗常数的值,该钛酸钴晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



