氮、磷、氯、溴、铁、铜等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。LiFePO4是新型锂离子电池的电极材料,可利用FeCl3、NH4H2PO4、LiC1和苯胺(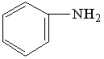 )等原料来制备。回答下列问题。
)等原料来制备。回答下列问题。
(1)铁元素在元素周期表中的位置为___________ ,基态Fe2+的价层电子排布图(轨道表达式)为___________ 。
(2)NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是___________ (填元素符号),P原子的杂化类型为___________ 。
(3)苯胺和甲苯相对分子质量接近,但苯胺熔点明显比甲苯的高,原因是___________ 。
(4)红磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为___________ 。研究发现固态PCl5和PBr5的结构分别为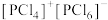 和
和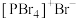 ,则它们的晶体类型为
,则它们的晶体类型为___________ 。
(5)已知NH3分子中H—N—H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H—N—H的键角___________ 107.3°(填“大于”“小于”“等于”)。
(6)铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构以及各原子的投影位置如图所示。
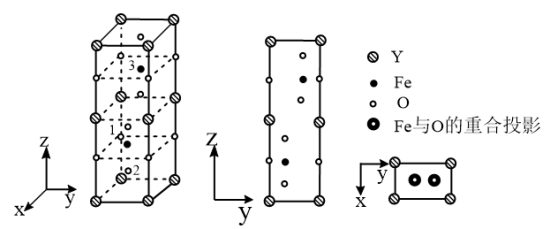
已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, −m,
−m, −n),则3号Fe原子的空间坐标为
−n),则3号Fe原子的空间坐标为___________ ,若晶胞参数分别为apm、bpm和cpm,阿伏加德罗常数的值用NA表示,则该晶体的密度为___________ g·cm−3(列出表达式)。
 )等原料来制备。回答下列问题。
)等原料来制备。回答下列问题。(1)铁元素在元素周期表中的位置为
(2)NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是
(3)苯胺和甲苯相对分子质量接近,但苯胺熔点明显比甲苯的高,原因是
(4)红磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为
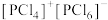 和
和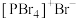 ,则它们的晶体类型为
,则它们的晶体类型为(5)已知NH3分子中H—N—H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H—N—H的键角
(6)铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构以及各原子的投影位置如图所示。

已知1号O原子空间坐标为(0,0,
 ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, −m,
−m, −n),则3号Fe原子的空间坐标为
−n),则3号Fe原子的空间坐标为
更新时间:2022-03-22 21:30:46
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】高纯度的氢氟酸是制造芯片的重要原料之一。
(1)氟原子激发态的电子排布式有_____ (选填编号,下同),其中能量较高的是_____ 。
A.1s22s22p43s1 B.1s22s22p43d2 C.1s22s12p5 D.1s22s22p33p2
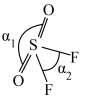
SO2F2的分子结构如图所示,键角α1>α2的主要原因是______ 。
(2)HF无论是气态还是在水溶液中均可二聚形成(HF)2。HF能二聚的原因是_____ ,写出(HF)2发生第二步电离的电离方程式:_____ 。
(3)已知:HF(aq) H+(aq)+F-(aq) △H=-10.4kJ•mol-1
H+(aq)+F-(aq) △H=-10.4kJ•mol-1
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1
则HF(aq)+NaOH(aq)=NaF(aq)+H2O(l)的△H=______ kJ•mol-1。
如图为恒温、带有可自由移动隔板的刚性容器。当两边分别充入4g氦气和20g单分子态的HF气体时,隔板位于“5”处,隔板两边容器内的压强均为100kPa。

若固定隔板位于“5”处,当右侧容器内反应2HF(g) (HF)2(g)达到平衡状态时,右侧容器内压强为p1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器压强为p2。
(HF)2(g)达到平衡状态时,右侧容器内压强为p1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器压强为p2。
(4)p1_____ p2(选填“A:>”“B:<”或“C:=”)。该温度下,2HF(g) (HF)2(g)反应的平衡常数Kp=
(HF)2(g)反应的平衡常数Kp=_____ kPa-1。
(5)若将上述容器改为绝热容器,固定隔板在“5”处,下列不能说明右侧容器内反应已达平衡状态的是____ (选填编号)。
A.容器右侧气体的密度不再改变
B.容器右侧的温度不再改变
C.容器右侧气体的压强不再改变
D.容器右侧气体的平均相对分子质量不再改变
E.2v(HF)正=v[(HF)2]逆
某温度下,将分析浓度(总浓度)相同的HCl、HF和CH3COOH三种溶液,分别加水稀释时,溶液pH变化如图所示。图中,氢氟酸溶液在稀释初期的pH上升较快。

(6)据此判断,(HF)2与HF的酸性相比,较强的是_____ [选填“A:(HF)2”或“B:HF”]。
(7)NaF和HF的混合液具有一定的缓冲能力,即加入少量的酸或碱时,溶液的pH基本保持不变。用电离平衡理论解释NaF和HF混合液具有一定缓冲能力的原因______ 。
(1)氟原子激发态的电子排布式有
A.1s22s22p43s1 B.1s22s22p43d2 C.1s22s12p5 D.1s22s22p33p2
SO2F2的分子结构如图所示,键角α1>α2的主要原因是

(2)HF无论是气态还是在水溶液中均可二聚形成(HF)2。HF能二聚的原因是
(3)已知:HF(aq)
 H+(aq)+F-(aq) △H=-10.4kJ•mol-1
H+(aq)+F-(aq) △H=-10.4kJ•mol-1H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1
则HF(aq)+NaOH(aq)=NaF(aq)+H2O(l)的△H=
如图为恒温、带有可自由移动隔板的刚性容器。当两边分别充入4g氦气和20g单分子态的HF气体时,隔板位于“5”处,隔板两边容器内的压强均为100kPa。

若固定隔板位于“5”处,当右侧容器内反应2HF(g)
 (HF)2(g)达到平衡状态时,右侧容器内压强为p1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器压强为p2。
(HF)2(g)达到平衡状态时,右侧容器内压强为p1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器压强为p2。(4)p1
 (HF)2(g)反应的平衡常数Kp=
(HF)2(g)反应的平衡常数Kp=(5)若将上述容器改为绝热容器,固定隔板在“5”处,下列不能说明右侧容器内反应已达平衡状态的是
A.容器右侧气体的密度不再改变
B.容器右侧的温度不再改变
C.容器右侧气体的压强不再改变
D.容器右侧气体的平均相对分子质量不再改变
E.2v(HF)正=v[(HF)2]逆
某温度下,将分析浓度(总浓度)相同的HCl、HF和CH3COOH三种溶液,分别加水稀释时,溶液pH变化如图所示。图中,氢氟酸溶液在稀释初期的pH上升较快。

(6)据此判断,(HF)2与HF的酸性相比,较强的是
(7)NaF和HF的混合液具有一定的缓冲能力,即加入少量的酸或碱时,溶液的pH基本保持不变。用电离平衡理论解释NaF和HF混合液具有一定缓冲能力的原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】锂离子电池是近年来的研究热点,常见的锂离子聚合物电池材料有石墨、LiAsF6、LiPF6、LiMn2O4等。回答下列问题:
(1)As的最高能级组的电子排布式为_______ ,Li、O、P、As四种元素电负性由大到小的顺序为_______ (填元素符号)。
(2)LiPF6的阴离子的空间构型为_______ 。
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺( )制得。三聚氰胺分子中氮原子杂化类型是
)制得。三聚氰胺分子中氮原子杂化类型是_______ ;三聚氰胺分子不溶于冷水,溶于热水,主要原因是_______ 。
(4)尖晶石结构的LiMn2O4是一种常用的正极材料。已知一种LiMn2O4晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“○”表示O2−。
 ①“●”表示的微粒是
①“●”表示的微粒是_______ (填元素符号)
②若该晶胞的晶胞参数为apm,设NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(列出计算表达式,不必化简)
(1)As的最高能级组的电子排布式为
(2)LiPF6的阴离子的空间构型为
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺(
 )制得。三聚氰胺分子中氮原子杂化类型是
)制得。三聚氰胺分子中氮原子杂化类型是(4)尖晶石结构的LiMn2O4是一种常用的正极材料。已知一种LiMn2O4晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“○”表示O2−。
 ①“●”表示的微粒是
①“●”表示的微粒是②若该晶胞的晶胞参数为apm,设NA为阿伏加德罗常数的值,该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D、E为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素原子的价电子数是其余电子数的一半。
(1)A、C、D的第一电离能由大到小的顺序为____________ (用元素符号表示),E2+的基态电子排布式为_________ 。
(2)B、D形成的化合物中属于非极性分子的是______ (填化学式),该分子中心原子的杂化类型是_____________ 。
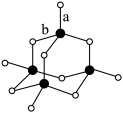
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为___________________ (填图2中字母a或b),1mol该分子中含有的σ键数目为_______ 。
(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为________ 晶体(填晶体类型)。
②E2(CO)8晶体中存在的作用力有______________________ 。
(1)A、C、D的第一电离能由大到小的顺序为
(2)B、D形成的化合物中属于非极性分子的是
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为

(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为
②E2(CO)8晶体中存在的作用力有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子排布式为_________________ 。钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是______________ ,VO43-的立体构型为__________ 。
(2)2-巯基烟酸氧钒配合物(图1) 是副作用较小的有效调节血糖的新型药物。

①该药物中N 原子的杂化方式是____________ ,其所含第二周期元素第一电离能按由大到小顺序的排列是__________________ 。
②2-巯基烟酸(图2)水溶性优于2-巯基烟酸氧钒配合物的原因是_________________________________ 。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________ 。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,图4 为该晶胞的俯视图,该晶胞的密度为________________ g·cm-3 (列出计算式即可)。

(1)基态钒原子的外围电子排布式为
(2)2-巯基烟酸氧钒配合物(图1) 是副作用较小的有效调节血糖的新型药物。

①该药物中N 原子的杂化方式是
②2-巯基烟酸(图2)水溶性优于2-巯基烟酸氧钒配合物的原因是
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,图4 为该晶胞的俯视图,该晶胞的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】按要求回答下列问题:
(1)基态Cl原子含有_______ 种空间运动状态不同的电子: ClO VSEPR模型为
VSEPR模型为_______ ;
(2)甲醇(CH3OH)的沸点_______ 甲醛(HCHO) 的沸点(填“>”或“<”或“=”);
(3)已知(CN)2有对称性,且各原子均达到8电子稳定结构,则(CN)2分子中π键与σ键的个数比为_______ ;
(4)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是_______;
(5)比较基态铁原子与基态钴原子的第四电离能,I4 (Fe)_______ I4 (Co)(填“>”或“<”或“=”),原因是_______ 。
(6)已知P4O6与P4O10的结构如图,则P4O6中的∠O-P-O_______ P4O10中的∠O-P-O(填“>”或“<”或“=”);

(7)吡啶(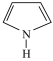 )分子为平面构型,则N原子的杂化类型为
)分子为平面构型,则N原子的杂化类型为_______ ,lmol吡啶分子中所含的σ键数目为_______ NA;
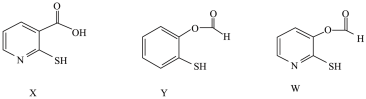
(8)X、Y、W三种物质(结构如图)在水中的溶解性由大到小的顺序为_______ ;
(9)氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因是_______ 。
(10)如图所示为PTC元件(热敏电阻)的主要成分BaTiO3晶体的晶胞,该晶胞为立方体,该晶体密度为dg·cm-3,顶点位置为Ti4+所占,立方体中心位置为Ba2+所占,所有棱心位置为O2-所占。
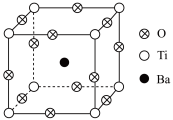
①在Ti4+周围与它最近的且距离相等的Ba2+有_______ 个:
②在该晶胞结构的另一种表示中,若Ti4+处于晶胞体心位置,则O2-处于_______ 位置,
③已知阿伏加德罗常数的值为NA,BaTiO3的相对分子质量为M,求该晶胞的晶胞参数为_______ pm(列出计算式即可)。
(1)基态Cl原子含有
 VSEPR模型为
VSEPR模型为(2)甲醇(CH3OH)的沸点
(3)已知(CN)2有对称性,且各原子均达到8电子稳定结构,则(CN)2分子中π键与σ键的个数比为
(4)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是_______;
A.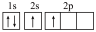 | B.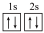 | C.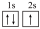 | D.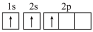 |
(6)已知P4O6与P4O10的结构如图,则P4O6中的∠O-P-O

(7)吡啶(
 )分子为平面构型,则N原子的杂化类型为
)分子为平面构型,则N原子的杂化类型为(8)X、Y、W三种物质(结构如图)在水中的溶解性由大到小的顺序为

(9)氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因是
(10)如图所示为PTC元件(热敏电阻)的主要成分BaTiO3晶体的晶胞,该晶胞为立方体,该晶体密度为dg·cm-3,顶点位置为Ti4+所占,立方体中心位置为Ba2+所占,所有棱心位置为O2-所占。

①在Ti4+周围与它最近的且距离相等的Ba2+有
②在该晶胞结构的另一种表示中,若Ti4+处于晶胞体心位置,则O2-处于
③已知阿伏加德罗常数的值为NA,BaTiO3的相对分子质量为M,求该晶胞的晶胞参数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】硅、磷、硫、氯都是第三周期的非金属元素,它们在工农业生产中都有重要的用途。
(1)基态硅原子的电子排布图为_______________ ;硫的基态原子能量最高的电子云在空间有________________ 个伸展方向,原子轨道呈________________ 形。
(2)硅、磷、硫的第一电离能由大到小的顺序为________________ 。
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为________________ ,其分子的空间构型为________________ 。
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为__________ ;PO43-作为___________ 为Fe3+提供________________ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏伽德罗常数的值,则磷化硼晶体的密度为_________ g/cm3。

(1)基态硅原子的电子排布图为
(2)硅、磷、硫的第一电离能由大到小的顺序为
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏伽德罗常数的值,则磷化硼晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】非金属元素及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)As4S4俗称雄黄,其中基态砷原子外围电子排布式为___________ 。
(2)HOCH2CN分子中含有的σ键与π键数目之比为___________ ,该化合物中处于同周期的元素中第一电离能由大到小的顺序为:___________
(3)三硝基胺N(NO2)3(其结构为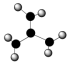 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为___________ ,并且与三个硝基中的N构成___________ 形。
(4)甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是___________ 。
(5)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是___________ 。[Cu(NH3)4]2+中2个NH3被2个H2O取代,得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是___________ 。
(6)某立方磷青铜晶体的晶胞结构如图所示。
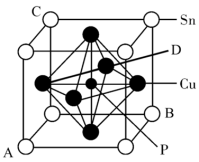
①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为___________ 。
②若晶体密度为ρg/cm-3,最近的Cu原子核间距为___________ pm(用含ρ、NA的代数式表示)。
(1)As4S4俗称雄黄,其中基态砷原子外围电子排布式为
(2)HOCH2CN分子中含有的σ键与π键数目之比为
(3)三硝基胺N(NO2)3(其结构为
 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为(4)甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
(5)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是
(6)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为
②若晶体密度为ρg/cm-3,最近的Cu原子核间距为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】热电材料可实现热能和电能的直接相互转换,我国科学家以 铬掺杂的硒化铅
铬掺杂的硒化铅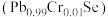 作为研究对象,改写了室温热电优值记录。回答下列问题:
作为研究对象,改写了室温热电优值记录。回答下列问题:
(1)Cr元素属于元素周期表的_______ 区,其基态原子的价层电子排布式为_______ 。
(2)铅(Pb)在元素周期表中位于第六周期,与碳同族,则电负性Pb_______ Se(填“>”、“<”或“=”)
(3) 分子中
分子中 的杂化轨道类型为
的杂化轨道类型为_______ , 可溶于水,而
可溶于水,而 难溶于水,原因是
难溶于水,原因是_______ 。
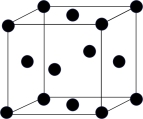
(4)金属 的晶胞结构示意图如下,其晶胞参数为
的晶胞结构示意图如下,其晶胞参数为 ,列式计算该晶胞的空间利用率为
,列式计算该晶胞的空间利用率为_______ (列出计算式即可,不必化简)
(5)火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,如同结晶一般,称为“岩浆晶出”。实验证明,岩浆晶出的次序与晶格能的大小有关,如下面两种氧化物:
则 和
和 两种矿物,晶出次序优先的物质是
两种矿物,晶出次序优先的物质是_______ ,原因为_______ 。
(6) 具有
具有 型的晶体结构,其晶体结构如下图所示,晶胞中
型的晶体结构,其晶体结构如下图所示,晶胞中 的配位数为
的配位数为_______ ,若晶胞密度为 ,则两个
,则两个 之间的最短距离为
之间的最短距离为_______ nm(列出计算式,设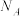 为阿伏加德罗常数值)。
为阿伏加德罗常数值)。

 铬掺杂的硒化铅
铬掺杂的硒化铅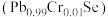 作为研究对象,改写了室温热电优值记录。回答下列问题:
作为研究对象,改写了室温热电优值记录。回答下列问题:(1)Cr元素属于元素周期表的
(2)铅(Pb)在元素周期表中位于第六周期,与碳同族,则电负性Pb
(3)
 分子中
分子中 的杂化轨道类型为
的杂化轨道类型为 可溶于水,而
可溶于水,而 难溶于水,原因是
难溶于水,原因是(4)金属
 的晶胞结构示意图如下,其晶胞参数为
的晶胞结构示意图如下,其晶胞参数为 ,列式计算该晶胞的空间利用率为
,列式计算该晶胞的空间利用率为
(5)火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,如同结晶一般,称为“岩浆晶出”。实验证明,岩浆晶出的次序与晶格能的大小有关,如下面两种氧化物:
| 氧化物 | 晶格能 | 晶出次序 |
 | 3401 | 先 |
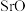 | 3223 | 后 |
则
 和
和 两种矿物,晶出次序优先的物质是
两种矿物,晶出次序优先的物质是(6)
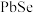 具有
具有 型的晶体结构,其晶体结构如下图所示,晶胞中
型的晶体结构,其晶体结构如下图所示,晶胞中 的配位数为
的配位数为 ,则两个
,则两个 之间的最短距离为
之间的最短距离为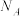 为阿伏加德罗常数值)。
为阿伏加德罗常数值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】嫦娥五号带回的月球土壤中可能存在金、银、铜、铁、锌、铼等元素。
(1)铼位于第六周期,与锰属于同一副族。类比锰,写出基态铼(Re)原子的价层电子排布式:_____ 。
(2)Cu、 位于元素周期表的
位于元素周期表的_____ 区,第二电离能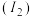 :
: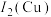
_____ 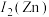 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是_____ 。
(3)甘氨酸亚铁络合物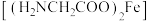 是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
① 中含有第二周期元素的第一电离能由大到小的顺序为
中含有第二周期元素的第一电离能由大到小的顺序为_____ (用元素符号表示),碳原子的杂化类型为_____ 。
②甘氨酸 的沸点比相同相对分子质量的烷烃大很多,原因是
的沸点比相同相对分子质量的烷烃大很多,原因是_____ 。
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图所示,则分子内的作用力不可能含有_____ (填序号)。
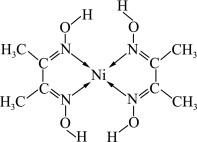
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
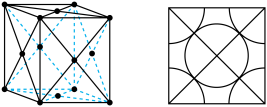
(5)铜为面心立方最密堆积的金属,其晶胞结构如图所示,已知铜原子的半径为 ,则铜晶体的密度
,则铜晶体的密度
_____  (只需列出计算式)。
(只需列出计算式)。
(1)铼位于第六周期,与锰属于同一副族。类比锰,写出基态铼(Re)原子的价层电子排布式:
(2)Cu、
 位于元素周期表的
位于元素周期表的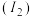 :
: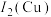
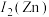 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是(3)甘氨酸亚铁络合物
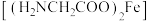 是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。①
 中含有第二周期元素的第一电离能由大到小的顺序为
中含有第二周期元素的第一电离能由大到小的顺序为②甘氨酸
 的沸点比相同相对分子质量的烷烃大很多,原因是
的沸点比相同相对分子质量的烷烃大很多,原因是(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图所示,则分子内的作用力不可能含有

A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)铜为面心立方最密堆积的金属,其晶胞结构如图所示,已知铜原子的半径为
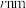 ,则铜晶体的密度
,则铜晶体的密度
 (只需列出计算式)。
(只需列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】高温超导材料广泛应用于超导输电、超导计算机、磁悬浮列车和热核聚变反应堆等。将 、
、 和
和 混合在高温下反应可制得新型节能高温超导体钇钡铜氧(其中Y显+3价,Cu显+2、+3价)。
混合在高温下反应可制得新型节能高温超导体钇钡铜氧(其中Y显+3价,Cu显+2、+3价)。
回答下列问题:
(1)Y(钇)是一种重要的稀土金属元素,与Sc(钪)同族相邻,则Y元索在元素同族相邻,则Y元素在元素周期表中的位置为___________ 。
(2)根据元素原子外围电子排布特征,可将周期表分成五个区域,其中O元素属于___________ 区,基态O原子电子占据最高能级的电子云轮廊图为___________ 形。
(3)基态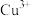 离子价层电子的电子排布图(轨道表示式)为
离子价层电子的电子排布图(轨道表示式)为___________ 。
(4)与 形成配合物的分子或离子应具备的结构特征是
形成配合物的分子或离子应具备的结构特征是___________ 。 中配位体的立体构型为
中配位体的立体构型为___________ 形,铜有两种氧化物 和
和 ,后者比前者的热稳定性强,原因是
,后者比前者的热稳定性强,原因是___________ 。
(5)在 中,C原子采用
中,C原子采用___________ 杂化,第一电离能:C___________ O(填“>”或“<”) 、
、 、
、 受热分解分别生成
受热分解分别生成 、
、 、
、 其中
其中 、
、 、
、 熔点较高的是
熔点较高的是___________ (填化学式)。
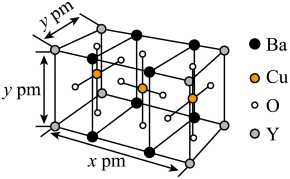
(6)钇钡铜氧的晶胞结构如图,根据晶胞结构确定其化学式为___________ ,若该晶体摩尔质量为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶体密度为
,则晶体密度为___________  。
。
 、
、 和
和 混合在高温下反应可制得新型节能高温超导体钇钡铜氧(其中Y显+3价,Cu显+2、+3价)。
混合在高温下反应可制得新型节能高温超导体钇钡铜氧(其中Y显+3价,Cu显+2、+3价)。回答下列问题:
(1)Y(钇)是一种重要的稀土金属元素,与Sc(钪)同族相邻,则Y元索在元素同族相邻,则Y元素在元素周期表中的位置为
(2)根据元素原子外围电子排布特征,可将周期表分成五个区域,其中O元素属于
(3)基态
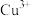 离子价层电子的电子排布图(轨道表示式)为
离子价层电子的电子排布图(轨道表示式)为(4)与
 形成配合物的分子或离子应具备的结构特征是
形成配合物的分子或离子应具备的结构特征是 中配位体的立体构型为
中配位体的立体构型为 和
和 ,后者比前者的热稳定性强,原因是
,后者比前者的热稳定性强,原因是(5)在
 中,C原子采用
中,C原子采用 、
、 、
、 受热分解分别生成
受热分解分别生成 、
、 、
、 其中
其中 、
、 、
、 熔点较高的是
熔点较高的是(6)钇钡铜氧的晶胞结构如图,根据晶胞结构确定其化学式为
 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶体密度为
,则晶体密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】CuInSe2晶体具有优良的光学特性,是当今光电转换领域的研究热点和太阳能电池吸收层的理想材料。回答下列问题:
(1)硒(Se)是人体内必需的微量元素之一、基态Se原子的电子排布式为[Ar]___________ 。H2O、H2S和H2Se的沸点由低到高的顺序为___________ (填化学式,下同),还原性由弱到强的顺序为___________ ,键角由小到大的顺序为___________ 。SeF2分子存在角形和直线形两种异构体,其中直线形分子的键长较长,___________ 分子的能量较大。
(2)铟(In)为ⅢA族元素,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是___________ 。在乙醚中InCl3和LiH反应生成LiInH4,LiInH4中阴离子的空间结构为___________ 。
(3)四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=a pm,c=c pm,α=β=γ=90°。设阿伏加德罗常数的值为NA,CuInSe2的相对质量为M,则该晶体密度ρ=___________ g·cm-3(用含有a、c、M和NA的代数式表示)。该晶胞中,原子坐标分别为1号Se原子___________ ,2号Cu原子(0,0.5,0.25),3号In原子(0,0.5,0.75)。晶体中有___________ 个Se原子距离4号Cu原子最近。

(1)硒(Se)是人体内必需的微量元素之一、基态Se原子的电子排布式为[Ar]
(2)铟(In)为ⅢA族元素,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是
(3)四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=a pm,c=c pm,α=β=γ=90°。设阿伏加德罗常数的值为NA,CuInSe2的相对质量为M,则该晶体密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,外围电子占用___________ 个原子轨道;雌黄分子式为 ,分子结构如图,则砷原子的杂化方式为
,分子结构如图,则砷原子的杂化方式为___________ 。

(2)向 溶液中加入少蛋氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出
溶液中加入少蛋氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出 晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是
晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是___________ (填元素符号),晶体中含有的化学键有___________ 。加入乙醇后析出 晶体的原因是
晶体的原因是___________ 。
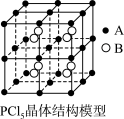
(3)常温下 是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与
是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与 具有相同的空间结构和相似的化学键特征,则A为
具有相同的空间结构和相似的化学键特征,则A为___________ ,B为___________ 。
(4)从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的结构如图。

该磷钇矿的化学式为___________ ,与 互为等电子体的阴离子有
互为等电子体的阴离子有___________ (写出两种离子的化学式)。
(1)基态砷原子中,外围电子占用
 ,分子结构如图,则砷原子的杂化方式为
,分子结构如图,则砷原子的杂化方式为
(2)向
 溶液中加入少蛋氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出
溶液中加入少蛋氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出 晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是
晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是 晶体的原因是
晶体的原因是(3)常温下
 是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与
是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与 具有相同的空间结构和相似的化学键特征,则A为
具有相同的空间结构和相似的化学键特征,则A为
(4)从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的结构如图。

该磷钇矿的化学式为
 互为等电子体的阴离子有
互为等电子体的阴离子有
您最近一年使用:0次



