下列关于工业合成氨: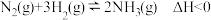 的说法正确的是
的说法正确的是
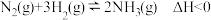 的说法正确的是
的说法正确的是| A.增大氮气的浓度,化学反应速率加快,平衡常数增大 |
| B.该反应达平衡状态后,恒温恒容下充入氦气,则正反应速率增大,逆反应速率减小 |
| C.该反应使用催化剂,加快反应速率的原因是降低了活化能,提高了活化分子百分数 |
| D.该反应中反应物的键能之和大于生成物的键能之和 |
更新时间:2022-05-05 11:49:52
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】科学家已获得极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1 mol N-N键吸收193 kJ热量 ,形成1 mol N≡N叁键放出941 kJ热量,则
| A.N4分子中的N是sp2杂化 | B.N4是极性分子 |
| C.N4和N2互为同分异构体 | D.1 mol N4气体转化为N2时放出724 kJ 能量 |
您最近一年使用:0次
【推荐2】已知某化学反应2B2A(g) A2(g)+2B2(g)(B2A、A2、B2的分子结构分别为B─A─B、A=A、B—B)的能量变化如图所示,下列有关叙述不正确的是
A2(g)+2B2(g)(B2A、A2、B2的分子结构分别为B─A─B、A=A、B—B)的能量变化如图所示,下列有关叙述不正确的是
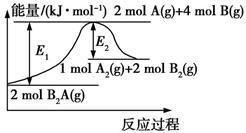
 A2(g)+2B2(g)(B2A、A2、B2的分子结构分别为B─A─B、A=A、B—B)的能量变化如图所示,下列有关叙述不正确的是
A2(g)+2B2(g)(B2A、A2、B2的分子结构分别为B─A─B、A=A、B—B)的能量变化如图所示,下列有关叙述不正确的是
| A.该反应的进行一定需要加热 |
| B.该反应的ΔH=(E1-E2) kJ·mol-1 |
| C.由2 mol A(g)和4 mol B(g)形成1 mol A=A键和2 mol B—B键,放出E2 kJ能量 |
| D.该反应中,反应物的键能总和大于生成物的键能总和 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】以碳酸锰铜矿(主要成分是 和
和 ,含少量
,含少量 )为原料制备
)为原料制备 和
和 的工艺流程如图所示:
的工艺流程如图所示:
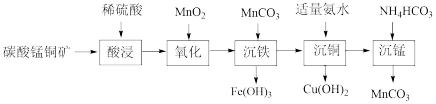
下列叙述正确的是
 和
和 ,含少量
,含少量 )为原料制备
)为原料制备 和
和 的工艺流程如图所示:
的工艺流程如图所示:
下列叙述正确的是
| A.粉碎矿石能增大活化分子百分数 | B.“酸浸”后的溶液中只含3种阳离子 |
C.“氧化”时可用 替代 替代 | D.“沉锰”时发生了氧化还原反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知某化学反应A2(g)+2B2(g)=2AB2(g)的能量变化如图所示,下列有关叙述中正确的是
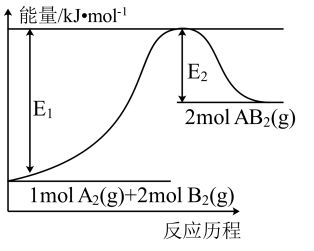

| A.该反应是熵增的反应 |
| B.该反应的ΔH=(E2-E1)kJ·mol-1 |
| C.该反应的活化能为E2 |
| D.该反应中,反应物分子的键能总和大于生成物分子的键能总和 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知反应2NO + 2H2 = N2 + 2H2O的速率方程为υ= kc2(NO)· c(H2)(k为速率常数),其反应历程如下:
① 2NO + H2 → N2+H2O2 慢 ; ② H2O2 + H2 → 2H2O 快
下列说法不正确 的是
① 2NO + H2 → N2+H2O2 慢 ; ② H2O2 + H2 → 2H2O 快
下列说法
| A.升高温度,可提高反应①、②的反应速率 |
| B.c (NO) 、c(H2)增大相同的倍数,对总反应的反应速率的影响程度相同 |
| C.该反应的快慢主要取决于反应① |
| D.可逆反应使用催化剂加快反应速率时,正逆反应的活化能均减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】利用催化转化装置,可以降低汽车尾气中NOx的排放,其工作原理如图所示。下列说法错误的是


| A.此催化转化装置可以减少酸雨和光化学烟雾的形成 |
B.储存过程中可能发生反应 |
| C.高温下Ba(NO3)2具有强氧化性 |
| D.Pt催化剂能降低反应的活化能,提高NOx的平衡转化率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列实验操作和现象与预期实验目的或所得结论不一致的是
| 选项 | 实验操作和现象 | 预期实验目的或所得结论 |
| A | 将酸性KMnO4溶液滴入丙烯醛中,溶液的紫红色褪去 | 不能说明丙烯醛中含有碳碳双键 |
| B | 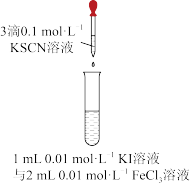 现象为溶液变红 | 证明化学反应存在一定的限度 |
| C | 相同条件下,在两支试管中各加入3mL6%的H2O2溶液,再向H2O2溶液中分别滴入1mLH2O和1mLFeCl3溶液,观察并比较H2O2的分解速率 | 探究催化剂对H2O2分解速率的影响 |
| D | 向2mL甲苯中加入3滴酸性KMnO4溶液,振荡,紫色褪去;向2mL苯中加入3滴酸性KMnO4溶液,振荡,紫色没有褪去 | 证明与苯环相连的甲基易被氧化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】恒温恒压下向密闭容器中充入 和
和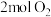 ,反应如下:
,反应如下: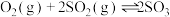
 ,在2min时反应达到平衡,生成
,在2min时反应达到平衡,生成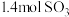 ,同时放出热量QkJ。则下列分析正确的是
,同时放出热量QkJ。则下列分析正确的是
 和
和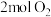 ,反应如下:
,反应如下: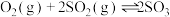
 ,在2min时反应达到平衡,生成
,在2min时反应达到平衡,生成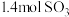 ,同时放出热量QkJ。则下列分析正确的是
,同时放出热量QkJ。则下列分析正确的是A.若改为恒容容器且体积为2L,则 |
B.2min后向容器中再通入一定量的 气体,重新达到平衡时, 气体,重新达到平衡时, 的含量增大 的含量增大 |
C.若把条件“恒温恒压”改为“绝热恒压”,则平衡后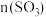 大于1.4mol 大于1.4mol |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在体积相同的刚性容器中模拟 的催化氧化:
的催化氧化: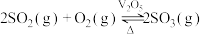
 。当
。当 、
、 和
和 起始物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,
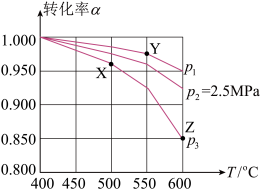
起始物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下, 平衡转化率α随温度的变化如下图。下列说法错误的是。
平衡转化率α随温度的变化如下图。下列说法错误的是。
 的催化氧化:
的催化氧化: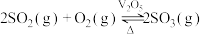
 。当
。当 、
、 和
和 起始物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,
起始物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下, 平衡转化率α随温度的变化如下图。下列说法错误的是。
平衡转化率α随温度的变化如下图。下列说法错误的是。
| A.该反应的△H<0 |
B.Z点, 的物质的量分数为1.125% 的物质的量分数为1.125% |
C.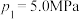 |
D.该反应化学平衡常数: |
您最近一年使用:0次
【推荐3】工业上用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g) ΔH。反应的平衡常数K如表:
CH3OH(g) ΔH。反应的平衡常数K如表:
下列说法错误的是
 CH3OH(g) ΔH。反应的平衡常数K如表:
CH3OH(g) ΔH。反应的平衡常数K如表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10 | 2.4×10 |
| A.ΔH<0 | B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1molCO、0.2molH2和0.3molCH3OH,此时v正>v逆 | D.T1时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50% |
您最近一年使用:0次

 制备
制备 的部分反应历程和能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
的部分反应历程和能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是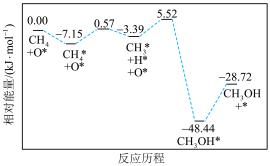
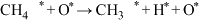 不是决速步
不是决速步

