丙烯是一种重要的化工原料,可以由丙烷在催化剂作用下,制得:
反应Ⅰ(直接脱氢):

反应Ⅱ(氧化脱氢):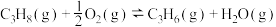
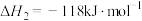
(1)已知键能: ,
,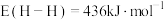 ,
, 。由此计算:
。由此计算: 分子中共价键的键能为
分子中共价键的键能为_______ 。
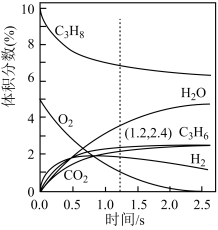
(2)在一定温度和总压恒定的条件下,向反应装置通入气体浓度比为 的混合气体(
的混合气体( 不参加反应),各组分气体的体积分数随时间的变化关系如图所示;反应一段时间后,实验测得消耗的
不参加反应),各组分气体的体积分数随时间的变化关系如图所示;反应一段时间后,实验测得消耗的 和
和 的质量之比小于2.75的原因可能是
的质量之比小于2.75的原因可能是_______ 。
(3)恒温刚性密闭容器中通入气体分压比为 的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):
的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):
反应Ⅱ: k
k
反应Ⅲ: k′
k′
实验测得丙烯的净生成速率方程为: ,试推测丙烯的浓度随时间的变化,在图中画出变化趋势图
,试推测丙烯的浓度随时间的变化,在图中画出变化趋势图_______ 。

(4)关于上述反应,下列说法不正确 的是_______。
(5)已知:ⅰ.一般来说,在过氧化物( )存在下,丙烯与HBr发生自由基机理的反马氏加成反应生成1-溴丙烷:
)存在下,丙烯与HBr发生自由基机理的反马氏加成反应生成1-溴丙烷:
ⅱ.以 作溶剂,光、热或过氧化物存在时,丙烯与HBr、NBS固体可发生自由基机理的取代反应(固体表面):
作溶剂,光、热或过氧化物存在时,丙烯与HBr、NBS固体可发生自由基机理的取代反应(固体表面):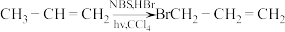 。NBS固体
。NBS固体极易 与HBr快速反应生成 ,进而生成溴自由基(用
,进而生成溴自由基(用 表示)发生后续反应。
表示)发生后续反应。
①若过氧化物存在下,丙烯与HBr的反马氏加成反应的机理如下:
引发阶段:
Ⅰ.
Ⅱ._______;
链的传递:
Ⅲ. CH3-CH=CH2+Br·→C H3-CH-CH2Br
Ⅳ. CH3-C H-CH2Br+HBr→CH3-CH2-CH2Br+Br·
链的终止:(若自由基之间相互结合或被反应容器壁所捕获,链反应即行终止)
请你补充引发阶段步骤Ⅱ:_______ 。按此机理分析预测,写出可能生成的另两种有机物的结构简式_______ 、_______ 。
②在满足上述自由基反应的条件下,丙烯与HBr的加成和取代反应存在竞争关系,两个反应的进程和能量系如图所示:

请说明在不同条件下两者反应主要产物不同的原因:_______ 。
反应Ⅰ(直接脱氢):


反应Ⅱ(氧化脱氢):
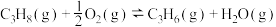
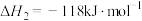
(1)已知键能:
 ,
,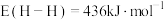 ,
, 。由此计算:
。由此计算: 分子中共价键的键能为
分子中共价键的键能为(2)在一定温度和总压恒定的条件下,向反应装置通入气体浓度比为
 的混合气体(
的混合气体( 不参加反应),各组分气体的体积分数随时间的变化关系如图所示;反应一段时间后,实验测得消耗的
不参加反应),各组分气体的体积分数随时间的变化关系如图所示;反应一段时间后,实验测得消耗的 和
和 的质量之比小于2.75的原因可能是
的质量之比小于2.75的原因可能是
(3)恒温刚性密闭容器中通入气体分压比为
 的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):
的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):反应Ⅱ:
 k
k反应Ⅲ:
 k′
k′实验测得丙烯的净生成速率方程为:
 ,试推测丙烯的浓度随时间的变化,在图中画出变化趋势图
,试推测丙烯的浓度随时间的变化,在图中画出变化趋势图
(4)关于上述反应,下列说法
A.总压恒定时,通 过多或过少都会降低丙烯的产率 过多或过少都会降低丙烯的产率 |
B.将空气经碱液净化处理后,按合适比例与 混合,可作原料气制丙烯 混合,可作原料气制丙烯 |
C.提高原料气中 的体积分数,能使反应Ⅱ平衡右移,一定能提高丙烯产率 的体积分数,能使反应Ⅱ平衡右移,一定能提高丙烯产率 |
| D.实际生产过程中,应该根据反应达平衡后丙烯的体积分数最大值确定反应的温度 |
 )存在下,丙烯与HBr发生自由基机理的反马氏加成反应生成1-溴丙烷:
)存在下,丙烯与HBr发生自由基机理的反马氏加成反应生成1-溴丙烷:
ⅱ.以
 作溶剂,光、热或过氧化物存在时,丙烯与HBr、NBS固体可发生自由基机理的取代反应(固体表面):
作溶剂,光、热或过氧化物存在时,丙烯与HBr、NBS固体可发生自由基机理的取代反应(固体表面):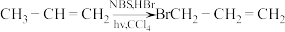 。NBS固体
。NBS固体 ,进而生成溴自由基(用
,进而生成溴自由基(用 表示)发生后续反应。
表示)发生后续反应。①若过氧化物存在下,丙烯与HBr的反马氏加成反应的机理如下:
引发阶段:
Ⅰ.

Ⅱ._______;
链的传递:
Ⅲ. CH3-CH=CH2+Br·→
Ⅳ.
链的终止:(若自由基之间相互结合或被反应容器壁所捕获,链反应即行终止)
请你补充引发阶段步骤Ⅱ:
②在满足上述自由基反应的条件下,丙烯与HBr的加成和取代反应存在竞争关系,两个反应的进程和能量系如图所示:

请说明在不同条件下两者反应主要产物不同的原因:
更新时间:2022-05-27 21:37:07
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】甲醇是一种可再生能源,具有开发和应用的广阔前景。
(1)①已知 、
、 的燃烧热分别为
的燃烧热分别为 ,
, 。
。
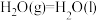

则 的
的
_______  。
。
② 与
与 合成甲醇过程中,会发生副反应:
合成甲醇过程中,会发生副反应:
 ,为减少副反应的发生,同时不降低
,为减少副反应的发生,同时不降低 生成
生成 的反应速率和平衡转化率,可采取的措施是
的反应速率和平衡转化率,可采取的措施是_______ 。
(2)科学家以 为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为
为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为_______ 。


(3)用如图乙所示的电解装置可制得甲醇等。
①阳极区发生的电极反应式为_______ 。
②请解释阴极区NaOH浓度增大的原因_______ 。
(1)①已知
 、
、 的燃烧热分别为
的燃烧热分别为 ,
, 。
。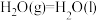

则
 的
的
 。
。②
 与
与 合成甲醇过程中,会发生副反应:
合成甲醇过程中,会发生副反应:
 ,为减少副反应的发生,同时不降低
,为减少副反应的发生,同时不降低 生成
生成 的反应速率和平衡转化率,可采取的措施是
的反应速率和平衡转化率,可采取的措施是(2)科学家以
 为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为
为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为

(3)用如图乙所示的电解装置可制得甲醇等。
①阳极区发生的电极反应式为
②请解释阴极区NaOH浓度增大的原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l) ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g) = 2(NH4)2SO4(aq) ΔH3=c kJ·kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l) 的ΔH=________ kJ·mol-1
(2)燃煤发电厂常利用反应:2CaCO3(s)+2SO2(g)+O2(g) = 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~10min内,平均反应速率v(O2)=________ mol·L-1·min-1;当升高温度,该反应的平衡常数K________ (填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________ (填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
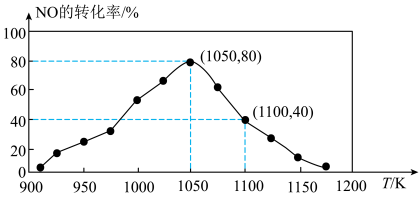
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________ ;在1100K时,CO2的体积分数为________ 。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________ [已知:气体分压(P分)=气体总压(P总)×体积分数]。
(5)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
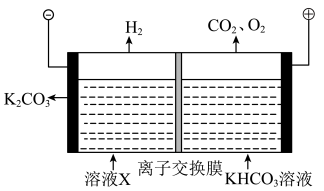
①在阳极区发生的反应包括___________ 和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:______________ 。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l) ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g) = 2(NH4)2SO4(aq) ΔH3=c kJ·kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l) 的ΔH=
(2)燃煤发电厂常利用反应:2CaCO3(s)+2SO2(g)+O2(g) = 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 | |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=
(5)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:

①在阳极区发生的反应包括
②简述CO32-在阴极区再生的原理:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】二氧化碳—甲烷重整反应制备合成气( )是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①

②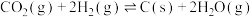

③

④
回答下列问题:
(1) =
=______ ,反应①______ 正向自发进行(填标号)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为5.00MPa、1.00MPa和0.50MPa时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为5.00MPa的曲线是
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为5.00MPa的曲线是______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是______  的物质的量先增加后减少。主要原因是
的物质的量先增加后减少。主要原因是______ . 和1mol
和1mol ,达到平衡时CH4的转化率为80%,
,达到平衡时CH4的转化率为80%, 的转化率为50%,碳单质的物质的量为0.8mol,
的转化率为50%,碳单质的物质的量为0.8mol, 的物质的量为
的物质的量为______ mol,反应①用摩尔分数表示的平衡常数 =
=______ (结果保留两位小数)。上述平衡时 。向体系通入
。向体系通入 气,重新达到平衡时。
气,重新达到平衡时。 ,则
,则
______  (填“>”“<”或“=”)。(已知反应
(填“>”“<”或“=”)。(已知反应 的
的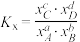 ,物质
,物质 的摩尔分数
的摩尔分数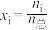 )
)
 )是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:①


②
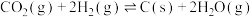

③


④

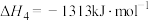
回答下列问题:
(1)
 =
=A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为5.00MPa、1.00MPa和0.50MPa时,
 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为5.00MPa的曲线是
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为5.00MPa的曲线是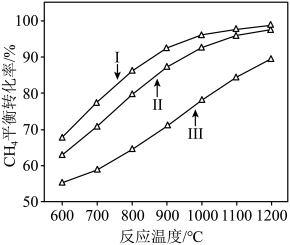
 的物质的量先增加后减少。主要原因是
的物质的量先增加后减少。主要原因是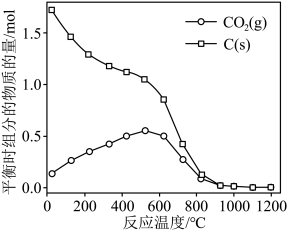
 和1mol
和1mol ,达到平衡时CH4的转化率为80%,
,达到平衡时CH4的转化率为80%, 的转化率为50%,碳单质的物质的量为0.8mol,
的转化率为50%,碳单质的物质的量为0.8mol, 的物质的量为
的物质的量为 =
= 。向体系通入
。向体系通入 气,重新达到平衡时。
气,重新达到平衡时。 ,则
,则
 (填“>”“<”或“=”)。(已知反应
(填“>”“<”或“=”)。(已知反应 的
的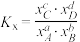 ,物质
,物质 的摩尔分数
的摩尔分数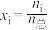 )
)
您最近一年使用:0次
【推荐1】中国科学家研发出铜基催化剂( ),实现了
),实现了 高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:
高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:
(1)某科研小组设计如图所示电解池,可利用 和
和 制备甲酸盐和水煤气,生成甲酸盐的电极反应式为
制备甲酸盐和水煤气,生成甲酸盐的电极反应式为________ ,当生成1mol甲酸根时,有4mol离子通过交换膜,两极共生成气体________ L(标况下)。
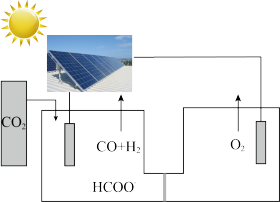
(2)已知25℃、101kPa下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ.

Ⅱ.
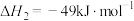
Ⅲ.
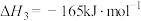
①几种化学键的键能如图表所示,则a=________ 。
②反应Ⅰ的速率方程为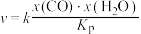 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后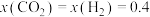 ,此时反应Ⅱ的速率v=
,此时反应Ⅱ的速率v=________  (用含k的代数式表示)。
(用含k的代数式表示)。
(3)向体积均为1L的刚性密闭容器中通入 、
、 ,发生反应Ⅰ和反应Ⅱ,温度对CO和
,发生反应Ⅰ和反应Ⅱ,温度对CO和 的物质的量分数影响如图所示。
的物质的量分数影响如图所示。
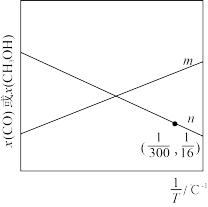
图中表示 物质的量分数的为
物质的量分数的为________ (填“m”或“n”);已知起始压强为pkPa,在300℃时 平衡转化率为60%,则此时反应Ⅰ的
平衡转化率为60%,则此时反应Ⅰ的
________ 。为提高 的选择性,可采取的措施有
的选择性,可采取的措施有________ (写出1条即可)。
 ),实现了
),实现了 高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:
高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:(1)某科研小组设计如图所示电解池,可利用
 和
和 制备甲酸盐和水煤气,生成甲酸盐的电极反应式为
制备甲酸盐和水煤气,生成甲酸盐的电极反应式为
(2)已知25℃、101kPa下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ.


Ⅱ.

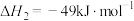
Ⅲ.

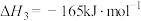
①几种化学键的键能如图表所示,则a=
化学键 | C-H | H-H | H-O | C=O |
键能 | 413 | 436 | 463 | a |
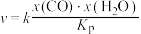 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后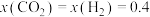 ,此时反应Ⅱ的速率v=
,此时反应Ⅱ的速率v= (用含k的代数式表示)。
(用含k的代数式表示)。(3)向体积均为1L的刚性密闭容器中通入
 、
、 ,发生反应Ⅰ和反应Ⅱ,温度对CO和
,发生反应Ⅰ和反应Ⅱ,温度对CO和 的物质的量分数影响如图所示。
的物质的量分数影响如图所示。
图中表示
 物质的量分数的为
物质的量分数的为 平衡转化率为60%,则此时反应Ⅰ的
平衡转化率为60%,则此时反应Ⅰ的
 的选择性,可采取的措施有
的选择性,可采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ:氨热分解法制氢气。相关化学键的键能数据如下:
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(1)反应

___________  。
。
(2)此反应在___________ (填“高温”或“低温”)条件下能自发进行。
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,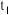 时反应达到平衡,用
时反应达到平衡,用 的压强变化表示0~
的压强变化表示0~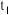 时间内的反应速率
时间内的反应速率
___________ Kpa/min(用含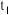 的代数式表示)。
的代数式表示)。
②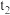 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ 。
③在该温度下,反应的标准平衡常数
___________ 。(已知:分压=总压×该组分物质的量分数,对于反应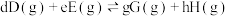 ,
,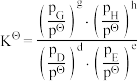 ,其中
,其中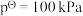 ,
, 、
、 、
、 、
、 为各级分的平衡分压。)
为各级分的平衡分压。)
方法Ⅰ:氨热分解法制氢气。相关化学键的键能数据如下:
| 化学键 | N≡N | H—H | N—H |
键能( ) ) | 946.0 | 436.0 | 390.8 |
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(1)反应


 。
。(2)此反应在
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol
 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,
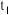 时反应达到平衡,用
时反应达到平衡,用 的压强变化表示0~
的压强变化表示0~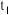 时间内的反应速率
时间内的反应速率
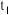 的代数式表示)。
的代数式表示)。②
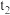 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是③在该温度下,反应的标准平衡常数

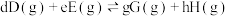 ,
,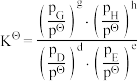 ,其中
,其中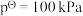 ,
, 、
、 、
、 、
、 为各级分的平衡分压。)
为各级分的平衡分压。)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】液态肼( )是一种高能燃料,在工业生产中用途广泛,其结构如图所示:
)是一种高能燃料,在工业生产中用途广泛,其结构如图所示: 肼中含有
肼中含有_______  极性共价键。
极性共价键。
(2)工业上可用肼与新制 反应制备
反应制备 ,同时放出
,同时放出 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3) 可在
可在 中燃烧生成
中燃烧生成 和水蒸气,已知:
和水蒸气,已知: 肼完全反应放出热量为
肼完全反应放出热量为 ,则
,则 的键能为
的键能为_______  ;部分共价键键能如下表所示:
;部分共价键键能如下表所示:
(4)肼—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。该电池的B极区发生_______ (填“氧化反应”或“还原反应”),负极的电极反应为_______ ,电池工作过程中,若A极区产生 (标况下)
(标况下) ,则B极区消耗
,则B极区消耗 的物质的量是
的物质的量是_______ ,转移的电子数目为_______ 。
 )是一种高能燃料,在工业生产中用途广泛,其结构如图所示:
)是一种高能燃料,在工业生产中用途广泛,其结构如图所示: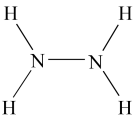
 肼中含有
肼中含有 极性共价键。
极性共价键。(2)工业上可用肼与新制
 反应制备
反应制备 ,同时放出
,同时放出 ,该反应的化学方程式为
,该反应的化学方程式为(3)
 可在
可在 中燃烧生成
中燃烧生成 和水蒸气,已知:
和水蒸气,已知: 肼完全反应放出热量为
肼完全反应放出热量为 ,则
,则 的键能为
的键能为 ;部分共价键键能如下表所示:
;部分共价键键能如下表所示: |  |  |  | |
键能( ) ) | 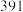 | 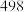 | 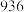 |  |
 (标况下)
(标况下) ,则B极区消耗
,则B极区消耗 的物质的量是
的物质的量是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】基于 载氮体的碳基化学链合成氨技术示意图如下。
载氮体的碳基化学链合成氨技术示意图如下。

_______  。
。
(2)有利于提高反应ⅰ平衡转化率的条件为_______(填标号)。
(3)在温度t、100kPa条件下进行反应ⅰ,平衡时若氮气转化率为50%,则 压强为
压强为_______ ,平衡常数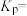
_______  (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
(4)60℃、100kPa条件下,反应ⅰ中溶液pH随时间变化如图,120min~180min持续收集到氨气,但溶液pH几乎不变的原因是_______ 。_______ 的键能大于_______ 的键能。
②15min时反应速率突然加快的原因是_______ 。
(6)相较于哈伯法合成氨,碳基化学链合成氨的优势有能够降低能耗、减少原料成本。_______ (写出一条即可)。
 载氮体的碳基化学链合成氨技术示意图如下。
载氮体的碳基化学链合成氨技术示意图如下。


 。
。(2)有利于提高反应ⅰ平衡转化率的条件为_______(填标号)。
| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
 压强为
压强为
 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。(4)60℃、100kPa条件下,反应ⅰ中溶液pH随时间变化如图,120min~180min持续收集到氨气,但溶液pH几乎不变的原因是


②15min时反应速率突然加快的原因是
(6)相较于哈伯法合成氨,碳基化学链合成氨的优势有能够降低能耗、减少原料成本。
您最近一年使用:0次
【推荐2】 为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生成。
气体生成。 脱硫技术是当前的重点研究方向。
脱硫技术是当前的重点研究方向。
(1)1883年英国化学家Claus开发了 氧化制硫的方法,即:
氧化制硫的方法,即: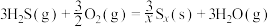
 ,20世纪30年代,德国法本公司将
,20世纪30年代,德国法本公司将 的氧化分两阶段完成。
的氧化分两阶段完成。
第一阶段反应为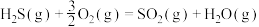
 ;
;
第二阶段反应为

_______  。
。
(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:
 ,文献显示,工业上氧化锌法控制温度在
,文献显示,工业上氧化锌法控制温度在 ,请分析控制此温度区间的原因
,请分析控制此温度区间的原因_______ 。
(3)热解 制
制 。根据文献,将
。根据文献,将 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
I

II

总反应:III
投料按体积之比 ,并用
,并用 稀释,常压,不同温度下反应相同时间后,测得
稀释,常压,不同温度下反应相同时间后,测得 和
和 体积分数如下表:
体积分数如下表:
①反应II能自发进行的条件是_______ 。
②下列说法正确的是_______ 。
A.其他条件不变时,温度越高, 的转化率越高
的转化率越高
B.断裂 键的同时断裂
键的同时断裂 键,说明反应I已达平衡状态
键,说明反应I已达平衡状态
C.恒温恒压下,增加 的体积分数,
的体积分数, 的浓度升高
的浓度升高
D.在 ,常压下,保持通入的
,常压下,保持通入的 体积分数不变,提高投料比
体积分数不变,提高投料比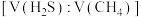 ,
, 的转化率不变
的转化率不变
③在 、
、 反应条件下,只充入
反应条件下,只充入 和
和 气体进行
气体进行 热分解反应。已知反应一开始,
热分解反应。已知反应一开始, ,平衡时混合气中
,平衡时混合气中 与
与 的分压相等,则平衡常数
的分压相等,则平衡常数
_______  。[对于气相反应,用某组分
。[对于气相反应,用某组分 的平衡压强
的平衡压强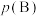 代替物质的量浓度
代替物质的量浓度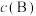 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如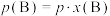 ,
, 为平衡总压强,
为平衡总压强,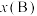 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。
(4)栲胶脱硫技术是我国独创的湿法催化氧化脱硫技术,被广泛应用于国内。栲胶脱硫技术机理如下,请在横线上补全第二步:
①
②_______ 。
③ 栲胶(醌态)
栲胶(醌态) 栲胶(酚态)
栲胶(酚态)
④栲胶(酚态) 栲胶(醌态)
栲胶(醌态)
⑤
总反应:
 为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生成。
气体生成。 脱硫技术是当前的重点研究方向。
脱硫技术是当前的重点研究方向。(1)1883年英国化学家Claus开发了
 氧化制硫的方法,即:
氧化制硫的方法,即: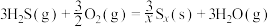
 ,20世纪30年代,德国法本公司将
,20世纪30年代,德国法本公司将 的氧化分两阶段完成。
的氧化分两阶段完成。第一阶段反应为
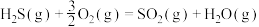
 ;
;第二阶段反应为


 。
。(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:

 ,文献显示,工业上氧化锌法控制温度在
,文献显示,工业上氧化锌法控制温度在 ,请分析控制此温度区间的原因
,请分析控制此温度区间的原因(3)热解
 制
制 。根据文献,将
。根据文献,将 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:I


II


总反应:III

投料按体积之比
 ,并用
,并用 稀释,常压,不同温度下反应相同时间后,测得
稀释,常压,不同温度下反应相同时间后,测得 和
和 体积分数如下表:
体积分数如下表:温度/ | 950 | 1000 | 1050 | 1100 | 1150 |
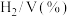 | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
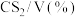 | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
②下列说法正确的是
A.其他条件不变时,温度越高,
 的转化率越高
的转化率越高B.断裂
 键的同时断裂
键的同时断裂 键,说明反应I已达平衡状态
键,说明反应I已达平衡状态C.恒温恒压下,增加
 的体积分数,
的体积分数, 的浓度升高
的浓度升高D.在
 ,常压下,保持通入的
,常压下,保持通入的 体积分数不变,提高投料比
体积分数不变,提高投料比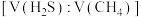 ,
, 的转化率不变
的转化率不变③在
 、
、 反应条件下,只充入
反应条件下,只充入 和
和 气体进行
气体进行 热分解反应。已知反应一开始,
热分解反应。已知反应一开始, ,平衡时混合气中
,平衡时混合气中 与
与 的分压相等,则平衡常数
的分压相等,则平衡常数
 。[对于气相反应,用某组分
。[对于气相反应,用某组分 的平衡压强
的平衡压强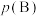 代替物质的量浓度
代替物质的量浓度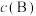 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如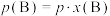 ,
, 为平衡总压强,
为平衡总压强,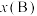 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。(4)栲胶脱硫技术是我国独创的湿法催化氧化脱硫技术,被广泛应用于国内。栲胶脱硫技术机理如下,请在横线上补全第二步:
①

②
③
 栲胶(醌态)
栲胶(醌态) 栲胶(酚态)
栲胶(酚态)④栲胶(酚态)
 栲胶(醌态)
栲胶(醌态)
⑤

总反应:

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】十九大报告提出要对环境问题进行全面、系统的可持续治理,绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如图所示:

(1)已知反应Ⅰ.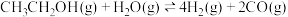
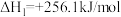
反应Ⅱ.
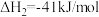
写出反应Ⅲ的热化学方程式_______ 。
(2)反应Ⅱ,在进气比 不同时,测得相应的
不同时,测得相应的 平衡转化率见图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
平衡转化率见图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

①A、E和G三点对应的反应温度相同,反应在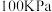 的压强下进行,则G点的
的压强下进行,则G点的
_______ (填数值),图中温度最高的点是_______ 。
②C、D两点对应的正反应速率: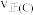
_______ 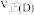 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。已知反应速率
”)。已知反应速率 ,k为反应速率常数,x为物质的量分数,计算在达到平衡状态为C点的反应过程中,当
,k为反应速率常数,x为物质的量分数,计算在达到平衡状态为C点的反应过程中,当 转化率刚好达到20%时,
转化率刚好达到20%时,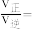
_______ 。
(3)工业上采用催化乙烯水合制乙醇,该反应过程中能量变化如图所示:
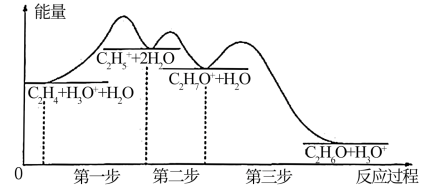
①反应过程中的控制总反应速率的步骤是_______ ,理由为_______ 。
②反应物分子有效碰撞几率最大的步骤是_______ ,对应的基元反应为_______ 。

(1)已知反应Ⅰ.
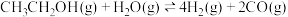
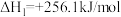
反应Ⅱ.

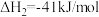
写出反应Ⅲ的热化学方程式
(2)反应Ⅱ,在进气比
 不同时,测得相应的
不同时,测得相应的 平衡转化率见图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
平衡转化率见图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
①A、E和G三点对应的反应温度相同,反应在
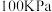 的压强下进行,则G点的
的压强下进行,则G点的
②C、D两点对应的正反应速率:
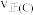
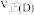 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。已知反应速率
”)。已知反应速率 ,k为反应速率常数,x为物质的量分数,计算在达到平衡状态为C点的反应过程中,当
,k为反应速率常数,x为物质的量分数,计算在达到平衡状态为C点的反应过程中,当 转化率刚好达到20%时,
转化率刚好达到20%时,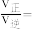
(3)工业上采用催化乙烯水合制乙醇,该反应过程中能量变化如图所示:

①反应过程中的控制总反应速率的步骤是
②反应物分子有效碰撞几率最大的步骤是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】利用某一工业钴渣(主要成分为 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示:
①沉淀1为黄钠铁矾,化学式为: 。
。
②当某离子浓度 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,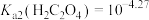
③氧化性:
(1)“浸出”过程中 元发生反应的离子方程式为
元发生反应的离子方程式为_______ ,用盐酸代替硫酸的缺点是_______ 。
(2)“浸出液”中加入 的作用是
的作用是_______ ,试剂a为_______ 。
(3)有机萃取剂用HR表示,发生萃取的反应可表示为 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是_______ 。
(4)沉淀2为 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH=_______ 。用 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=_______ 。
(5)已知氧化性: 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是_______ 。
 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示: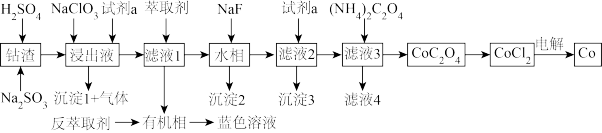
①沉淀1为黄钠铁矾,化学式为:
 。
。②当某离子浓度
 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,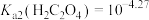
③氧化性:

(1)“浸出”过程中
 元发生反应的离子方程式为
元发生反应的离子方程式为(2)“浸出液”中加入
 的作用是
的作用是(3)有机萃取剂用HR表示,发生萃取的反应可表示为
 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是(4)沉淀2为
 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH= 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=(5)已知氧化性:
 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】杭州亚运会主火炬塔燃料使用的甲醇被誉为绿色燃料。在以往的运动会中,丙烷、煤油也曾作为燃料使用。上述燃料的热值和 排放量如下表所示:
排放量如下表所示:
(1)根据上表数据,计算 的燃烧热为___________
的燃烧热为___________ 。
。
(2)根据上表,从 排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因
排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因___________ 。
以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一、其反应原理为:
资源化利用的方式之一、其反应原理为:
(3)下图中,曲线___________ 能表示该反应的平衡常数K与温度T的关系。
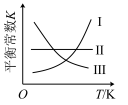
A.I B.II C.III
(4)某温度下,向容积为2.0L的恒容密闭容器中充入 和
和 模拟上述反应。反应达到平衡状态时,测得
模拟上述反应。反应达到平衡状态时,测得 。该温度下,平衡常数
。该温度下,平衡常数 ___________。
___________。
在不同温度下,向等容积的反应器中,分别通入等量、相同比例的 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO:
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO: 。
。

(5)图中一定不处于化学平衡状态的点是___________。
(6)已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有___________ 、___________ 。
光催化可以加快合成甲醇的反应速率,下图是该反应的部分历程,其中吸附在催化剂表面的物质用*表示。

(7)上图虚线框中的基元反应,主要决定总反应速率快慢的是___________。
上海某研究团队研制出了一种具有反应和分离“双功能分子师催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示:
CO2+3H2 CH3OH+H2O
CH3OH+H2O
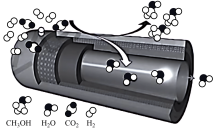
在不同反应器中, 平衡转化率和甲醇选择性
平衡转化率和甲醇选择性 的相关实验数据如下表所示:
的相关实验数据如下表所示:
(8)从绿色化学的角度,分析该双功能分子筛催化膜反应器的优点有:
① 平衡转化率明显升高;
平衡转化率明显升高;
②___________ ;
③___________ 。
 排放量如下表所示:
排放量如下表所示:| 燃料 | 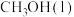 |  | 煤油 |
热值 | 22.7 | 50.4 | 29.0 |
 排放量 排放量 | 16.5 | 16.2 | 22.9 |
(1)根据上表数据,计算
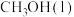 的燃烧热为___________
的燃烧热为___________ 。
。| A.22.7 | B. | C. | D. |
(2)根据上表,从
 排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因
排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因以
 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一、其反应原理为:
资源化利用的方式之一、其反应原理为:
(3)下图中,曲线

A.I B.II C.III
(4)某温度下,向容积为2.0L的恒容密闭容器中充入
 和
和 模拟上述反应。反应达到平衡状态时,测得
模拟上述反应。反应达到平衡状态时,测得 。该温度下,平衡常数
。该温度下,平衡常数 ___________。
___________。| A.3.00 | B.0.33 | C.0.15 | D.0.59 |
在不同温度下,向等容积的反应器中,分别通入等量、相同比例的
 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO:
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO: 。
。
(5)图中一定不处于化学平衡状态的点是___________。
| A.点A | B.点B | C.点C | D.点D |
(6)已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有
光催化可以加快合成甲醇的反应速率,下图是该反应的部分历程,其中吸附在催化剂表面的物质用*表示。

(7)上图虚线框中的基元反应,主要决定总反应速率快慢的是___________。
A. | B. |
C. | D. |
上海某研究团队研制出了一种具有反应和分离“双功能分子师催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示:
CO2+3H2
 CH3OH+H2O
CH3OH+H2O
在不同反应器中,
 平衡转化率和甲醇选择性
平衡转化率和甲醇选择性 的相关实验数据如下表所示:
的相关实验数据如下表所示:| 实验组 | 反应器 | 压强/MPa | 温度/K | 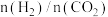 |  平衡转化率/% 平衡转化率/% | 甲醇选择性/% |
| ① | 普通催化反应器 | 3 | 533 | 3 | 21.9 | 67.3 |
| ② | 双功能分子筛催化膜反应器 | 36.1 | 100 |
(8)从绿色化学的角度,分析该双功能分子筛催化膜反应器的优点有:
①
 平衡转化率明显升高;
平衡转化率明显升高;②
③
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】生产医用防护口罩的原料聚丙烯属于有机高分子材料,其单体为丙烯。丙烯除了合成聚丙烯外,还广泛用于制备1,2-二氯丙烷、丙烯醛、丙烯酸等。回答下列问题:
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯反应原理为:
①CH2=CHCH3(g)+Cl2(g)=CH2ClCHClCH3(g) △H=-134kJ/mol
②CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2Cl(g)+HCl △H=-102kJ/mol
已知:CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g)的活化能Ea(逆)为164kJ/mol,则该反应的活化能Ea(正)为___________ kJ/mol。
(2)丙烷无氧脱氢法制备丙烯反应如下:C3H8(g) C3H6(g)+H2(g) △H=+124kJ/mol
C3H6(g)+H2(g) △H=+124kJ/mol
①某温度下,在刚性容器中充入C3H8(g),起始压强为10kPa,平衡时总压为14kPa,C3H8(g)的平衡转化率为___________ 。该反应的平衡常数Kp=___________ 。(以分压表示,分压=总压×物质的量分数)
②总压分别为100kPa、10kPa时发生该反应,平衡体系中C3H8(g)和C3H6(g)的物质的量分数随温度的变化关系如图所示,其中曲线a代表压强为___________ kPa时___________ 的物质的量分数随温度的变化关系。

(3)丙烷氧化脱氢制备丙烯还生成CO、CO2等副产物制备丙烯的反应:C3H8(g)+ O2(g)=C3H6(g)+H2O(g) △H=-118kJ/mol,相同时间内,在某催化剂作用下C3H8(g)的转化率和C3H6(g)的产率随温度的变化关系如图所示。
O2(g)=C3H6(g)+H2O(g) △H=-118kJ/mol,相同时间内,在某催化剂作用下C3H8(g)的转化率和C3H6(g)的产率随温度的变化关系如图所示。

①图中C3H8(g)的转化率随温度升高而上升的原因是___________ 。
②575℃时,C3H6(g)的选择性为___________ 。[选择性= ]
]
③基于上述研究结果能提高C3H6(g)选择性的措施是___________ 。
(4)甲酸作为直接燃料电池的燃料具有能量密度高的优点,该电池的理论输出电压为2.30V,能量密度E=___________ kWh/kg(能量密度=电池输出电能/燃料质量,1kWh=3.6×106J,法拉第常数F=96500C/mol)
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯反应原理为:
①CH2=CHCH3(g)+Cl2(g)=CH2ClCHClCH3(g) △H=-134kJ/mol
②CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2Cl(g)+HCl △H=-102kJ/mol
已知:CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g)的活化能Ea(逆)为164kJ/mol,则该反应的活化能Ea(正)为
(2)丙烷无氧脱氢法制备丙烯反应如下:C3H8(g)
 C3H6(g)+H2(g) △H=+124kJ/mol
C3H6(g)+H2(g) △H=+124kJ/mol①某温度下,在刚性容器中充入C3H8(g),起始压强为10kPa,平衡时总压为14kPa,C3H8(g)的平衡转化率为
②总压分别为100kPa、10kPa时发生该反应,平衡体系中C3H8(g)和C3H6(g)的物质的量分数随温度的变化关系如图所示,其中曲线a代表压强为

(3)丙烷氧化脱氢制备丙烯还生成CO、CO2等副产物制备丙烯的反应:C3H8(g)+
 O2(g)=C3H6(g)+H2O(g) △H=-118kJ/mol,相同时间内,在某催化剂作用下C3H8(g)的转化率和C3H6(g)的产率随温度的变化关系如图所示。
O2(g)=C3H6(g)+H2O(g) △H=-118kJ/mol,相同时间内,在某催化剂作用下C3H8(g)的转化率和C3H6(g)的产率随温度的变化关系如图所示。
①图中C3H8(g)的转化率随温度升高而上升的原因是
②575℃时,C3H6(g)的选择性为
 ]
]③基于上述研究结果能提高C3H6(g)选择性的措施是
(4)甲酸作为直接燃料电池的燃料具有能量密度高的优点,该电池的理论输出电压为2.30V,能量密度E=
您最近一年使用:0次




