为减少CO2对环境造成的影响,可采⽤“CO2催化加氢制甲醇”⽅法将其资源化利⽤。
该反应体系中涉及以下三个反应:
Ⅰ.
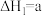 kJ·mol-1
kJ·mol-1
Ⅱ.
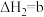 kJ·mol-1
kJ·mol-1
Ⅲ.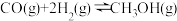
回答下列问题:
(1)已知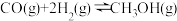 的正反应的活化能为c kJ·mol-1,则逆反应的活化能为
的正反应的活化能为c kJ·mol-1,则逆反应的活化能为___________ kJ·mol-1.(⽤含a、b、c代数式表示)
(2)反应I、II的lg K(K代表化学平衡常数)随1/T(温度的倒数)的变化如图所示。
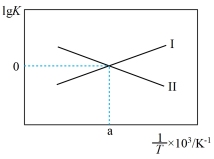
①ΔH2___________ 0(填“⼤于”或“⼩于”或“等于”);
②降低温度,反应 的化学平衡常数
的化学平衡常数___________ (填“增⼤”或“减⼩”或“不变”)。原因为___________ 。
③关于反应Ⅲ的lg K(K代表化学平衡常数)随1/T(温度的倒数)的变化图正确的是___________
A、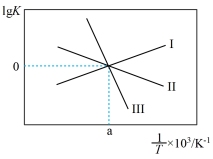 B、
B、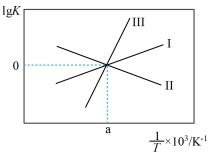
C、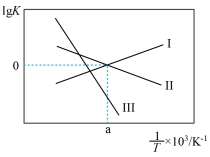 D、
D、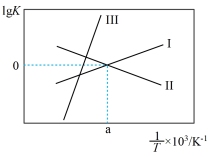
④在a点温度下,若只发⽣I、II两个反应,在2L的容器中投⼊⾜量的CO2和3molH2,达到平衡后氢⽓的转化率为80%,此条件下甲醇的选择性(指转化为甲醇的CO2占发⽣反应的CO2的百分比)为___________ 。
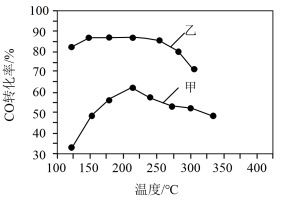
(3)向2L密闭容器中分别投⼊⼀定量的CO和H2发⽣反应Ⅲ,其他条件相同时,在甲、⼄两种催化剂的作⽤下,CO的转化率与温度的关系如图所示。在催化剂甲的作⽤下,温度⾼于210℃时,CO转化率降低的可能原因是___________。
该反应体系中涉及以下三个反应:
Ⅰ.

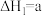 kJ·mol-1
kJ·mol-1Ⅱ.

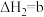 kJ·mol-1
kJ·mol-1Ⅲ.
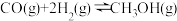
回答下列问题:
(1)已知
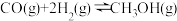 的正反应的活化能为c kJ·mol-1,则逆反应的活化能为
的正反应的活化能为c kJ·mol-1,则逆反应的活化能为(2)反应I、II的lg K(K代表化学平衡常数)随1/T(温度的倒数)的变化如图所示。

①ΔH2
②降低温度,反应
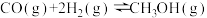 的化学平衡常数
的化学平衡常数③关于反应Ⅲ的lg K(K代表化学平衡常数)随1/T(温度的倒数)的变化图正确的是
A、
 B、
B、
C、
 D、
D、
④在a点温度下,若只发⽣I、II两个反应,在2L的容器中投⼊⾜量的CO2和3molH2,达到平衡后氢⽓的转化率为80%,此条件下甲醇的选择性(指转化为甲醇的CO2占发⽣反应的CO2的百分比)为
(3)向2L密闭容器中分别投⼊⼀定量的CO和H2发⽣反应Ⅲ,其他条件相同时,在甲、⼄两种催化剂的作⽤下,CO的转化率与温度的关系如图所示。在催化剂甲的作⽤下,温度⾼于210℃时,CO转化率降低的可能原因是___________。

| A.催化剂活性降低 | B.温度升⾼副反应增多 |
| C.温度升⾼平衡逆向移动 | D.该反应的活化能升⾼ |
更新时间:2022-06-03 17:08:12
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】已知 混合后在一定条件下能发生如下反应:
混合后在一定条件下能发生如下反应:
I.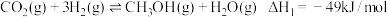
II.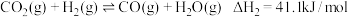
(1)试写出 与
与 反应合成甲醇的热化学方程式
反应合成甲醇的热化学方程式_______
(2) 和
和 混合在一定条件下反应,测得
混合在一定条件下反应,测得 平衡转化率、平衡时含碳产物中甲醇和
平衡转化率、平衡时含碳产物中甲醇和 物质的量分数随温度的变化如图所示。则图中
物质的量分数随温度的变化如图所示。则图中 的百分含量对应的曲线应该是
的百分含量对应的曲线应该是_______ (填“b”或“c”),理由是_______ ;图中X点的混合体系中甲醇、 的物质的量之比为
的物质的量之比为_______ , 的转化率为
的转化率为_______ (保留一位小数)

(3)CO与H2O可以在 催化作用下发生上述反应II,其反应机理如图2所示,OH-在该反应过程中的作用是
催化作用下发生上述反应II,其反应机理如图2所示,OH-在该反应过程中的作用是_______ ,若参与反应的是C18O,则生成的CO2成分为_______ (填“只有CO18O”或“只有CO2”或“CO18O和CO2”)

 混合后在一定条件下能发生如下反应:
混合后在一定条件下能发生如下反应:I.
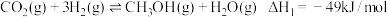
II.
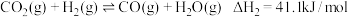
(1)试写出
 与
与 反应合成甲醇的热化学方程式
反应合成甲醇的热化学方程式(2)
 和
和 混合在一定条件下反应,测得
混合在一定条件下反应,测得 平衡转化率、平衡时含碳产物中甲醇和
平衡转化率、平衡时含碳产物中甲醇和 物质的量分数随温度的变化如图所示。则图中
物质的量分数随温度的变化如图所示。则图中 的百分含量对应的曲线应该是
的百分含量对应的曲线应该是 的物质的量之比为
的物质的量之比为 的转化率为
的转化率为
(3)CO与H2O可以在
 催化作用下发生上述反应II,其反应机理如图2所示,OH-在该反应过程中的作用是
催化作用下发生上述反应II,其反应机理如图2所示,OH-在该反应过程中的作用是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】铜的化合物在工农业生产中具有重要地位。请按要求回答下列问题。
Ⅰ.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:①2Cu(s)+ O2(g)=Cu2O(s)△H=-169kJ·mol﹣1
O2(g)=Cu2O(s)△H=-169kJ·mol﹣1
②C(s)+ O2(g)=CO(g)△H=-110.5kJ·mol﹣1
O2(g)=CO(g)△H=-110.5kJ·mol﹣1
③CuO(s)=Cu(s)+ O2(g)△H=+157kJ·mol﹣1
O2(g)△H=+157kJ·mol﹣1
写出方法c反应的热化学方程式:_______ 。
(2)在相同的密闭容器中,用上表方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g) 2H2(g)+O2(g)△H>0。水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g)△H>0。水蒸气的浓度随时间t变化如下表所示:
对比上述实验数据,可获得的结论:
①催化剂的催化效率:实验i_______ 实验ii(填“>”“<”“=”,下同)。
②T1_______ T2。
Ⅱ.在2L的恒温密闭容器中通入5molO2并加入足量Cu2S发生反应:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H1=-271.4kJ/mol,反应过程中某气体的体积分数随时间变化如图所示。

(3)反应前2min平均反应速率v(SO2)=_______ ;该温度下反应的平衡常数K=_______ 。若保持温度不变向平衡体系中再通入1molO2,达到新平衡后氧气的体积分数_______ (填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
Ⅰ.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法a | 用葡萄糖还原新制的Cu(OH)2(NaOH过量)制备Cu2O |
| 方法b | 用肼(N2H4)加热还原新制的Cu(OH)2制备Cu2O,同时放出N2 |
| 方法c | 用炭粉在1000℃以上还原CuO制备Cu2O,同时放出CO |
 O2(g)=Cu2O(s)△H=-169kJ·mol﹣1
O2(g)=Cu2O(s)△H=-169kJ·mol﹣1②C(s)+
 O2(g)=CO(g)△H=-110.5kJ·mol﹣1
O2(g)=CO(g)△H=-110.5kJ·mol﹣1③CuO(s)=Cu(s)+
 O2(g)△H=+157kJ·mol﹣1
O2(g)△H=+157kJ·mol﹣1写出方法c反应的热化学方程式:
(2)在相同的密闭容器中,用上表方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)
 2H2(g)+O2(g)△H>0。水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g)△H>0。水蒸气的浓度随时间t变化如下表所示:| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| i | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ii | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| iii | T2 | 0.100 | 0.0960 | 0.0930 | 0.0900 | 0.0900 | 0.0900 |
①催化剂的催化效率:实验i
②T1
Ⅱ.在2L的恒温密闭容器中通入5molO2并加入足量Cu2S发生反应:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H1=-271.4kJ/mol,反应过程中某气体的体积分数随时间变化如图所示。

(3)反应前2min平均反应速率v(SO2)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】目前人们对环境保护、新能源开发很重视。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中的氮氧化物NOx,可用CH4催化还原,消除氮氧化物的污染。
已知:
①CH4(g)+ 2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-860.0kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH=-860.0kJ·mol-1
②2NO2(g) N2O4(g) ΔH =-66.9 kJ·mol-1
N2O4(g) ΔH =-66.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式:_________ 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)的容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)的容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该正反应为_______ (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率 (NO)
(NO)________ 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
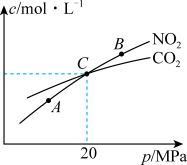
①A.B两点的浓度平衡常数关系:Kc(A)=______ Kc(B)(填“>”、“<”或“=”)。
②A、B、C三点中NO2的转化率最低的是_____ (填“A”、“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=_____ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)实验室常用NaOH溶液吸收法处理NOx,反应的化学方程式如下(已知NO不能与NaOH溶液反应):
NO+ NO2 + 2NaOH=2NaNO2 + H2O 2NO2 +2NaOH=NaNO2+ NaNO3 + H2O
①若NOx(此时为NO和NO2的混合气体)能被NaOH溶液完全吸收,则x的取值范围为_______ 。
②1 mol NO2和溶质物质的量为1 mol的NaOH溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序为,___________ 。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中的氮氧化物NOx,可用CH4催化还原,消除氮氧化物的污染。
已知:
①CH4(g)+ 2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-860.0kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH=-860.0kJ·mol-1②2NO2(g)
 N2O4(g) ΔH =-66.9 kJ·mol-1
N2O4(g) ΔH =-66.9 kJ·mol-1写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式:
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)的容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)的容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.60 | 0.60 |
| n(NO )(乙容器,400℃)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO )(丙容器,T℃)/mol | 2.00 | 1.00 | 0.50 | 0.50 | 0.50 |
①该正反应为
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率
 (NO)
(NO)(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1 molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A.B两点的浓度平衡常数关系:Kc(A)=
②A、B、C三点中NO2的转化率最低的是
③计算C点时该反应的压强平衡常数Kp(C)=
(4)实验室常用NaOH溶液吸收法处理NOx,反应的化学方程式如下(已知NO不能与NaOH溶液反应):
NO+ NO2 + 2NaOH=2NaNO2 + H2O 2NO2 +2NaOH=NaNO2+ NaNO3 + H2O
①若NOx(此时为NO和NO2的混合气体)能被NaOH溶液完全吸收,则x的取值范围为
②1 mol NO2和溶质物质的量为1 mol的NaOH溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序为,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
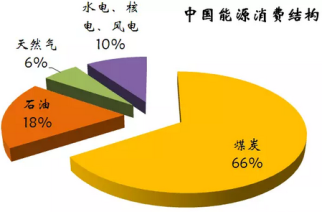
【推荐1】下图为我国目前的能源消费结构图:
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤炭为主,但直接燃烧煤炭的弊端是_____________________________________________ 。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:
根据以上数据,写出该反应的热化学方程式_____________________________ ;
(3)直接燃烧水煤气的能量利用率远远低于燃料电池,请写出碱性水煤气燃料电池的负极反应式________________________ ,______________________ 。
(4)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用H2、CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
在体积一定的密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______ 。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g) 的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v正_______ v逆(填“> ”、“= ”或“< ")。
(6)在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t变化曲线I如图所示,若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。
当曲线I变为曲线II时,改变的条件可能是________ 。当曲线I变为曲线III时,改变的条件可能是________ 。
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤炭为主,但直接燃烧煤炭的弊端是
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:

根据以上数据,写出该反应的热化学方程式
(3)直接燃烧水煤气的能量利用率远远低于燃料电池,请写出碱性水煤气燃料电池的负极反应式
(4)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用H2、CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度 | |
| 500 | 800 | ||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)  H2O(g)+ CO(g) H2O(g)+ CO(g) | K2 | 1.00 | 2.5 |
③3H2(g)+CO2(g)  CH3OH(g)+ H2O(g) CH3OH(g)+ H2O(g) | K3 | ||
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g) 的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v正
(6)在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t变化曲线I如图所示,若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。

当曲线I变为曲线II时,改变的条件可能是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】黄铁矿的主要成分是FeS2,其中含有一定量的铜、钴等金属。某工厂在传统回收工艺的基础上进一步改进焙烧方式,研究出高效利用硫铁矿资源的工艺如下:
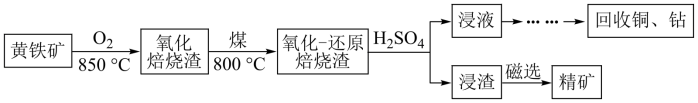
(1)黄铁矿焙烧之前需要粉碎,其目的是:_______
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是 ,反应的化学方程式为:
,反应的化学方程式为:_______ ;
②制硫酸工艺中涉及反应2SO2+O2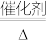 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是_______ 。
(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为_______ (填化学式);浸液通过加入萃取剂可实现铜和钴的分离,在萃取前加入NaOH溶液乳化可提高分离效率,不同浓度的溶液对萃取率的影响如图,则NaOH溶液最佳的浓度为_______ 。
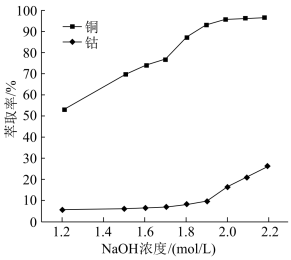
已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为_______ (结果保留三位有效数字)。

(1)黄铁矿焙烧之前需要粉碎,其目的是:
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是
 ,反应的化学方程式为:
,反应的化学方程式为:②制硫酸工艺中涉及反应2SO2+O2
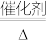 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为

已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为
| 项目 | Fe | S | Cu | Co |
| 焙烧前(%) | 40.28 | 42.55 | 0.53 | 0.022 |
| 焙烧后(%) | 53.08 | 0.96 | 0.76 | 0.047 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】丙烯是三大合成材料的基本原料之一,可用于生产多种重要有机化工原料。由丙烷制丙烯的两种方法如下:
Ⅰ. 丙烷氧化脱氢法:
Ⅱ. 丙烷无氧脱氢法:

请回答下列问题:
(1)已知
 ,由此计算
,由此计算
_______  。
。
(2)在催化剂作用下, 氧化脱氢除生成
氧化脱氢除生成 外,还生成CO、
外,还生成CO、 等物质。
等物质。 的转化率和
的转化率和 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。

①图中 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是_______ 。
②在550℃时, 的选择性为
的选择性为_______ 。(保留1位小数)( 的选择性
的选择性 )。
)。
③ 的选择性:550℃
的选择性:550℃_______ 575℃(填“大于”或“小于”)。
(3)某温度下,在刚性密闭容器中充入 发生无氧脱氢制备丙烯。
发生无氧脱氢制备丙烯。
①下列能说明该反应达到平衡状态的是_______ 。
a.
b.容器内气体的密度不再发生变化
c.容器内气体平均相对分子质量不再变化
d.容器内的压强不再发生变化
②若起始时容器内压强为 ,反应达平衡后总压为
,反应达平衡后总压为 ,则
,则 的平衡转化率为
的平衡转化率为_______ ,该反应的压强平衡常数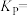
_______  (保留1位小数)。
(保留1位小数)。
Ⅰ. 丙烷氧化脱氢法:

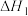
Ⅱ. 丙烷无氧脱氢法:


请回答下列问题:
(1)已知

 ,由此计算
,由此计算
 。
。(2)在催化剂作用下,
 氧化脱氢除生成
氧化脱氢除生成 外,还生成CO、
外,还生成CO、 等物质。
等物质。 的转化率和
的转化率和 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。
①图中
 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是②在550℃时,
 的选择性为
的选择性为 的选择性
的选择性 )。
)。③
 的选择性:550℃
的选择性:550℃(3)某温度下,在刚性密闭容器中充入
 发生无氧脱氢制备丙烯。
发生无氧脱氢制备丙烯。①下列能说明该反应达到平衡状态的是
a.

b.容器内气体的密度不再发生变化
c.容器内气体平均相对分子质量不再变化
d.容器内的压强不再发生变化
②若起始时容器内压强为
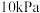 ,反应达平衡后总压为
,反应达平衡后总压为 ,则
,则 的平衡转化率为
的平衡转化率为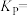
 (保留1位小数)。
(保留1位小数)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(1)在25℃、101kPa时

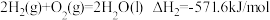
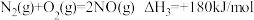
则NO与NH3反应生成惰性氮的热化学方程式为___________ 。
II.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成: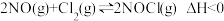 。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[
。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[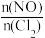 ]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
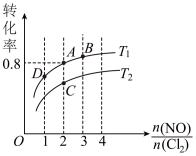
(2)图中T1、T2的关系为:T1___________ T2(填“>”、“<”或“=”)
(3)图中A、B、C、D四点对应的NOCl体积分数最大的是___________ 。
(4)若容器容积为2L,则A点的平衡常数为___________ 。
I.已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(1)在25℃、101kPa时

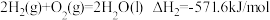
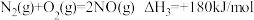
则NO与NH3反应生成惰性氮的热化学方程式为
II.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:
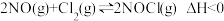 。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[
。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[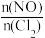 ]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
(2)图中T1、T2的关系为:T1
(3)图中A、B、C、D四点对应的NOCl体积分数最大的是
(4)若容器容积为2L,则A点的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】回答下列问题:
(1)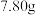 乙炔(
乙炔( )气体完全燃烧生成二氧化碳和液态水,放出
)气体完全燃烧生成二氧化碳和液态水,放出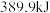 的热量,写出反应的热化学方程式
的热量,写出反应的热化学方程式___________ 。
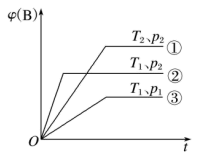
(2)已知某可逆反应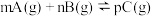 在密闭容器中进行,如图表示在不同反应时间
在密闭容器中进行,如图表示在不同反应时间 时,温度
时,温度 和压强
和压强 与反应物
与反应物 在混合气体中的体积分数
在混合气体中的体积分数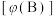 的关系曲线,根据图象分析:
的关系曲线,根据图象分析:
___________  ,
,
___________  ,
,
___________  ,该反应为
,该反应为___________ 反应(吸热或放热)。
(1)
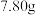 乙炔(
乙炔( )气体完全燃烧生成二氧化碳和液态水,放出
)气体完全燃烧生成二氧化碳和液态水,放出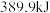 的热量,写出反应的热化学方程式
的热量,写出反应的热化学方程式(2)已知某可逆反应
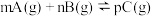 在密闭容器中进行,如图表示在不同反应时间
在密闭容器中进行,如图表示在不同反应时间 时,温度
时,温度 和压强
和压强 与反应物
与反应物 在混合气体中的体积分数
在混合气体中的体积分数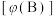 的关系曲线,根据图象分析:
的关系曲线,根据图象分析:
 ,
,
 ,
,
 ,该反应为
,该反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为____________________ ;此反应的逆反应△S__________ 0 (填﹤,﹥,﹦)。
(2)下列说法中能说明该反应达到了化学平衡状态的是___________________________ 。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后(稀有气体不参与反应),与之是等效平衡的是______________ 。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为___________________ kJ。
(5)已知:该反应的平衡常数随温度的变化如下表:
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为__________________ ℃。
 a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则(1)化学计量数a的值为
(2)下列说法中能说明该反应达到了化学平衡状态的是
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后(稀有气体不参与反应),与之是等效平衡的是
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为
(5)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 150 | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的△H_____ 0(填“大于”“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示,在0~60 s时段,反应速率v(N2O4)为____ mol·L﹣1·s﹣1反应的平衡常数K1=___ 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L﹣1·s﹣1的平均速率降低,经10 s又达到平衡。
①T______ 100℃(填“大于”“小于”),判断理由是______ 。
②温度T时反应的平衡常数K2=_______ 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向____ (填“正反应”或“逆反应”)方向移动,判断的理由是:________ 。
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是:________ .
 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L﹣1·s﹣1的平均速率降低,经10 s又达到平衡。
①T
②温度T时反应的平衡常数K2=
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是:
您最近一年使用:0次
【推荐2】为积极有效应对CO2引起的全球气候变化问题。目前,我国科学实验微型监测数据对外开放共享,该数据有效提高了全球对碳循环过程的理论认识。请回答下列问题:
(1)某温度下有反应:
①CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1K1
CO2(g)+2H2O(g) △H1K1
②N2(g)+O2(g) 2NO(g) △H2 K2
2NO(g) △H2 K2
③2NO(g)+O2(g) 2NO2(g) △H3K3
2NO2(g) △H3K3
④CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H4K4
N2(g)+CO2(g)+2H2O(g) △H4K4
则△H4=__________ (用含△H1、△H2、△H3的代数式表示),K4=_________ (用含K1、K2、K3的代数式表示)。
(2)在某密闭容器中充入1 mol CH4(g)和2.4 mol NO2(g),发生如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H4<0。
N2(g)+CO2(g)+2H2O(g) △H4<0。
①若改变温度和压强,平衡体系中CO2(g)的物质的量分数如图所示:

下列关于温度和压强的关系判断正确的是__________ (填标号)
A. p1> p2> p3>p4T1>T2>T3>T4 B. p1<p2<p3<p4T1>T2>T3>T4
C. p1> p2> p3>p4T1<T2<T3<T4 D. p1<p2<p3<p4 T1<T2<T3<T4
②测得某温度下,体积为2 L的密闭容器中数据如下表所示:
0~4min内的平均速率v(H2O)=__________ mol·L-1·min-1;该温度下,化学反应的平衡常数K=__________ (保留到小数点后两位,下同);平衡时,NO2的转化率为__________ %。
(1)某温度下有反应:
①CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1K1
CO2(g)+2H2O(g) △H1K1②N2(g)+O2(g)
 2NO(g) △H2 K2
2NO(g) △H2 K2③2NO(g)+O2(g)
 2NO2(g) △H3K3
2NO2(g) △H3K3④CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) △H4K4
N2(g)+CO2(g)+2H2O(g) △H4K4则△H4=
(2)在某密闭容器中充入1 mol CH4(g)和2.4 mol NO2(g),发生如下反应:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) △H4<0。
N2(g)+CO2(g)+2H2O(g) △H4<0。①若改变温度和压强,平衡体系中CO2(g)的物质的量分数如图所示:

下列关于温度和压强的关系判断正确的是
A. p1> p2> p3>p4T1>T2>T3>T4 B. p1<p2<p3<p4T1>T2>T3>T4
C. p1> p2> p3>p4T1<T2<T3<T4 D. p1<p2<p3<p4 T1<T2<T3<T4
②测得某温度下,体积为2 L的密闭容器中数据如下表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 |
| n(CH4)/mol | 1 | 0.6 | 0.4 | 0.3 | 0.3 |
| n(NO2)/mol | 2.4 | 1.6 | 1.2 | x | y |
0~4min内的平均速率v(H2O)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】异丁烯是一种重要的化工原料,主要用于生产橡胶、催化剂、汽油添加剂和润滑油等。工业上常用异丁烷为原料制备异丁烯。回答下列问题:
(1)异丁烷直接脱氢制备异丁烯,反应为
 。根据下列键能数据,计算该反应的
。根据下列键能数据,计算该反应的
___________  。
。
(2)异丁烷的转化率和异丁烯的选择性[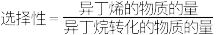 ]随温度的变化如图所示。当温度升高,异丁烯的选择性变化的原因是___________(填标号)。
]随温度的变化如图所示。当温度升高,异丁烯的选择性变化的原因是___________(填标号)。
(3)在温度853K、压强100kPa下,初始反应气体组成 或
或 与平衡时异丁烷摩尔分数x的关系如图所示。
与平衡时异丁烷摩尔分数x的关系如图所示。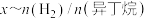 的曲线为
的曲线为___________ (填“M”或“N”)。
②a点反应的平衡常数
___________ kPa(列出计算式,分压=总压×物质的量分数)。
(4)有人提出加入适量空气,采用异丁烷氧化脱氢制备异丁烯,反应为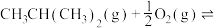
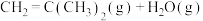
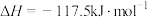 ,与异丁烷直接脱氢制备异丁烯相比,该方法的优缺点有
,与异丁烷直接脱氢制备异丁烯相比,该方法的优缺点有___________ 。
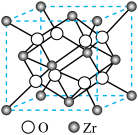
(5)一种 基催化剂可高效催化异丁烷直接脱氢制备异丁烯。四方
基催化剂可高效催化异丁烷直接脱氢制备异丁烯。四方 晶胞如图所示,晶胞参数为a pm、a pm、c pm。
晶胞如图所示,晶胞参数为a pm、a pm、c pm。 离子在晶胞中的配位数是
离子在晶胞中的配位数是___________ ,该晶体的密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)异丁烷直接脱氢制备异丁烯,反应为

 。根据下列键能数据,计算该反应的
。根据下列键能数据,计算该反应的
 。
。| 化学键 |  |  |  |  |
键能/( ) ) | 348 | 615 | 413 | 436 |
(2)异丁烷的转化率和异丁烯的选择性[
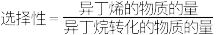 ]随温度的变化如图所示。当温度升高,异丁烯的选择性变化的原因是___________(填标号)。
]随温度的变化如图所示。当温度升高,异丁烯的选择性变化的原因是___________(填标号)。
| A.催化剂的活性增大 | B.异丁烷裂解发生副反应 |
| C.异丁烯容易发生聚合反应 | D.平衡向逆反应方向移动 |
(3)在温度853K、压强100kPa下,初始反应气体组成
 或
或 与平衡时异丁烷摩尔分数x的关系如图所示。
与平衡时异丁烷摩尔分数x的关系如图所示。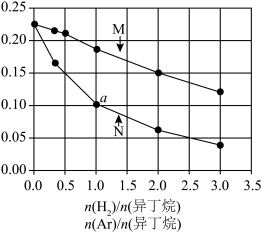
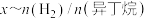 的曲线为
的曲线为②a点反应的平衡常数

(4)有人提出加入适量空气,采用异丁烷氧化脱氢制备异丁烯,反应为
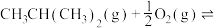
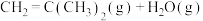
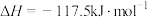 ,与异丁烷直接脱氢制备异丁烯相比,该方法的优缺点有
,与异丁烷直接脱氢制备异丁烯相比,该方法的优缺点有(5)一种
 基催化剂可高效催化异丁烷直接脱氢制备异丁烯。四方
基催化剂可高效催化异丁烷直接脱氢制备异丁烯。四方 晶胞如图所示,晶胞参数为a pm、a pm、c pm。
晶胞如图所示,晶胞参数为a pm、a pm、c pm。 离子在晶胞中的配位数是
离子在晶胞中的配位数是 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次



