有色金属冶炼废水中的砷元素主要以亚砷酸(H3AsO3)和砷酸(H3AsO4)形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:

查阅资料:
①可将废水中的砷元素转化为Ca5(AsO4)3OH沉淀,从而脱离液相体系。
②氢氧化钙的溶解度随温度升高而减小。
③亚砷酸(H3AsO3)不稳定,在溶液中加热就会分解。
(1)“氧化”过程中氧化产物为____ ,“废渣”的主要成分是:____ 。
(2)流程中可循环利用的物质为____ 。
(3)先“碱浸”“沉砷”后“酸化”的目的是____ 。
(4)“还原”发生反应的化学方程式为____ 。
(5)研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高,沉淀率下降的原因____ 。
(6)查阅资料,As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图象分析,“结晶”的具体操作是____ 。


查阅资料:
①可将废水中的砷元素转化为Ca5(AsO4)3OH沉淀,从而脱离液相体系。
②氢氧化钙的溶解度随温度升高而减小。
③亚砷酸(H3AsO3)不稳定,在溶液中加热就会分解。
(1)“氧化”过程中氧化产物为
(2)流程中可循环利用的物质为
(3)先“碱浸”“沉砷”后“酸化”的目的是
(4)“还原”发生反应的化学方程式为
(5)研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高,沉淀率下降的原因
(6)查阅资料,As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图象分析,“结晶”的具体操作是

更新时间:2022-06-15 11:20:35
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】国家实施“青山绿水”工程,故加大力度研究脱硫以及“三废”处理技术意义重大。某工厂拟综合处理工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)和含 的废水,设计了如下流程:
的废水,设计了如下流程:

(1)固体1的成分为___________ (填化学式)。
(2)捕获剂所捕获的气体主要是___________ (填化学式)。
(3)气体1通入适量空气,其中NO与氧气的物质的量比最好是___________ 。
(4)用离子方程式表示由NaNO2溶液处理含 的废水时发生的反应:
的废水时发生的反应:___________ ,当2mol 参加反应时,转移的电子数目为
参加反应时,转移的电子数目为___________ 。
(5)NaNO2在肉类制品加工中常用作发色剂和防腐剂,但是 易被酸性KMnO4溶液或氧气氧化。甲同学为了测定实验室的NaNO2的纯度,称取样品2.0g溶于水并将它配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L的酸性KMnO4溶液进行反应,消耗KMnO4溶液10.00mL,则样品中NaNO2的质量分数为
易被酸性KMnO4溶液或氧气氧化。甲同学为了测定实验室的NaNO2的纯度,称取样品2.0g溶于水并将它配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L的酸性KMnO4溶液进行反应,消耗KMnO4溶液10.00mL,则样品中NaNO2的质量分数为___________ (保留两位小数)。
 的废水,设计了如下流程:
的废水,设计了如下流程:
(1)固体1的成分为
(2)捕获剂所捕获的气体主要是
(3)气体1通入适量空气,其中NO与氧气的物质的量比最好是
(4)用离子方程式表示由NaNO2溶液处理含
 的废水时发生的反应:
的废水时发生的反应: 参加反应时,转移的电子数目为
参加反应时,转移的电子数目为(5)NaNO2在肉类制品加工中常用作发色剂和防腐剂,但是
 易被酸性KMnO4溶液或氧气氧化。甲同学为了测定实验室的NaNO2的纯度,称取样品2.0g溶于水并将它配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L的酸性KMnO4溶液进行反应,消耗KMnO4溶液10.00mL,则样品中NaNO2的质量分数为
易被酸性KMnO4溶液或氧气氧化。甲同学为了测定实验室的NaNO2的纯度,称取样品2.0g溶于水并将它配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L的酸性KMnO4溶液进行反应,消耗KMnO4溶液10.00mL,则样品中NaNO2的质量分数为
您最近一年使用:0次
【推荐2】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是__ 。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有__ (填化学性质)。
②如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:__ 。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
__ Fe(OH)3+__ ClO-+__ =__ FeO42-+__ Cl-+__
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是__ ,操作I用到的玻璃仪器有烧杯、玻璃棒和__ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为__ 。
③上述流程中操作III包括__ 、__ 、过滤、洗涤。
(1)所含铁元素只有还原性的物质是
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有
②如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作III包括
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组为测定黑木耳中的含铁量,进行了如下实验。
【铁元素的分离】
(1)高温灼烧黑木耳,使之完全灰化。用足量的硫酸充分溶解,过滤,得滤液。用铁氰化钾溶液检验发现滤液中也存在 ,请用离子方程式说明检验原理
,请用离子方程式说明检验原理_______ 。
【铁元素含量测定】
研学小组提出以下两种测定方案。
Ⅰ.沉淀法:
(2)向(1)中的滤液中加入足量NaOH溶液,过滤、洗涤沉淀、充分加热至恒重、称量。充分加热至恒重前发生的氧化还原反应方程式为_______ 。
Ⅱ.比色法:
方法:
步骤1:取10 mL a mol/L标准 溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;
溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;
步骤2:将混合液定容至100 mL得到溶液X,再用色度传感器测定其对光的吸收率;
步骤3:改变标准 溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准
溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准 溶液浓度的关系)如下图所示:
溶液浓度的关系)如下图所示:
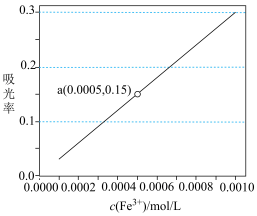
(3)用比色法估测(1)中的滤液中铁元素含量的操作如下:取10 mL(1)中的滤液,再加_______ ,混合均匀,再定容至100 mL,所得溶液颜色与标准色阶比对,即可测得10 mL滤液中铁元素含量。
(4)若(1)中取9 g黑木耳处理后得到15 mL滤液,按照比色法测得吸光率为上图中a点,则9g黑木耳中含铁元素的质量为_______ 。
(5)若将步骤1中的标准 溶液与(3)中的滤液用量均减少为原来的
溶液与(3)中的滤液用量均减少为原来的 ,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量
,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量_______ 。(填“偏高”、“偏低”或“不变”)
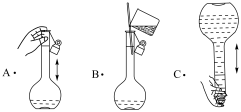
(6)用容量瓶配制a mol/L标准 溶液的部分操作如下,其中正确的是
溶液的部分操作如下,其中正确的是_______ ,若定容时仰视读数,则测得的黑木耳中铁元素的含量_______ 。(填“偏高”、“偏低”或“不变”)
【铁元素的分离】
(1)高温灼烧黑木耳,使之完全灰化。用足量的硫酸充分溶解,过滤,得滤液。用铁氰化钾溶液检验发现滤液中也存在
 ,请用离子方程式说明检验原理
,请用离子方程式说明检验原理【铁元素含量测定】
研学小组提出以下两种测定方案。
Ⅰ.沉淀法:
(2)向(1)中的滤液中加入足量NaOH溶液,过滤、洗涤沉淀、充分加热至恒重、称量。充分加热至恒重前发生的氧化还原反应方程式为
Ⅱ.比色法:
方法:
步骤1:取10 mL a mol/L标准
 溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;
溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;步骤2:将混合液定容至100 mL得到溶液X,再用色度传感器测定其对光的吸收率;
步骤3:改变标准
 溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准
溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准 溶液浓度的关系)如下图所示:
溶液浓度的关系)如下图所示:
(3)用比色法估测(1)中的滤液中铁元素含量的操作如下:取10 mL(1)中的滤液,再加
(4)若(1)中取9 g黑木耳处理后得到15 mL滤液,按照比色法测得吸光率为上图中a点,则9g黑木耳中含铁元素的质量为
(5)若将步骤1中的标准
 溶液与(3)中的滤液用量均减少为原来的
溶液与(3)中的滤液用量均减少为原来的 ,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量
,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量(6)用容量瓶配制a mol/L标准
 溶液的部分操作如下,其中正确的是
溶液的部分操作如下,其中正确的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】一氧化碳是一种重要的工业原料,以下是利用一氧化碳大规模制取氢气的方法:
 。
。
(1)欲提高CO的平衡转化率,理论上可以采取的措施为_______。
(2)800℃时,该反应的平衡常数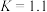 ,在容积为1L的密闭容器中进行反应,测得某一时刻混合物中CO、
,在容积为1L的密闭容器中进行反应,测得某一时刻混合物中CO、 、
、 、
、 的物质的量分别为1mol、1mol、3mol、1mol。
的物质的量分别为1mol、1mol、3mol、1mol。
①写出该反应的平衡常数表达式
_______ 。
②该时刻反应_______ (填“正向进行”“逆向进行”或“达平衡”)。
(3)830℃时,该反应的平衡常数 ,在容积为2L的密闭容器中,将2molCO与
,在容积为2L的密闭容器中,将2molCO与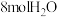 混合加热到830℃,反应达平衡时CO的转化率为
混合加热到830℃,反应达平衡时CO的转化率为_______ 。
(4)下图表示不同温度条件下,CO平衡转化率随着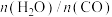 的变化趋势。
的变化趋势。 、
、 和
和 的大小关系是
的大小关系是_______ ,请说明理由_______ 。

(5)实验发现,其它条件不变,在相同时间内,向反应体系中投入一定量的CaO可以增大 的体积分数,实验结果如下图所示。(已知:1微米
的体积分数,实验结果如下图所示。(已知:1微米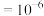 米,1纳米
米,1纳米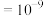 米)。
米)。

投入纳米CaO比微米CaO, 的体积分数更高的原因是
的体积分数更高的原因是_______ 。

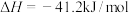 。
。(1)欲提高CO的平衡转化率,理论上可以采取的措施为_______。
| A.升高温度 | B.增大压强 |
C.通入过量 | D.加入催化剂 |
(2)800℃时,该反应的平衡常数
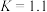 ,在容积为1L的密闭容器中进行反应,测得某一时刻混合物中CO、
,在容积为1L的密闭容器中进行反应,测得某一时刻混合物中CO、 、
、 、
、 的物质的量分别为1mol、1mol、3mol、1mol。
的物质的量分别为1mol、1mol、3mol、1mol。①写出该反应的平衡常数表达式

②该时刻反应
(3)830℃时,该反应的平衡常数
 ,在容积为2L的密闭容器中,将2molCO与
,在容积为2L的密闭容器中,将2molCO与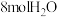 混合加热到830℃,反应达平衡时CO的转化率为
混合加热到830℃,反应达平衡时CO的转化率为(4)下图表示不同温度条件下,CO平衡转化率随着
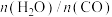 的变化趋势。
的变化趋势。 、
、 和
和 的大小关系是
的大小关系是
(5)实验发现,其它条件不变,在相同时间内,向反应体系中投入一定量的CaO可以增大
 的体积分数,实验结果如下图所示。(已知:1微米
的体积分数,实验结果如下图所示。(已知:1微米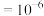 米,1纳米
米,1纳米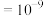 米)。
米)。
投入纳米CaO比微米CaO,
 的体积分数更高的原因是
的体积分数更高的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】合成氨反应[N2(g)+3H2(g)⇌2NH3(g)]是人工固氮的主要手段,对人类生存、社会进步和经济发展都有着重大意义。
回答下列问题:
(1)合成氨反应的反应历程和能量变化如图所示:
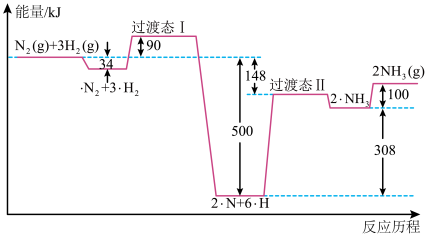
①N2(g)+3H2(g)⇌2NH3(g) △H=____________ 。
②对总反应速率影响较小的步骤的能垒(活化能)为_______ kJ/mol,该步骤的化学方程式为______________ 。
(2)一定温度下,向10 L恒容密闭容器中充入1 mol N2(g)和3 mol H2(g),发生合成氨反应。10 min末达到平衡,测得NH3的体积分数为60%。
①N2的平衡体积分数为___________ 。
②0~10 min内,用H2的浓度变化表示的平均反应速率v(H2)=_____________ 。
(3)合成氨反应中,正反应速率v正=k正●c(N2)●c3(H2),逆反应速率v逆=k逆●c2(NH3),k正、k逆为速率常数。正反应和逆反应的平衡常数与温度的关系如图所示:
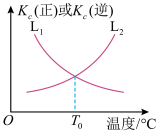
①表示逆反应的平衡常数与温度变化关系的曲线为_____ (填“L1”或 “L2"),理由为_________________ 。
②T0°C时,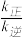 =
= _________________ 。
回答下列问题:
(1)合成氨反应的反应历程和能量变化如图所示:

①N2(g)+3H2(g)⇌2NH3(g) △H=
②对总反应速率影响较小的步骤的能垒(活化能)为
(2)一定温度下,向10 L恒容密闭容器中充入1 mol N2(g)和3 mol H2(g),发生合成氨反应。10 min末达到平衡,测得NH3的体积分数为60%。
①N2的平衡体积分数为
②0~10 min内,用H2的浓度变化表示的平均反应速率v(H2)=
(3)合成氨反应中,正反应速率v正=k正●c(N2)●c3(H2),逆反应速率v逆=k逆●c2(NH3),k正、k逆为速率常数。正反应和逆反应的平衡常数与温度的关系如图所示:

①表示逆反应的平衡常数与温度变化关系的曲线为
②T0°C时,
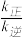 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】2023年全国政府工作报告中指出要继续推进重点领域节能降碳。 还原
还原 是实现降碳减排的有效途径之一,相关反应如下:
是实现降碳减排的有效途径之一,相关反应如下:
Ⅰ.

Ⅱ.
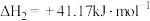
(1)反应Ⅲ: 的
的
_____ 
(2)恒温条件下,向某容器中充入一定量的 和
和 ,发生反应Ⅲ,测得各组分物质的量随时间变化如图
,发生反应Ⅲ,测得各组分物质的量随时间变化如图

①曲线C代表物质_____ 。
②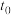 时刻达到平衡,该过程
时刻达到平衡,该过程_____ (填“放出”或“吸收”)热量_____  。
。
③向体积均为2.0L的甲乙两密闭容器中充入 和
和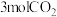 ,分别在
,分别在 、
、 温度下发生反应Ⅲ,甲、乙两容器中
温度下发生反应Ⅲ,甲、乙两容器中 的物质的量随时间的变化如下表:
的物质的量随时间的变化如下表:
i.能判断该反应已达到化学反应限度的标志是_____ (填字母)。
A.容器中混合气体的密度保持不变
B.容器中 与
与 浓度之比为
浓度之比为
C.容器中混合气体的平均相对分子质量保持不变
D. 的生成速率是
的生成速率是 的消耗速率的4倍
的消耗速率的4倍
ii.甲乙两容器的温度
_____  (填“>”“<”或“=”),甲容器中0~3min内用
(填“>”“<”或“=”),甲容器中0~3min内用 表示的平均反应速率为
表示的平均反应速率为_____ 。
iii.若要加快反应速率,可采取的措施是_____ (一条即可)。
 还原
还原 是实现降碳减排的有效途径之一,相关反应如下:
是实现降碳减排的有效途径之一,相关反应如下:Ⅰ.


Ⅱ.

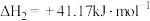
(1)反应Ⅲ:
 的
的

(2)恒温条件下,向某容器中充入一定量的
 和
和 ,发生反应Ⅲ,测得各组分物质的量随时间变化如图
,发生反应Ⅲ,测得各组分物质的量随时间变化如图
①曲线C代表物质
②
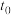 时刻达到平衡,该过程
时刻达到平衡,该过程 。
。③向体积均为2.0L的甲乙两密闭容器中充入
 和
和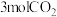 ,分别在
,分别在 、
、 温度下发生反应Ⅲ,甲、乙两容器中
温度下发生反应Ⅲ,甲、乙两容器中 的物质的量随时间的变化如下表:
的物质的量随时间的变化如下表:| t/min | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器 | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器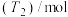 | 0 | 0.24 | 0.45 | 0.62 | 0.73 | 0.73 |
A.容器中混合气体的密度保持不变
B.容器中
 与
与 浓度之比为
浓度之比为
C.容器中混合气体的平均相对分子质量保持不变
D.
 的生成速率是
的生成速率是 的消耗速率的4倍
的消耗速率的4倍ii.甲乙两容器的温度

 (填“>”“<”或“=”),甲容器中0~3min内用
(填“>”“<”或“=”),甲容器中0~3min内用 表示的平均反应速率为
表示的平均反应速率为iii.若要加快反应速率,可采取的措施是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】NaNO2可用作食品添加剂。NaNO2能发生以下反应:3NO2-+2H+=NO3-+2NO↑+H2O
NO2-+Ag+=AgNO2↓(淡黄色)
某化学兴趣小组进行以下探究。回答有关问题:
(l)制取NaNO2反应原理:Na2CO3+2NO2=NaNO2+NaNO3+CO2 Na2CO3+NO+NO2=2NaNO2+CO2
用下图所示装置进行实验。

①铜与浓硝酸反应的化学方程式为______________________________ 。
②实验过程中,需控制B中溶液的pH>7,否则产率会下降,理由是_________ 。
③往C中通入空气的目的是____________________ (用化学方程式表示)。
④反应结束后,B中溶液经蒸发浓缩、冷却结晶、___________ 等操作,可得到粗产品晶体和母液。
(2)测定粗产品中NaNO2的含量
称取5.000g粗产品,溶解后稀释至250mL。取出25.00 mL溶液,用0.1000 mol·L-1KMNO4酸性溶液平行滴定三次,平均消耗的体积为20.00mL。已知:2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O
①稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有_________ (填标号)。
A.容量瓶 B.量筒 C.胶头滴管 D.锥形瓶
②当观察到_________________ 时,滴定达到终点。
③粗产品中NaNO2的质量分数为____________ (用代数式表示)。
NO2-+Ag+=AgNO2↓(淡黄色)
某化学兴趣小组进行以下探究。回答有关问题:
(l)制取NaNO2反应原理:Na2CO3+2NO2=NaNO2+NaNO3+CO2 Na2CO3+NO+NO2=2NaNO2+CO2
用下图所示装置进行实验。

①铜与浓硝酸反应的化学方程式为
②实验过程中,需控制B中溶液的pH>7,否则产率会下降,理由是
③往C中通入空气的目的是
④反应结束后,B中溶液经蒸发浓缩、冷却结晶、
(2)测定粗产品中NaNO2的含量
称取5.000g粗产品,溶解后稀释至250mL。取出25.00 mL溶液,用0.1000 mol·L-1KMNO4酸性溶液平行滴定三次,平均消耗的体积为20.00mL。已知:2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O
①稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有
A.容量瓶 B.量筒 C.胶头滴管 D.锥形瓶
②当观察到
③粗产品中NaNO2的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

回答下列问题:
(1)在95℃“溶浸”时,主要反应的化学方程式为______ ,产生的气体在“吸收”中反应的化学方程式为__________________ 。
(2)“溶浸”剂用(NH4)2SO4溶液比用H2SO4溶液的优点是____________ 。
(3)根据H3BO3的解离反应:H3BO3+H2O H++B(OH)
H++B(OH) ,K=5.81×10-10,可判断H3BO3是
,K=5.81×10-10,可判断H3BO3是______ 酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______ 。
(4)在“沉镁”中生成Mg(OH)2 MgCO3沉淀的离子方程式为_______ ,母液经加热后可返回_____ 工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_______ 。

回答下列问题:
(1)在95℃“溶浸”时,主要反应的化学方程式为
(2)“溶浸”剂用(NH4)2SO4溶液比用H2SO4溶液的优点是
(3)根据H3BO3的解离反应:H3BO3+H2O
 H++B(OH)
H++B(OH) ,K=5.81×10-10,可判断H3BO3是
,K=5.81×10-10,可判断H3BO3是(4)在“沉镁”中生成Mg(OH)2 MgCO3沉淀的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以镍黄铁矿为原料制备Ni(OH)2的工艺流程如下:

已知:①高镍锍的主要成分为Ni、Fe、Co、Cu的低价硫化物及合金:
②氧化性:Ni3+>Co3+>H2O2>Fe3+;
③ ,
, ,
,
回答下列问题:
(1)“酸浸”时,H2SO4溶液需过量,其目的是___________ ;
(2)“过滤”时滤渣1的主要成分___________ ;
(3)结合化学用语解释“除铁”的原理是___________ ;
(4)“除钴”时,发生反应的离子方程式为___________ ;
(5)“沉镍”后需过滤、洗涤,过滤沉淀所需的玻璃仪器有烧杯、___________ ,若“沉镍”后的滤液中 ,则滤液的pH>
,则滤液的pH>___________ ;
(6)Ni(OH)2可用于制备镍氢电池。该电池是以金属氢化物为负极,氢氧化镍电极为正极,氢氧化钾溶液为电解液,电池反应为MH+NiOOH=M+Ni(OH)2,该电池的负极反应式为___________ 。

已知:①高镍锍的主要成分为Ni、Fe、Co、Cu的低价硫化物及合金:
②氧化性:Ni3+>Co3+>H2O2>Fe3+;
③
 ,
, ,
,
回答下列问题:
(1)“酸浸”时,H2SO4溶液需过量,其目的是
(2)“过滤”时滤渣1的主要成分
(3)结合化学用语解释“除铁”的原理是
(4)“除钴”时,发生反应的离子方程式为
(5)“沉镍”后需过滤、洗涤,过滤沉淀所需的玻璃仪器有烧杯、
 ,则滤液的pH>
,则滤液的pH>(6)Ni(OH)2可用于制备镍氢电池。该电池是以金属氢化物为负极,氢氧化镍电极为正极,氢氧化钾溶液为电解液,电池反应为MH+NiOOH=M+Ni(OH)2,该电池的负极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】纳米铁可用作特殊的催化剂,以FeSO4饱和溶液为原料制取纳米铁的工艺流程如图所示。
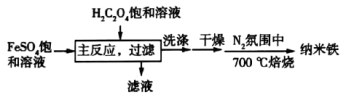
已知:主反应在80℃左右条件下进行,直至得到黄色(FeC2O4•2H2O)沉淀。
(1)实验室中FeSO4溶液在保存时需要加入少量铁粉,原因是___ 。
(2)写出进行“主反应”的化学方程式___ ,为了保证主反应的顺利进行,可以采取的加热方式是__ 。
(3)能够确定沉淀洗涤干净的操作和现象是__ 。
(4)写出焙烧过程中发生反应的化学方程式__ 。
(5)若洗涤后所得晶体未进行干燥而直接焙烧,则最终得到的纳米铁中含有的杂质可能为___ 。

已知:主反应在80℃左右条件下进行,直至得到黄色(FeC2O4•2H2O)沉淀。
(1)实验室中FeSO4溶液在保存时需要加入少量铁粉,原因是
(2)写出进行“主反应”的化学方程式
(3)能够确定沉淀洗涤干净的操作和现象是
(4)写出焙烧过程中发生反应的化学方程式
(5)若洗涤后所得晶体未进行干燥而直接焙烧,则最终得到的纳米铁中含有的杂质可能为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Li2CO3可用于制备锂电池的正极材料LiCoO2,以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、MnO、MgF2等杂质)制备Li2CO3。
已知:①Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=2×10-13、Ksp[Mg(OH)2]=1.2×10-11、Ksp[Al(OH)3]=1.0×10-33。
②Co3O4、CoO均难溶于水。Co3O4难溶于酸,CoO能溶于酸中。
③当溶液中的离子浓度小于10-5mol/L时,已完全沉淀。
④部分物质的溶解度曲线见图。

利用锂云母矿石制备Li2CO3步骤如下:
(1)酸浸。向锂云母矿石中加入30%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是_______ 。

(2)调pH。向酸浸后的溶液中加入NaOH溶液,调节pH约为6,过滤。再向滤液中继续滴加氢氧化钠溶液调pH>13,过滤,此时的滤渣主要成分为_______ 。分两次调节pH的主要原因是_______ 。
(3)沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。洗涤沉淀的方法是_______ ,浓缩液中离子浓度过大将在产品中引入_______ 杂质(填化学式)。
(4)Co3O4可由CoCO3热分解制备。CoCO3在有氧和无氧环境下的所得Co3O4和CoO的百分含量与温度关系如图所示。请补充完整由CoCO3制备较纯净的Co3O4实验方案,取一定质量的CoCO3于热解装置中,_______ ,干燥。(须使用的试剂和仪器有:1mol/LH2SO4,蒸馏水,BaCl2溶液)

已知:①Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=2×10-13、Ksp[Mg(OH)2]=1.2×10-11、Ksp[Al(OH)3]=1.0×10-33。
②Co3O4、CoO均难溶于水。Co3O4难溶于酸,CoO能溶于酸中。
③当溶液中的离子浓度小于10-5mol/L时,已完全沉淀。
④部分物质的溶解度曲线见图。

利用锂云母矿石制备Li2CO3步骤如下:
(1)酸浸。向锂云母矿石中加入30%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是

(2)调pH。向酸浸后的溶液中加入NaOH溶液,调节pH约为6,过滤。再向滤液中继续滴加氢氧化钠溶液调pH>13,过滤,此时的滤渣主要成分为
(3)沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。洗涤沉淀的方法是
(4)Co3O4可由CoCO3热分解制备。CoCO3在有氧和无氧环境下的所得Co3O4和CoO的百分含量与温度关系如图所示。请补充完整由CoCO3制备较纯净的Co3O4实验方案,取一定质量的CoCO3于热解装置中,

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为::
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的是______ 。
(2)写出从滤液A→沉淀D的离子反应方程式______ 。
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是______ 。
(4)用KMnO 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: 。现将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.1000mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00 mL。
。现将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.1000mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00 mL。
①此步操作过程中需要用到下列哪些仪器(填写序号)______ ;


②达到滴定终点时,溶液的颜色变化是______ ;
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将______ (填“偏高”、“偏低”、“无影响”)。
(5)原茶叶中钙元素的质量分数为______ 。
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是______ 。
 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为::
| 离子 |  |  |
| 完全沉淀时的pH | 13 | 4.1 |
(2)写出从滤液A→沉淀D的离子反应方程式
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是
(4)用KMnO
 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: 。现将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.1000mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00 mL。
。现将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.1000mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00 mL。①此步操作过程中需要用到下列哪些仪器(填写序号)


②达到滴定终点时,溶液的颜色变化是
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将
(5)原茶叶中钙元素的质量分数为
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是
您最近一年使用:0次



