MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如图所示。

金属离子成的pH:
(1)写出酸浸池中MnCO3溶解的离子方程式:____ 。
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加氨水时发生反应的离子方程式:____ 。
(3)沉淀池2中,____ (填“能”或“不能”)用NaOH代替含硫沉淀剂,原因是____ 。
(4)用酸性高锰酸钾溶液可以检验Mn2+,产生黑色沉淀,该反应的离子方程式为____ 。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下:
i.称取ωg废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于250mL容量瓶中;
ii.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用xmol·L-1(NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为ymL,MnO 重新转化成Mn2+。
重新转化成Mn2+。
①步骤iii中反应的离子方程式为____ 。
②废渣中锰元素的质量分数为___ 。
(6)电解MnSO4溶液可获得二氧化锰,电解后的废水中还含有Mn2+,可用碱性溶液进行沉降得到Mn(OH)2沉淀。欲使溶液中c(Mn2+)≤1.0×10-5mol·L-1,则应使溶液中c(OH-)≥____ mol·L-1。

金属离子成的pH:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀时的pH | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀时的pH | 2.8 | 8.3 | 94 | 10.2 |
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加氨水时发生反应的离子方程式:
(3)沉淀池2中,
(4)用酸性高锰酸钾溶液可以检验Mn2+,产生黑色沉淀,该反应的离子方程式为
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下:
i.称取ωg废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于250mL容量瓶中;
ii.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用xmol·L-1(NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为ymL,MnO
 重新转化成Mn2+。
重新转化成Mn2+。①步骤iii中反应的离子方程式为
②废渣中锰元素的质量分数为
(6)电解MnSO4溶液可获得二氧化锰,电解后的废水中还含有Mn2+,可用碱性溶液进行沉降得到Mn(OH)2沉淀。欲使溶液中c(Mn2+)≤1.0×10-5mol·L-1,则应使溶液中c(OH-)≥
更新时间:2022-07-12 19:51:06
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=2KBr+2MnBr2+8H2O+5Br2
①其中还原剂为_________ ,还原产物为_________ (均填化学式)
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为_________ ,转移电子的数目是_________
③用双线桥表示转移电子的数目_________ 。
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为_________ ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式_________
(3)次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,其电离方程式是:H3PO2⇌H++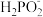 ,具有较强还原性,回答下列问题:
,具有较强还原性,回答下列问题:
①H3PO2中,磷元素的化合价为_________
②H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而用于化学镀银。利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:_________
A.PH3 B.H3PO3 C.P D.H3PO4
③NaH2PO2是正盐还是酸式盐?_________ ,其溶液显_________ 性(填弱酸性、中性、或者弱碱性)
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=2KBr+2MnBr2+8H2O+5Br2
①其中还原剂为
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为
③用双线桥表示转移电子的数目
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(3)次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,其电离方程式是:H3PO2⇌H++
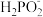 ,具有较强还原性,回答下列问题:
,具有较强还原性,回答下列问题:①H3PO2中,磷元素的化合价为
②H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而用于化学镀银。利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:
A.PH3 B.H3PO3 C.P D.H3PO4
③NaH2PO2是正盐还是酸式盐?
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4‧7H2O),再通过绿矾制备铁黄 [FeO(OH)]的流程如下:
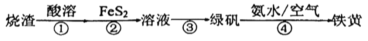
已知:步骤②涉及的离子反应为: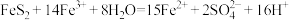
(1)步骤①中溶解烧渣的酸宜选用_______ (填“盐酸、硫酸或硝酸”)。
(2)步骤②中,每消耗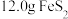 ,转移电子的物质的量为
,转移电子的物质的量为_______ mol。
(3)步骤②中, 可以用
可以用_______ 代替。
(4)步骤④中,若氨水浓度过大会使铁黄中混有_______ 杂质。
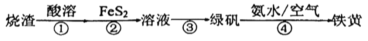
已知:步骤②涉及的离子反应为:
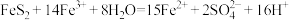
(1)步骤①中溶解烧渣的酸宜选用
(2)步骤②中,每消耗
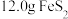 ,转移电子的物质的量为
,转移电子的物质的量为(3)步骤②中,
 可以用
可以用(4)步骤④中,若氨水浓度过大会使铁黄中混有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
Ⅰ.在2L密闭容器中,800℃时反应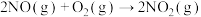 体系中,
体系中, 随时间的变化如表:
随时间的变化如表:
(1)用 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=____________ 。
(2)能说明该反应已达到平衡状态的是____________ (填序号)。
a. b.容器内压强保持不变 c.体系颜色不再改变 d.容器内密度保持不变
b.容器内压强保持不变 c.体系颜色不再改变 d.容器内密度保持不变
(3)转化反应 ,在
,在 的催化作用下反应历程可分为:
的催化作用下反应历程可分为:
第一步: ;
;
第二步: (将化学方程式补充完整)
(将化学方程式补充完整)___________________________ 。
(4)某种燃料电池的工作原理如图所示,a、b均为惰性电极。
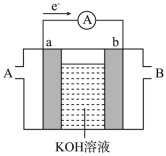
假设使用的“燃料”是甲醇,a极的电极反应式为___________________________ 。
Ⅰ.在2L密闭容器中,800℃时反应
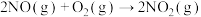 体系中,
体系中, 随时间的变化如表:
随时间的变化如表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用
 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=(2)能说明该反应已达到平衡状态的是
a.
 b.容器内压强保持不变 c.体系颜色不再改变 d.容器内密度保持不变
b.容器内压强保持不变 c.体系颜色不再改变 d.容器内密度保持不变(3)转化反应
 ,在
,在 的催化作用下反应历程可分为:
的催化作用下反应历程可分为:第一步:
 ;
;第二步:
 (将化学方程式补充完整)
(将化学方程式补充完整)(4)某种燃料电池的工作原理如图所示,a、b均为惰性电极。

假设使用的“燃料”是甲醇,a极的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)X原子的结构示意图为__ ,Z的基态原子的价电子排布式为__ ,其核外有__ 种能量状态的电子。
(2)写出M与R形成含有非极性键的离子化合物的电子式:__ 。
(3)在稀硫酸中,Z的最高价含氧酸的钾盐(K2Z2O7,橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的离子方程式是__ 。
(4)过氧化Z(ZO5)中Z的化合价为+6,O的化合价为-2(a个)和-1价(b个)。则a与b数目之比为___ 。
(5)已知氮化铬晶体的晶胞结构如图所示,如果N与Cr核间距离为apm,则氮化铬的密度为__ g•cm-3。(只要求列算式,不必计算数值)

(1)X原子的结构示意图为
(2)写出M与R形成含有非极性键的离子化合物的电子式:
(3)在稀硫酸中,Z的最高价含氧酸的钾盐(K2Z2O7,橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的离子方程式是
(4)过氧化Z(ZO5)中Z的化合价为+6,O的化合价为-2(a个)和-1价(b个)。则a与b数目之比为
(5)已知氮化铬晶体的晶胞结构如图所示,如果N与Cr核间距离为apm,则氮化铬的密度为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程
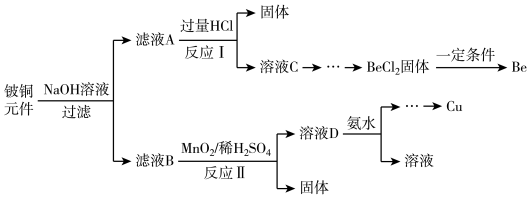
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________ 。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________ 。
②若用浓HNO3溶解金属硫化物,缺点是______________
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是_______________

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有
写出反应I中含铍化合物与过量盐酸反应的离子方程式
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式
②若用浓HNO3溶解金属硫化物,缺点是
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】四氧化三锰(Mn3O4)是电子工业的磁性材料。一种以氧化锰矿(含Mn2O3、MnOOH、Fe2O3、Al2O3、SiO2及CuO等)为原料制备Mn3O4的工艺流程如图:
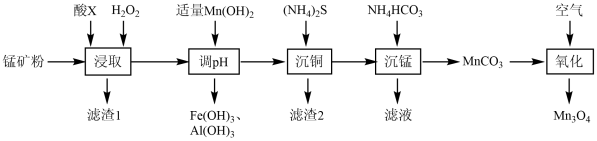
I.常温下,溶液中金属离子开始沉淀和沉淀完全的pH如表:
II.常温下,Ksp[Cu(OH)2]=2×10-20。
回答下列问题:
(1)①“浸取”过程中加入的酸X是_____ (填字母)。原因是_____ 。
A.硫酸 B.盐酸 C.硝酸
②加入H2O2的作用是_____ 。
(2)加入适量Mn(OH)2以除去溶液中的铁、铝元素,此时溶液中c(Cu2+)=2×10-3mol·L-1,则调节pH的范围为_____ 。
(3)“滤渣2”的主要成分是_____ (填化学式)。
(4)“沉锰”时发生反应的离子方程式为_____ ,“滤液”中溶质的主要成分是_____ (填化学式)。

I.常温下,溶液中金属离子开始沉淀和沉淀完全的pH如表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| 开始沉淀的pH | 7.8 | 6.5 | 1.5 | 3.3 |
| 沉淀完全的pH | 10.4 | 9.7 | 3.2 | 5.2 |
回答下列问题:
(1)①“浸取”过程中加入的酸X是
A.硫酸 B.盐酸 C.硝酸
②加入H2O2的作用是
(2)加入适量Mn(OH)2以除去溶液中的铁、铝元素,此时溶液中c(Cu2+)=2×10-3mol·L-1,则调节pH的范围为
(3)“滤渣2”的主要成分是
(4)“沉锰”时发生反应的离子方程式为
您最近一年使用:0次
【推荐2】将废旧锌锰电池进行回收处理以实现资源的再生利用,初步处理后的废料中含 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如图:
的一种工艺流程如图:

已知:①Mn的金属活动性强于Fe, 在酸性条件下比较稳定,pH大于5.5时易被氧化。
在酸性条件下比较稳定,pH大于5.5时易被氧化。
②相关物质的 数据如表所示。
数据如表所示。
回答下列问题:
(1)为加快“还原焙烧”时的反应速率,可采取的措施有_______ (填一条),该过程中生成的气体产物有 、
、 和
和________ (填化学式);“酸浸”后分离出滤渣1的操作名称为_________ 。
(2)已知,“净化”时溶液中 、
、 的物质的量浓度均约为
的物质的量浓度均约为 ,当金属离子的浓度小于
,当金属离子的浓度小于 时可认为该离子完全沉淀,则“净化”时调节
时可认为该离子完全沉淀,则“净化”时调节 的合理范围是
的合理范围是
___________ 。
(3)通过“电解”滤液2制备 和
和 ,若电路中转移
,若电路中转移 电子,溶液的
电子,溶液的 将
将___________ (填“增大”或“减小”)。
(4) 为两性氢氧化物,可溶于
为两性氢氧化物,可溶于 溶液,反应为
溶液,反应为
 ,其平衡常数
,其平衡常数
___________ {已知: 的平衡常数称为稳定平衡常数,
的平衡常数称为稳定平衡常数, 。
。
(5)在 条件下,
条件下, 和
和 按4:1的物质的量比发生反应制得
按4:1的物质的量比发生反应制得 ,同时产物还有
,同时产物还有 和
和 ,则该反应中n(氧化产物):n(还原产物)=
,则该反应中n(氧化产物):n(还原产物)=___________ ;以石墨和 为电极材料可制作可充电电池,该电池的总反应为
为电极材料可制作可充电电池,该电池的总反应为 ,充电时
,充电时 电极上发生的电极反应为
电极上发生的电极反应为___________ ,若此时电路中转移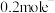 ,则石墨电极将增重
,则石墨电极将增重___________ g。
 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如图:
的一种工艺流程如图:
已知:①Mn的金属活动性强于Fe,
 在酸性条件下比较稳定,pH大于5.5时易被氧化。
在酸性条件下比较稳定,pH大于5.5时易被氧化。②相关物质的
 数据如表所示。
数据如表所示。| 化合物 |  |  |  |
 |  | 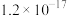 |  |
(1)为加快“还原焙烧”时的反应速率,可采取的措施有
 、
、 和
和(2)已知,“净化”时溶液中
 、
、 的物质的量浓度均约为
的物质的量浓度均约为 ,当金属离子的浓度小于
,当金属离子的浓度小于 时可认为该离子完全沉淀,则“净化”时调节
时可认为该离子完全沉淀,则“净化”时调节 的合理范围是
的合理范围是
(3)通过“电解”滤液2制备
 和
和 ,若电路中转移
,若电路中转移 电子,溶液的
电子,溶液的 将
将(4)
 为两性氢氧化物,可溶于
为两性氢氧化物,可溶于 溶液,反应为
溶液,反应为
 ,其平衡常数
,其平衡常数
 的平衡常数称为稳定平衡常数,
的平衡常数称为稳定平衡常数, 。
。(5)在
 条件下,
条件下, 和
和 按4:1的物质的量比发生反应制得
按4:1的物质的量比发生反应制得 ,同时产物还有
,同时产物还有 和
和 ,则该反应中n(氧化产物):n(还原产物)=
,则该反应中n(氧化产物):n(还原产物)= 为电极材料可制作可充电电池,该电池的总反应为
为电极材料可制作可充电电池,该电池的总反应为 ,充电时
,充电时 电极上发生的电极反应为
电极上发生的电极反应为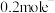 ,则石墨电极将增重
,则石墨电极将增重
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】镍钴锰酸锂电池是一种高功率动力电池。下列流程采用废旧锂离子电池正极材料(正极一般以铝箔作为基底,两侧均匀涂覆正极材料,正极材料包括一定配比的正极活性物质,如钴酸锂、磷酸铁锂、锰酸锂和三元材料等)制备镍钴锰酸锂三元正极材料( )
) )
)

回答下列问题:
(1)写出正极碱浸过程中的离子方程式:________________ ;能够提高碱浸效率的方法有____________ (至少写两种)。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_________________ 。
(3) 中
中 元素化合价为
元素化合价为_______________ ,其参与“还原”反应的离子方程式为___________ 。
(4)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是___________________ 。
(5)已知溶液中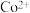 的浓度为
的浓度为 ,缓慢通入氨气,使其产生
,缓慢通入氨气,使其产生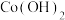 沉淀,列式计算
沉淀,列式计算 沉淀完全时溶液的
沉淀完全时溶液的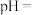
______________________ (已知离子沉淀完全时 ,溶液体积变化忽略不计)
,溶液体积变化忽略不计)
(6)写出“高温烧结固相合成”过程的化学方程式:____________________ 。
 )
) )
)
回答下列问题:
(1)写出正极碱浸过程中的离子方程式:
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是
(3)
 中
中 元素化合价为
元素化合价为(4)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是
(5)已知溶液中
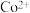 的浓度为
的浓度为 ,缓慢通入氨气,使其产生
,缓慢通入氨气,使其产生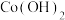 沉淀,列式计算
沉淀,列式计算 沉淀完全时溶液的
沉淀完全时溶液的
 ,溶液体积变化忽略不计)
,溶液体积变化忽略不计)(6)写出“高温烧结固相合成”过程的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如图所示

(1)杂质SiO2在“碱溶”时转化为难溶物铝硅酸钠(NaAlSiO4·nH2O),操作Ⅰ是__ ,用氧化物的形式表示铝硅酸钠的化学式__ 。
(2)溶液a中加入NaHCO3后,生成沉淀的离子方程式为__ 。
(3)工业上电解熔融Al2O3制备金属铝,阳极材料石墨在实际生产中其不断消耗,其原因是(用化学方程式表示)__ 。
(4)西湖边常有小商贩利用剪碎的易拉罐和一种白色固体及西湖的水混合后制售小氢气球,该反应方程式是___ 。

(1)杂质SiO2在“碱溶”时转化为难溶物铝硅酸钠(NaAlSiO4·nH2O),操作Ⅰ是
(2)溶液a中加入NaHCO3后,生成沉淀的离子方程式为
(3)工业上电解熔融Al2O3制备金属铝,阳极材料石墨在实际生产中其不断消耗,其原因是(用化学方程式表示)
(4)西湖边常有小商贩利用剪碎的易拉罐和一种白色固体及西湖的水混合后制售小氢气球,该反应方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】以软锰矿(含MnO2及少量Fe、Al、Si、Zn、Co的氧化物)为主要原料可制备MnO2、KMnO4等。制备MnO2的实验流程如下:
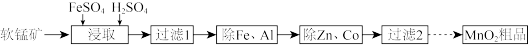
(1)“过滤1”所得滤液中的金属阳离子有Mn2+、Fe3+、Al3+、Fe2+、Co2+、Zn2+。生成Mn2+的离子方程式为_______ 。
(2)已知25℃时,Ksp(ZnS)=1.6×10-24,Ksp(CoS)=4.0×10-21,Ksp(MnS)=2.5×10-10。取一定量“除Fe、Al”后的酸性滤液,分析其中Zn2+、Co2+、Mn2+的含量[n(Zn2+)+n(Co2+)=amol]后,加入一定量Na2S充分反应。测得金属的沉淀率随加入n(Na2S)的变化如图所示。

①当n(Na2S)=amol时,测得溶液中c(Zn2+)=2.0×10-4mol/L,此时c(Co2+)=_______ 。
②当n(Na2S)=amol时,Co2+和Zn2+未完全沉淀的原因是_______ 。
(3)测定MnO2粗品的纯度。称取0.1450gMnO2粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量KI溶液。盖上玻璃塞,充分摇匀后静置30min。用0.1500mol/LNa2S2O3标准溶液滴定生成的I2,消耗Na2S2O3标准溶液20.00mL。滴定反应为2 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数_______ (写出计算过程)。
(4)将一定量的KClO3与稍过量KOH混合熔融,再分批加入一定量MnO2。在加热条件下迅速搅拌制得墨绿色K2MnO4。已知向K2MnO4碱性溶液中加酸会生成MnO2和KMnO4,在pH=9.5~10.5时,反应趋于完全。
①KClO3、KOH混合熔融时不能选用瓷坩埚的原因是_______ 。
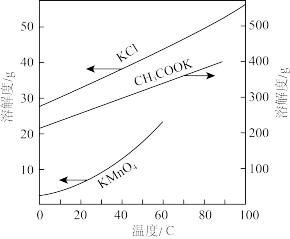
②请补充完整制取KMnO4晶体的实验方案:将墨绿色固体混合物加水溶解,_______ ,得KMnO4晶体。(实验中可选用试剂:6mol/LHCl、6mol/LCH3COOH、冰水。实验中须使用的实验仪器有:砂芯漏斗、pH计。部分物质溶解度曲线如图所示)
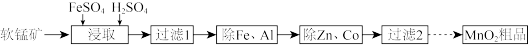
(1)“过滤1”所得滤液中的金属阳离子有Mn2+、Fe3+、Al3+、Fe2+、Co2+、Zn2+。生成Mn2+的离子方程式为
(2)已知25℃时,Ksp(ZnS)=1.6×10-24,Ksp(CoS)=4.0×10-21,Ksp(MnS)=2.5×10-10。取一定量“除Fe、Al”后的酸性滤液,分析其中Zn2+、Co2+、Mn2+的含量[n(Zn2+)+n(Co2+)=amol]后,加入一定量Na2S充分反应。测得金属的沉淀率随加入n(Na2S)的变化如图所示。

①当n(Na2S)=amol时,测得溶液中c(Zn2+)=2.0×10-4mol/L,此时c(Co2+)=
②当n(Na2S)=amol时,Co2+和Zn2+未完全沉淀的原因是
(3)测定MnO2粗品的纯度。称取0.1450gMnO2粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量KI溶液。盖上玻璃塞,充分摇匀后静置30min。用0.1500mol/LNa2S2O3标准溶液滴定生成的I2,消耗Na2S2O3标准溶液20.00mL。滴定反应为2
 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数(4)将一定量的KClO3与稍过量KOH混合熔融,再分批加入一定量MnO2。在加热条件下迅速搅拌制得墨绿色K2MnO4。已知向K2MnO4碱性溶液中加酸会生成MnO2和KMnO4,在pH=9.5~10.5时,反应趋于完全。
①KClO3、KOH混合熔融时不能选用瓷坩埚的原因是
②请补充完整制取KMnO4晶体的实验方案:将墨绿色固体混合物加水溶解,

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】硼镁泥是可贵的镁资源。硼镁泥的主要成分为 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备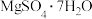 的工艺流程如图所示。
的工艺流程如图所示。

已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
③两种盐的溶解度曲线如图:

请回答下列问题:
(1)“酸浸”时,加入的酸为_______ (填名称),“酸浸”时,一般煮沸10min,这样做的目的是_______ 。
(2)“滤渣1”的主要成分为_______ (写化学式)。
(3)“滤渣2”中含有 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用_______ ,检验铁离子是否完全沉淀的操作为_______ 。
(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:_______ 、_______ 。
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、_______ ;“一系列操作”为_______ 、洗涤、干燥。
 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备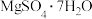 的工艺流程如图所示。
的工艺流程如图所示。
已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Fe2+ | Mg2+ |
| pH范围 | 1.5~2.8 | 3.4~4.7 | 8.1~10.1 | 6.3~8.3 | 9.9~11.9 |

请回答下列问题:
(1)“酸浸”时,加入的酸为
(2)“滤渣1”的主要成分为
(3)“滤渣2”中含有
 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、
您最近一年使用:0次




