某油脂厂废弃的油脂加氢反应的镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4:7H2O);

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)基态Ni2+的价电子排布式为_______ 。H2O2的结构如图所示,则H2O2中的O原子的杂化方式为_______ ,转化过程中的双氧水可用O3代替,O3的空间构型是_______ ,O3是_______ 分子(填“极性“或”非极性”)。

(2)“转化”过程宜控制较低温度的原因是_______ 。
(3)利用上述表格数据,计算Ni(OH)2的Ksp_______ 。如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是_______ 。
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式_______ 。

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
(1)基态Ni2+的价电子排布式为

(2)“转化”过程宜控制较低温度的原因是
(3)利用上述表格数据,计算Ni(OH)2的Ksp
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
更新时间:2022-07-23 07:13:54
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】学习小组探究了铜和浓硝酸的反应。
(1)铜与浓硝酸反应,装置如图,写出铜与浓硝酸反应的离子方程式___________ ;装置B的作用是___________ 。
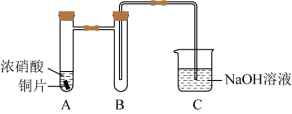
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
(2)依据实验1中的现象,判断猜想1不合理,理由是___________ 。
(3)取⑤中溶液,___________ (填操作和现象),证实猜想2成立。
小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
(4)结合上述实验现象,下列推测合理的是___________ (填字母序号)。
a. ①中溶液通入N2时,N2被缓慢氧化为NO2
b. ①中溶液含有某种与绿色有关的还原性微粒,通入空气时较快被氧化
c. 空气中的CO2溶于水显酸性,促进了溶液变蓝色
d. 加热溶液①后,可能观察到溶液变蓝的现象
小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii. NO2在溶液中存在:反应1:2NO2+H2O HNO3+HNO2,反应2:2HNO2
HNO3+HNO2,反应2:2HNO2 NO2+NO+H2O
NO2+NO+H2O
小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:
(5)取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
加入H2O2后溶液迅速变蓝,原因是H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3___________ ,___________ 。
(1)铜与浓硝酸反应,装置如图,写出铜与浓硝酸反应的离子方程式
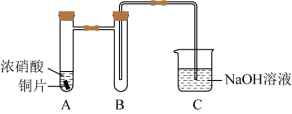
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
(2)依据实验1中的现象,判断猜想1不合理,理由是
(3)取⑤中溶液,
小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 | 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 |
(4)结合上述实验现象,下列推测合理的是
a. ①中溶液通入N2时,N2被缓慢氧化为NO2
b. ①中溶液含有某种与绿色有关的还原性微粒,通入空气时较快被氧化
c. 空气中的CO2溶于水显酸性,促进了溶液变蓝色
d. 加热溶液①后,可能观察到溶液变蓝的现象
小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii. NO2在溶液中存在:反应1:2NO2+H2O
 HNO3+HNO2,反应2:2HNO2
HNO3+HNO2,反应2:2HNO2 NO2+NO+H2O
NO2+NO+H2O小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:
(5)取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | 3滴30%H2O2溶液 | 3滴水 | |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】CuCl是见光容易分解的白色固体,难溶于水和乙醇,在潮湿的环境中易被氧化和水解。实验室制备CuCl的实验装置如下图所示,制取步骤如下:
①组装好整套实验装置,称取 的
的 晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
②在 左右向A装置中通入
左右向A装置中通入 气体,搅拌;
气体,搅拌;
③当A中溶液全部褪色,停止通 气体;
气体;
④实验结束后,先向A装置中加入适量蒸馏水,减压过滤(需避光),可得到CuCl粗产品;
⑤用乙醇洗涤CuCl粗产品,将产品在双层干燥器(分别装有浓硫酸和碱石灰)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品质量为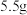 。
。
已知CuCl在溶液中存在如下平衡: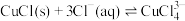 (aq,无色)。
(aq,无色)。
(1)基态S原子核外电子一共有________ 种不同的空间运动状态;液态 能发生自偶电离
能发生自偶电离 ,与
,与 互为等电子体的分子有
互为等电子体的分子有________ (写化学式,任写一种即可)。
(2)装置A的名称是________ ,多孔玻璃泡的作用是________________________ 。
(3)步骤②涉及的离子方程式为___________________________________ 。
(4)步骤④中,加入适量蒸馏水的目的是________________________________ 。
(5)步骤⑤用乙醇洗涤CuCl粗产品的原因是_______________________ 。
(6)本实验的产率是________ (保留3位有效数字)。
(7)假设在 下:
下:
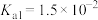 ,
, ,
, 且
且 ,测得反应后烧杯中的溶液
,测得反应后烧杯中的溶液 ,则烧杯中所发生的离子方程式为
,则烧杯中所发生的离子方程式为________________________ 。
①组装好整套实验装置,称取
 的
的 晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;②在
 左右向A装置中通入
左右向A装置中通入 气体,搅拌;
气体,搅拌;③当A中溶液全部褪色,停止通
 气体;
气体;④实验结束后,先向A装置中加入适量蒸馏水,减压过滤(需避光),可得到CuCl粗产品;
⑤用乙醇洗涤CuCl粗产品,将产品在双层干燥器(分别装有浓硫酸和碱石灰)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品质量为
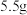 。
。已知CuCl在溶液中存在如下平衡:
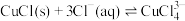 (aq,无色)。
(aq,无色)。
(1)基态S原子核外电子一共有
 能发生自偶电离
能发生自偶电离 ,与
,与 互为等电子体的分子有
互为等电子体的分子有(2)装置A的名称是
(3)步骤②涉及的离子方程式为
(4)步骤④中,加入适量蒸馏水的目的是
(5)步骤⑤用乙醇洗涤CuCl粗产品的原因是
(6)本实验的产率是
(7)假设在
 下:
下:
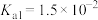 ,
, ,
, 且
且 ,测得反应后烧杯中的溶液
,测得反应后烧杯中的溶液 ,则烧杯中所发生的离子方程式为
,则烧杯中所发生的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】钯(Pd)是一种贵金属,性质类似铂(Pt)。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭、及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图:

已知:
Ⅰ.阴、阳离子交换树脂的基本工作原理分别为 、
、 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。
Ⅱ.“沉钯”时得到氯钯酸铵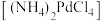 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。
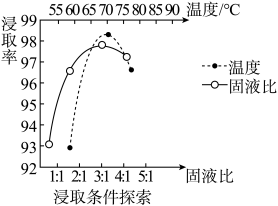
(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为___________ 。
(2)“浸取”时,加入试剂A的目的为___________ 。
(3)“浸取”时,加入 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:___________ 。
(4)“离子交换除杂”应使用___________ (填“阳离子”或“阴离子”)树脂,“洗脱”时应使用的洗脱液为___________ (填标号)。
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为___________ ,且该产物可循环利用至___________ 环节(填环节名称)。

已知:
Ⅰ.阴、阳离子交换树脂的基本工作原理分别为
 、
、 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。Ⅱ.“沉钯”时得到氯钯酸铵
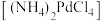 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为

(2)“浸取”时,加入试剂A的目的为
(3)“浸取”时,加入
 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:(4)“离子交换除杂”应使用
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程
 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】工业上利用炼锌矿渣[含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4等铁的化合物]获得3种金属盐,并进一步制备半导体材料氮化镓GaN,部分工艺流程如图:
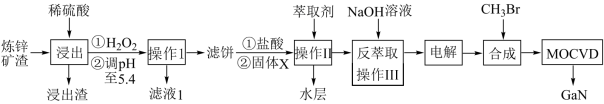
已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
②镓的化学性质与铝相似;
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为_______ , 浸取前需对矿渣粉碎的目的是_______ 。
(2)“浸出”后①中加入H2O2的离子方程式为_______ 。
(3)处理浸出液时,调节pH至5.4的目的是_______ 。
(4)萃取前,加入的固体X为_______ (填化学式)。
(5)反萃取后,镓元素的存在形式为_______ (填化学式)。
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为_______ 。
(7)滤液1中残留的镓离子的浓度为_______ mol·L-l。

已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.8 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为
(2)“浸出”后①中加入H2O2的离子方程式为
(3)处理浸出液时,调节pH至5.4的目的是
(4)萃取前,加入的固体X为
(5)反萃取后,镓元素的存在形式为
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为
(7)滤液1中残留的镓离子的浓度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】利用镍黄铁矿(主要成分是 、
、 、
、 )制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中
)制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中 、
、 全部参与反应,
全部参与反应, 煅烧后的产物为
煅烧后的产物为 。
。
(1) 的核外电子排布式为
的核外电子排布式为______ 。
(2)煅烧前将镍黄铁矿粉碎,目的是______ ;煅烧过程中 发生反应的化学方程式为
发生反应的化学方程式为____________ 。
(3)酸溶过程中产生的沉淀1是______ (填化学式)。
(4)加入物质X的目的是通过调节 生成
生成 沉淀,则物质X宜选用______(填标号)。
沉淀,则物质X宜选用______(填标号)。
(5) 有关沉淀数据如下表所示(完全沉淀时金属离子浓度
有关沉淀数据如下表所示(完全沉淀时金属离子浓度 )。
)。
若在 下溶液1中的
下溶液1中的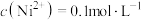 ,则此时需调节溶液的
,则此时需调节溶液的 的范围是
的范围是______ 。
(6)调 后的溶液2溶质是
后的溶液2溶质是 ,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵
,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵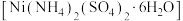 ,以硫酸镍浓溶液制备硫酸镍铵的实验方案为
,以硫酸镍浓溶液制备硫酸镍铵的实验方案为____________ (已知:硫酸镍铵易溶于水,难溶于乙醇;温度越高,其溶解度越大。实验中可选用的试剂:饱和硫酸铵溶液、硫酸镍的浓溶液、 溶液)。
溶液)。
 、
、 、
、 )制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中
)制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中 、
、 全部参与反应,
全部参与反应, 煅烧后的产物为
煅烧后的产物为 。
。
(1)
 的核外电子排布式为
的核外电子排布式为(2)煅烧前将镍黄铁矿粉碎,目的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)酸溶过程中产生的沉淀1是
(4)加入物质X的目的是通过调节
 生成
生成 沉淀,则物质X宜选用______(填标号)。
沉淀,则物质X宜选用______(填标号)。A. | B. | C. | D. |
(5)
 有关沉淀数据如下表所示(完全沉淀时金属离子浓度
有关沉淀数据如下表所示(完全沉淀时金属离子浓度 )。
)。沉淀 |
|
|
恰好完全沉淀时 |
| 9 |
 下溶液1中的
下溶液1中的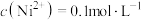 ,则此时需调节溶液的
,则此时需调节溶液的 的范围是
的范围是(6)调
 后的溶液2溶质是
后的溶液2溶质是 ,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵
,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵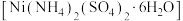 ,以硫酸镍浓溶液制备硫酸镍铵的实验方案为
,以硫酸镍浓溶液制备硫酸镍铵的实验方案为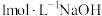 溶液)。
溶液)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】实验室以菱锰矿(含 及少量Fe、Si的氧化物等)为原料制备高纯
及少量Fe、Si的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下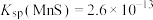 、
、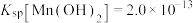 、
、 电离常数
电离常数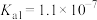 、
、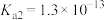 。
。

(1)该流程中可循环使用的物质有___________ 。
(2)“沉铁”过程需加氨水调节溶液pH,使溶液中 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是___________ 。
(3)沉铁过程中也会产生少量 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: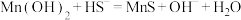 ,其平衡常数K=
,其平衡常数K=___________ 。
(4)制取 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水—
溶液与氨水— 混合溶液充分反应。
混合溶液充分反应。
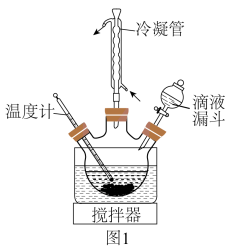
①滴液漏斗中添加的药品是___________ 。
②混合溶液中氨水的作用是___________ 。
(5)制取 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。

补充完整制取纯净 的实验方案:取150mL 0.7
的实验方案:取150mL 0.7 的
的 溶液,
溶液,___________ ,控制搅拌速率1500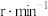 反应8h,
反应8h,___________ ,110℃干燥2h,得到纯净的 (须使用的试剂:1.4
(须使用的试剂:1.4 NaOH溶液、1.0
NaOH溶液、1.0
 溶液)。
溶液)。
 及少量Fe、Si的氧化物等)为原料制备高纯
及少量Fe、Si的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下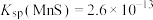 、
、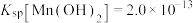 、
、 电离常数
电离常数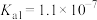 、
、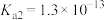 。
。
(1)该流程中可循环使用的物质有
(2)“沉铁”过程需加氨水调节溶液pH,使溶液中
 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是(3)沉铁过程中也会产生少量
 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: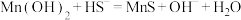 ,其平衡常数K=
,其平衡常数K=(4)制取
 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水—
溶液与氨水— 混合溶液充分反应。
混合溶液充分反应。
①滴液漏斗中添加的药品是
②混合溶液中氨水的作用是
(5)制取
 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。
补充完整制取纯净
 的实验方案:取150mL 0.7
的实验方案:取150mL 0.7 的
的 溶液,
溶液,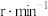 反应8h,
反应8h, (须使用的试剂:1.4
(须使用的试剂:1.4 NaOH溶液、1.0
NaOH溶液、1.0
 溶液)。
溶液)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】锂离子电池是近年来的研究热点,常见的锂离子聚合物电池材料有石墨、LiAsF6、LiPF6、LiMn2O4等。回答下列问题:
(1)As的最高能级组的电子排布式为_______ ,Li、O、P、As四种元素电负性由大到小的顺序为_______ (填元素符号)。
(2)LiPF6的阴离子的空间构型为_______ 。
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺( )制得。三聚氰胺分子中氮原子杂化类型是
)制得。三聚氰胺分子中氮原子杂化类型是_______ ;三聚氰胺分子不溶于冷水,溶于热水,主要原因是_______ 。
(4)尖晶石结构的LiMn2O4是一种常用的正极材料。已知一种LiMn2O4晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“○”表示O2−。
 ①“●”表示的微粒是
①“●”表示的微粒是_______ (填元素符号)
②若该晶胞的晶胞参数为apm,设NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(列出计算表达式,不必化简)
(1)As的最高能级组的电子排布式为
(2)LiPF6的阴离子的空间构型为
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺(
 )制得。三聚氰胺分子中氮原子杂化类型是
)制得。三聚氰胺分子中氮原子杂化类型是(4)尖晶石结构的LiMn2O4是一种常用的正极材料。已知一种LiMn2O4晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“○”表示O2−。
 ①“●”表示的微粒是
①“●”表示的微粒是②若该晶胞的晶胞参数为apm,设NA为阿伏加德罗常数的值,该晶体的密度为
您最近一年使用:0次
【推荐2】按照下列元素基态原子的电子排布特征回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:___________ 。
(2)上述元素中位于s区的有___________ (填元素符号)。
(3)写出C元素基态原子价电子排布图:___________ 。
(4)检验某溶液中是否含有D+,可通过___________ 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是___________ 和___________ 。
(5)写出E的元素符号:___________ ,要证明太阳上是否含有E元素,可采用的方法是___________ 。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:
(2)上述元素中位于s区的有
(3)写出C元素基态原子价电子排布图:
(4)检验某溶液中是否含有D+,可通过
(5)写出E的元素符号:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】氟化物在生产、生活和科研中应用广泛。请回答下列问题:
(1)基态氟原子核外电子的空间运动状态有________ 种,核外电子的最高能级的原子轨道相互________ 。
(2)夜明珠的主要成分是 。
。 难溶于水,但可溶于含
难溶于水,但可溶于含 的溶液中,其反应为
的溶液中,其反应为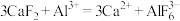 ,下列对
,下列对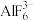 中心原子杂化方式推断合理的是________(填字母)。
中心原子杂化方式推断合理的是________(填字母)。
(3) 与一定量的水形成
与一定量的水形成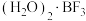 ,一定条件下
,一定条件下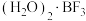 可发生如下转化:
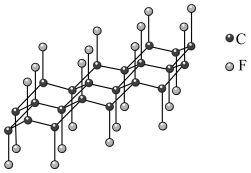
可发生如下转化:________ (填“无”或“有”)离子键形成。 (该物质仍具有润滑性),其单层局部结构如图所示。
(该物质仍具有润滑性),其单层局部结构如图所示。 的导电性
的导电性________ (填“增强”或“减弱”)。
②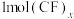 中含有
中含有________ molσ键(用含x的代数式表示)。
(5) 晶体属四方晶系(晶胞参数
晶体属四方晶系(晶胞参数 ),晶胞中代表Xe的是
),晶胞中代表Xe的是________ 球(填“黑”或“白”)。已知晶胞中A、B原子间距离为xpm,则B、C间距离为________ pm(用含a、c、x的代数式表示)。
(1)基态氟原子核外电子的空间运动状态有
(2)夜明珠的主要成分是
 。
。 难溶于水,但可溶于含
难溶于水,但可溶于含 的溶液中,其反应为
的溶液中,其反应为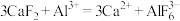 ,下列对
,下列对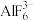 中心原子杂化方式推断合理的是________(填字母)。
中心原子杂化方式推断合理的是________(填字母)。A. | B. | C. | D. |
(3)
 与一定量的水形成
与一定量的水形成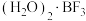 ,一定条件下
,一定条件下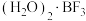 可发生如下转化:
可发生如下转化: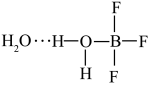

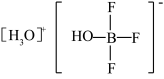
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如 分子中存在“离域π键”,可表示成
分子中存在“离域π键”,可表示成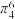 。实验测得
。实验测得 中硼氟键的键长比
中硼氟键的键长比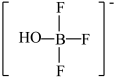 中B-F键的键长小,原因是
中B-F键的键长小,原因是
 (该物质仍具有润滑性),其单层局部结构如图所示。
(该物质仍具有润滑性),其单层局部结构如图所示。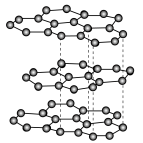
 的导电性
的导电性②
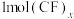 中含有
中含有(5)
 晶体属四方晶系(晶胞参数
晶体属四方晶系(晶胞参数 ),晶胞中代表Xe的是
),晶胞中代表Xe的是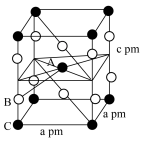
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】稀土正铁氧体RFeO3晶体是一类重要的多功能磁性材料,稳定的RFeO3晶体具有优异的磁光和光磁特性,我国科学家在磁光和光磁调控方面取得一系列重要研究进展。
回答下列问题:
(1)铁元素是构成人体的不可缺少的元素之一,亚铁离子是血红蛋白的重要组成成分。请写出Fe2+的核外电子排布式___________ ;铁的第四电离能I4远大于第三电离能I3的原因是___________ 。
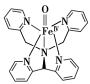
(2)某含铁络合物具有顺磁性,结构如图所示。组成该含铁络合物的第二周期元素中,电负性由大到小的顺序为___________ (用元素符号表示)。该含铁络合物中N原子的杂化方式为___________ ,碳原子价层电子对的空间构型为___________ 。
(3)铁在200 ℃、1×104 kPa压强下和一氧化碳反应,生成五羰基铁Fe(CO)5.Fe(CO)5为黄色液体,沸点103 ℃,Fe(CO)5属于___________ 晶体;铁在氯气中加热,生成三氯化铁,三氯化铁在300 ℃以上升华,气相为二聚体Fe2Cl6.Fe2Cl6中所含的化学键为___________ (填字母序号)。
A.离子键 B.共价键 C.配位键 D.氢键
(4)六方相RFeO3晶胞结构如图所示。R表示Sc与Lu元素,晶胞上下面面心为Sc,顶点为Lu,六方晶胞的高为p nm,正六边形底的边长为q nm。
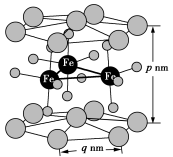
①六方相RFeO3的化学式为___________ 。
②RFeO3晶胞的密度是___________ g·cm−3。
回答下列问题:
(1)铁元素是构成人体的不可缺少的元素之一,亚铁离子是血红蛋白的重要组成成分。请写出Fe2+的核外电子排布式
(2)某含铁络合物具有顺磁性,结构如图所示。组成该含铁络合物的第二周期元素中,电负性由大到小的顺序为

(3)铁在200 ℃、1×104 kPa压强下和一氧化碳反应,生成五羰基铁Fe(CO)5.Fe(CO)5为黄色液体,沸点103 ℃,Fe(CO)5属于
A.离子键 B.共价键 C.配位键 D.氢键
(4)六方相RFeO3晶胞结构如图所示。R表示Sc与Lu元素,晶胞上下面面心为Sc,顶点为Lu,六方晶胞的高为p nm,正六边形底的边长为q nm。

①六方相RFeO3的化学式为
②RFeO3晶胞的密度是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】原子序数依次增大的前四周期元素X、Y、Z、W中,X和Y的价电子层中未成对电子均只有1个,并且 和
和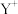 的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
(1)基态X原子的电子排布式为______ 。
(2)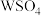 溶于氨水形成
溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中
中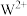 与
与 之间形成的化学键称为
之间形成的化学键称为______ ,提供孤电子对的成键原子是______ (填元素符号)。
② 中硫原子的杂化方式为
中硫原子的杂化方式为______ 。
③氨气溶于水时,大部分 与
与 以氢键(用“…”表示)结合形成
以氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为
的结构式为______ 。
④往 蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为
蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为______ 。
(3)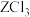 中的化学键具有明显的共价性,蒸气状态下以双聚分子形式存在的
中的化学键具有明显的共价性,蒸气状态下以双聚分子形式存在的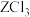 的结构式为
的结构式为______ ,其中Z的配位数为______ 。
(4)反应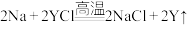 能够发生的原因为
能够发生的原因为______ 。
 和
和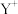 的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:(1)基态X原子的电子排布式为
(2)
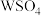 溶于氨水形成
溶于氨水形成 蓝色溶液。
蓝色溶液。①
 中
中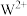 与
与 之间形成的化学键称为
之间形成的化学键称为②
 中硫原子的杂化方式为
中硫原子的杂化方式为③氨气溶于水时,大部分
 与
与 以氢键(用“…”表示)结合形成
以氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为
的结构式为④往
 蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为
蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为(3)
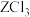 中的化学键具有明显的共价性,蒸气状态下以双聚分子形式存在的
中的化学键具有明显的共价性,蒸气状态下以双聚分子形式存在的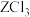 的结构式为
的结构式为(4)反应
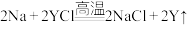 能够发生的原因为
能够发生的原因为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】南京工业大学某研究团队最近在《Nature Communications》刊文介绍了他们开发的一种新型催化剂——反钙钛矿基非贵金属催化剂,这种价廉的新型催化剂结合了钙钛矿结构的灵活性和过渡金属氮(碳)化合物的高导电性、优异电催化性等优点,理论上来说是一种很有发展潜力的析氧反应电催化剂。回答下列问题:
(1)基态氮原子核外未成对电子数为________ ,基态碳原子核外电子云有_______ 个伸展方向。
(2)在周期表中,N、O、F是位于同周期且相邻的三种元素,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的立体构型是_________ ,中心原子的杂化类型是________ 。
(3)在周期表中,钡位于第六周期ⅡA族,钛酸钡、钛酸钙的熔点分别为1625℃、1975℃,二者熔点差异的原因为__ 。
(4)钛酸钙的晶胞如图所示,钛酸钙的化学式为_____________ ;1个钛离子与________ 个氧离子等距离且最近,这些氧离子可构成正八面体,钛离子位于该正八面体的体心。已知钛酸钙的晶胞参数为a nm,则该正八面体的边长为________ pm。
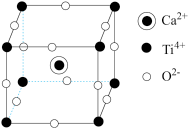
(5)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为x cm,高为y cm,NA为阿伏加 德罗常数的值,则晶胞的密度为________________ g·cm-3(列出计算式即可)。

(1)基态氮原子核外未成对电子数为
(2)在周期表中,N、O、F是位于同周期且相邻的三种元素,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的立体构型是
(3)在周期表中,钡位于第六周期ⅡA族,钛酸钡、钛酸钙的熔点分别为1625℃、1975℃,二者熔点差异的原因为
(4)钛酸钙的晶胞如图所示,钛酸钙的化学式为

(5)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为x cm,高为y cm,NA为阿伏加 德罗常数的值,则晶胞的密度为

您最近一年使用:0次





