硫酸的消费量常用来衡量一个国家工业发展水平。其中 的催化氧化是重要的一步,其反应为:
的催化氧化是重要的一步,其反应为: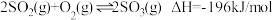 。回答下列问题:
。回答下列问题:
(1) 催化氧化反应在
催化氧化反应在___________ 温下自发(填“高”或“低”,下同),___________ 压有利于提高反应速率,___________ 压有利于提高平衡转化率。根据下表数据( 条件下测得)阐述实际工业生产选择
条件下测得)阐述实际工业生产选择 的理由:
的理由:___________ ;
(2)科研人员使用 为基础固硫材料,复合不同的催化剂
为基础固硫材料,复合不同的催化剂 催化
催化 向
向 的转化。同时研究了不同温度下使用三种催化剂对
的转化。同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响,结论如下图:
转化率表示)的影响,结论如下图:
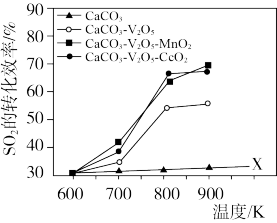
I.仅使用 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是___________ ;
Ⅱ.下列有关说法正确的是___________
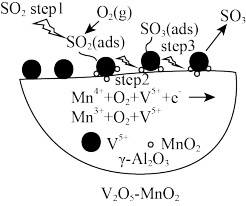
a.三种催化剂中 催化剂效率最低
催化剂效率最低
b.同温同压下,使用复合催化剂有利于提高 的平衡产率
的平衡产率
c.如图为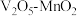 为催化剂时的反应机理,由图可知
为催化剂时的反应机理,由图可知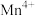 比
比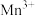 更易获得电子
更易获得电子
d.温度越高一定越有利于催化剂催化效率的提升
(3)某 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: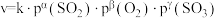 ,根据表中数据,
,根据表中数据,
___________ ;
(4)某种晶型的 晶胞如图,A位置的元素为
晶胞如图,A位置的元素为___________ (填元素符号)。

 的催化氧化是重要的一步,其反应为:
的催化氧化是重要的一步,其反应为: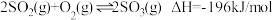 。回答下列问题:
。回答下列问题:(1)
 催化氧化反应在
催化氧化反应在 条件下测得)阐述实际工业生产选择
条件下测得)阐述实际工业生产选择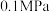 的理由:
的理由:| 压强 | 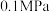 | 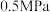 | 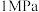 | 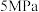 | 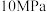 |
平衡时 的转化率 的转化率 | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
(2)科研人员使用
 为基础固硫材料,复合不同的催化剂
为基础固硫材料,复合不同的催化剂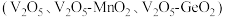 催化
催化 向
向 的转化。同时研究了不同温度下使用三种催化剂对
的转化。同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响,结论如下图:
转化率表示)的影响,结论如下图:
I.仅使用
 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是Ⅱ.下列有关说法正确的是

a.三种催化剂中
 催化剂效率最低
催化剂效率最低b.同温同压下,使用复合催化剂有利于提高
 的平衡产率
的平衡产率c.如图为
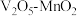 为催化剂时的反应机理,由图可知
为催化剂时的反应机理,由图可知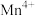 比
比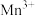 更易获得电子
更易获得电子d.温度越高一定越有利于催化剂催化效率的提升
(3)某
 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: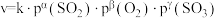 ,根据表中数据,
,根据表中数据,
| 实验 | 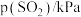 |  | 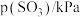 | 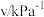 |
| 1 | m | n | p | q |
| 2 | 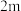 | n | p |  |
| 3 | m | n |  | 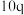 |
| 4 | m |  | p | 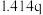 |
(4)某种晶型的
 晶胞如图,A位置的元素为
晶胞如图,A位置的元素为
2022·辽宁鞍山·一模 查看更多[3]
更新时间:2022-09-08 06:36:47
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】实验小组探究酸对Fe3++3SCN-⇌Fe(SCN)3平衡的影响。将0.005mol·L-1FeCl3溶液(接近无色)和0.01mol·L-1KSCN溶液等体积混合,得到红色溶液。
已知:FeCl3溶液呈酸性的原因是Fe3+水解:Fe3++3H2O⇌Fe(OH)3+3H+。
(1)甲同学认加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中_____ 增大,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
[查阅资料]
Fe3+和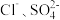 均能发生络合反应(配位平衡):
均能发生络合反应(配位平衡):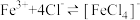 (黄色);
(黄色);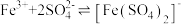 (无色)。
(无色)。
实验I.探究现象a中溶液颜色变化的原因
(2)实验①的目的是_____ 。
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:_____ 。
实验II.探究现象b中溶液呈浅黄色的原因
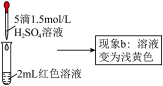
(4)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是_____ 。
(5)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(4)中的一种,请将实验④的操作及现象补充完整:_____ 、_____ 。
已知:FeCl3溶液呈酸性的原因是Fe3+水解:Fe3++3H2O⇌Fe(OH)3+3H+。
(1)甲同学认加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
 |  |
Fe3+和
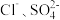 均能发生络合反应(配位平衡):
均能发生络合反应(配位平衡):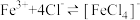 (黄色);
(黄色);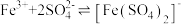 (无色)。
(无色)。实验I.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
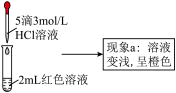
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol·L-1KCl溶液 | 溶液颜色变浅,呈橙色 |
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验II.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol·L-1Fe2 (SO4) 3溶液(无色)。加入1mL0.01mol·L-1KSCN溶液,再加入5滴1.5mol·L-1H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol·L-1FeCl3溶液,_____ | _____ |
(5)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(4)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】I.已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH1=-907kJ/mol;
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=-1269kJ/mol。
氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成两种无毒物质。
(1)写出该反应的热化学反应方程式:_______ 。该反应能在_______ (选项“高温”、“低温”或“任何温度”)下自发进行。
II.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g) N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:

(2)温度为T1,0~25分钟NO2(g)的平均反应速率为_______ mol•L-1•min-1。
(3)该反应的ΔH_______ 0(填“大于”或“小于”)。
(4)下列措施能提高容器乙中NO2转化率的是_______ (填字母)。
(5)温度为T1时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2molO2,则脱硝反应达到平衡前,v(正)_______ v(逆)(填“>”“<”或“=”)。
III.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(6)①某实验室模拟该反应,在恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1,反应开始时压强为800kPa,平衡时容器内气体总压强增加25%。则用平衡分压代替其平衡浓度表示化学平衡常数Kp=_______ kPa。[已知:气体分压(P分)=气体总E(P总)×体积分数]
②已知该反应的正反应速率方程v正=k正 p2(NO2),逆反应速率方程为v逆=k逆
p2(NO2),逆反应速率方程为v逆=k逆 p(N2)
p(N2)  p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=
p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=_______ 。(结果保留一位小数)
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=-1269kJ/mol。
氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成两种无毒物质。
(1)写出该反应的热化学反应方程式:
II.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)
 N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | 2molNO2、1molO3 | 2molNO2、1molO3 |

(2)温度为T1,0~25分钟NO2(g)的平均反应速率为
(3)该反应的ΔH
(4)下列措施能提高容器乙中NO2转化率的是
| A.向容器中充入He,增大容器的压强 |
| B.升高容器的温度 |
| C.向容器中再充入一定量的NO2 |
| D.向容器中再充入1molO3和2molNO2 |
III.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。(6)①某实验室模拟该反应,在恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1,反应开始时压强为800kPa,平衡时容器内气体总压强增加25%。则用平衡分压代替其平衡浓度表示化学平衡常数Kp=
②已知该反应的正反应速率方程v正=k正
 p2(NO2),逆反应速率方程为v逆=k逆
p2(NO2),逆反应速率方程为v逆=k逆 p(N2)
p(N2)  p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=
p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=
您最近一年使用:0次
【推荐3】2020年9月22日,国家主席习近平在第七十五届联合国大会上表示,中国将争取在2060年前实现碳中和。研究二氧化碳的回收对这一宏伟目标的实现具有现实意义:
(1)以 与
与 为原料可合成尿素
为原料可合成尿素 ,已知:
,已知:
Ⅰ.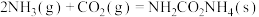
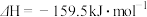
Ⅱ.
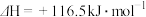
在相同条件下,反应 的正反应的活化能
的正反应的活化能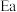 为179
为179 ,则逆反应的活化能
,则逆反应的活化能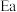 为
为_______  。
。
(2)一定条件下,二氧化碳转化为甲烷的反应如下:
 。现有两个相同的恒容绝热(与外界没有热量交换)密闭容器甲、乙,在甲中充入1mol
。现有两个相同的恒容绝热(与外界没有热量交换)密闭容器甲、乙,在甲中充入1mol  和4mol
和4mol  ,在乙中充入1mol
,在乙中充入1mol  和2mol
和2mol  (g),300℃下开始反应,达到平衡时,容器中的压强P甲
(g),300℃下开始反应,达到平衡时,容器中的压强P甲_______ P乙(填“ ”、“
”、“ ”或“
”或“ ”),
”), 的物质的量分数X甲
的物质的量分数X甲_______ X乙(填“ ”、“
”、“ ”或“
”或“ ”)
”)
(3)用催化剂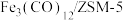 催化
催化 加氢合成乙烯的反应,所得产物含
加氢合成乙烯的反应,所得产物含 、
、 、
、 等副产物,反应过程如图所示:
等副产物,反应过程如图所示:
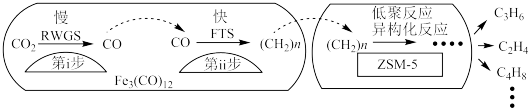
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得 转化率和各产物的物质的量占比见下表。
转化率和各产物的物质的量占比见下表。
①欲提高单位时间内乙烯的产量,在 中添加
中添加_______ 助剂效果最好﹔加入助剂能提高单位时间内乙烯产量的原因是_______ 。
②下列说法正确的是_______ (填字母)。
a.第一步反应为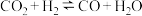
b.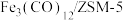 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
c.添加助剂不同,反应的平衡常数不同
(4) 和
和 在催化剂作用下可发生以下两个反应:
在催化剂作用下可发生以下两个反应:
Ⅰ.

Ⅱ.
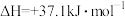
①为降低 含量,增大
含量,增大 含量,可采取的措施有
含量,可采取的措施有_______ 。
②恒温恒容密闭的1L容器中加入2mol (g)和4mol
(g)和4mol  (g),初始压强为10MPa,在300℃发生反应,达到平衡时,
(g),初始压强为10MPa,在300℃发生反应,达到平衡时, 的转化率为50%,容器内压强为7.5MPa,则反应Ⅰ的平衡常数
的转化率为50%,容器内压强为7.5MPa,则反应Ⅰ的平衡常数
_______ 。
(1)以
 与
与 为原料可合成尿素
为原料可合成尿素 ,已知:
,已知:Ⅰ.
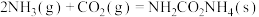
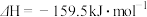
Ⅱ.

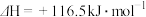
在相同条件下,反应
 的正反应的活化能
的正反应的活化能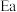 为179
为179 ,则逆反应的活化能
,则逆反应的活化能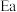 为
为 。
。(2)一定条件下,二氧化碳转化为甲烷的反应如下:

 。现有两个相同的恒容绝热(与外界没有热量交换)密闭容器甲、乙,在甲中充入1mol
。现有两个相同的恒容绝热(与外界没有热量交换)密闭容器甲、乙,在甲中充入1mol  和4mol
和4mol  ,在乙中充入1mol
,在乙中充入1mol  和2mol
和2mol  (g),300℃下开始反应,达到平衡时,容器中的压强P甲
(g),300℃下开始反应,达到平衡时,容器中的压强P甲 ”、“
”、“ ”或“
”或“ ”),
”), 的物质的量分数X甲
的物质的量分数X甲 ”、“
”、“ ”或“
”或“ ”)
”)(3)用催化剂
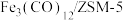 催化
催化 加氢合成乙烯的反应,所得产物含
加氢合成乙烯的反应,所得产物含 、
、 、
、 等副产物,反应过程如图所示:
等副产物,反应过程如图所示:
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得
 转化率和各产物的物质的量占比见下表。
转化率和各产物的物质的量占比见下表。| 助剂 |  转化率(%) 转化率(%) | 各产物在所有产物中的占比(%) | ||
 |  | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
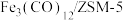 中添加
中添加②下列说法正确的是
a.第一步反应为
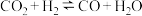
b.
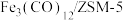 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小c.添加助剂不同,反应的平衡常数不同
(4)
 和
和 在催化剂作用下可发生以下两个反应:
在催化剂作用下可发生以下两个反应:Ⅰ.


Ⅱ.

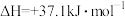
①为降低
 含量,增大
含量,增大 含量,可采取的措施有
含量,可采取的措施有②恒温恒容密闭的1L容器中加入2mol
 (g)和4mol
(g)和4mol  (g),初始压强为10MPa,在300℃发生反应,达到平衡时,
(g),初始压强为10MPa,在300℃发生反应,达到平衡时, 的转化率为50%,容器内压强为7.5MPa,则反应Ⅰ的平衡常数
的转化率为50%,容器内压强为7.5MPa,则反应Ⅰ的平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2(g)+CO2(g).
N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①根据表中数据,计算T1℃时该反应的平衡常数为_____ (保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)_____ v(逆)(填“>、<、=”)
②下列各项能判断该反应达到平衡状态的是_____ (填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率_____ (填“增大”、“不变”或“减小”).
(2)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g) H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
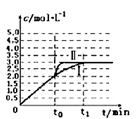
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是_____ ;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线_____ .
(3)已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)△H=﹣41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:下列说法正确的是_____ (填序号)

A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应平衡常数会减小
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(4)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,amol CO2和bmol H2.若达平衡时各组分体积分数都与(3)中平衡时相同,则a=_____ mol,b=_____ mol.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g).
N2(g)+CO2(g).某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②下列各项能判断该反应达到平衡状态的是
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率
(2)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)
 H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线
(3)已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)△H=﹣41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:下列说法正确的是

A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应平衡常数会减小
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(4)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,amol CO2和bmol H2.若达平衡时各组分体积分数都与(3)中平衡时相同,则a=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】二氧化碳加氢制甲醇是碳中和的一个重要研究方向。在恒压条件下,将 和
和 充入密闭容器中进行如下反应:
充入密闭容器中进行如下反应:
I:

II:

III: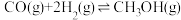
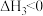
回答下列问题:
(1) 转化率
转化率 、
、 选择性(产物中CH3OH的物质的量与参加反应
选择性(产物中CH3OH的物质的量与参加反应 的物质的量之比,用
的物质的量之比,用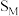 表示)、
表示)、 选择性(产物中
选择性(产物中 的物质的量与参加反应
的物质的量与参加反应 的物质的量之比,用
的物质的量之比,用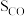 表示)随温度变化如图所示。
表示)随温度变化如图所示。

①反应I正反应活化能为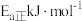 ,逆反应活化能为
,逆反应活化能为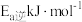 ,则
,则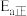
___________ 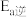 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②图1中表示 的曲线是
的曲线是___________ ,曲线c随温度升高而升高的原因是___________ 。
③已知T=240℃, ,
,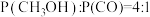 ,反应Ⅱ的分压平衡常数
,反应Ⅱ的分压平衡常数
___________ (保留2位有效数字)。
(2)为探究原料气中混杂 对反应的影响,测得
对反应的影响,测得 小、平衡时
小、平衡时 与初始
与初始 物质的量之比
物质的量之比 随原料气中
随原料气中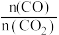 的变化如图所示。
的变化如图所示。
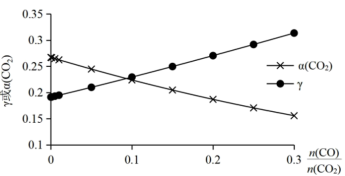
①图2中 降低而
降低而 升高的原因是
升高的原因是___________ ;当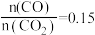 时,
时,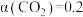 ,
,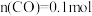 则
则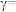
___________ 。
②下列措施能提高 值的是
值的是___________ (填字母标号)。
A.恒容条件通入 B.恒压条件通入氩气 C.选用更高效的催化剂 D.将尾气进行循环使用
B.恒压条件通入氩气 C.选用更高效的催化剂 D.将尾气进行循环使用
 和
和 充入密闭容器中进行如下反应:
充入密闭容器中进行如下反应:I:


II:


III:
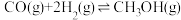
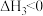
回答下列问题:
(1)
 转化率
转化率 、
、 选择性(产物中CH3OH的物质的量与参加反应
选择性(产物中CH3OH的物质的量与参加反应 的物质的量之比,用
的物质的量之比,用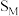 表示)、
表示)、 选择性(产物中
选择性(产物中 的物质的量与参加反应
的物质的量与参加反应 的物质的量之比,用
的物质的量之比,用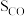 表示)随温度变化如图所示。
表示)随温度变化如图所示。
①反应I正反应活化能为
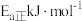 ,逆反应活化能为
,逆反应活化能为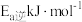 ,则
,则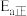
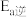 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②图1中表示
 的曲线是
的曲线是③已知T=240℃,
 ,
,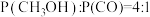 ,反应Ⅱ的分压平衡常数
,反应Ⅱ的分压平衡常数
(2)为探究原料气中混杂
 对反应的影响,测得
对反应的影响,测得 小、平衡时
小、平衡时 与初始
与初始 物质的量之比
物质的量之比 随原料气中
随原料气中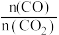 的变化如图所示。
的变化如图所示。
①图2中
 降低而
降低而 升高的原因是
升高的原因是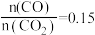 时,
时,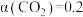 ,
,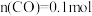 则
则
②下列措施能提高
 值的是
值的是A.恒容条件通入
 B.恒压条件通入氩气 C.选用更高效的催化剂 D.将尾气进行循环使用
B.恒压条件通入氩气 C.选用更高效的催化剂 D.将尾气进行循环使用
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】对CO2的综合利用意义深远,可有效减缓温室效应。
(1)由合成气(组成为H2、CO和少量的CO2)直接制备甲醇,主要过程涉及以下反应:
I:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ·mol-1
CH3OH(g) △H1=-90.1kJ·mol-1
II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1
III:CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
已知反应III的△S=-0.18kJ·mol-1·K-1,则____ (“高温”或“低温”)有利于反应III自发进行。
(2)恒压条件下,发生反应II,该反应的速率方程为v正=k正•x(CO2)•x3(H2),v逆=k逆•x(CH3OH)•x(H2O),k正、k逆为速率常数且只与温度有关,x为物质的量分数(也称摩尔分数)。
①摩尔分数平衡常数Kx=____ (以k正、k逆表示)(摩尔分数平衡常数即用摩尔分数代替物质的量浓度的平衡常数)。
②达到平衡时,升高温度,k正、k逆均增大,增大倍数较大的是____ ,由此请用文字描述当温度改变时,正、逆反应活化能(Ea)与k正、k逆变化的关系____ 。
③我国科学家使用Pd—Cu双金属合金作催化剂,研究反应II。利用计算机模拟,反应历程如图所示(*表示催化剂吸附的物种),TS1表示过液态1。
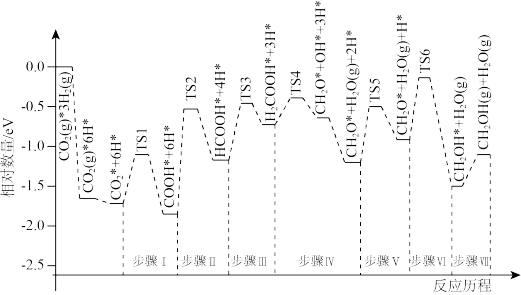
通过降低步骤____ (填步骤编号)的能垒(活化能),进一步提高该反应的反应速率。
(3)利用焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应的lgKp(Kp是以分压表示的平衡常数)与温度的关系如图所示。
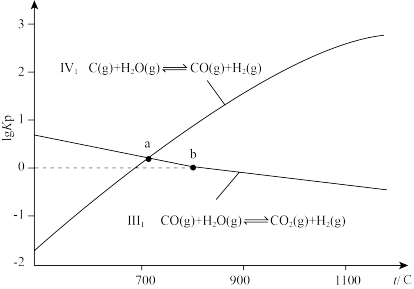
①工业上用焦炭和水蒸气反应生成水煤气(CO、H2)时通常交替通入合适量的空气和水蒸气与焦炭反应,其理由是____ 。
②a点时,C(s)+CO2(g) 2CO(g)的Kp=
2CO(g)的Kp=____ (填数值)。
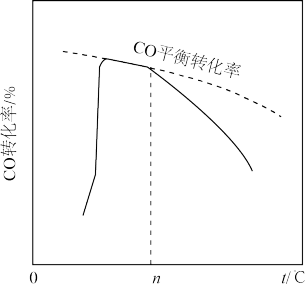
③等物质的量的CO和H2O发生反应III,b点时,CO的转化率=____ 。北京大学马丁教授等研究了在Au/a—MoC催化作用下,反应相同时间,温度与CO转化率的关系,如图所示。分析温度升高至t1后,CO转化率降低的原因是____ 。
(1)由合成气(组成为H2、CO和少量的CO2)直接制备甲醇,主要过程涉及以下反应:
I:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ·mol-1
CH3OH(g) △H1=-90.1kJ·mol-1II:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1III:CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3已知反应III的△S=-0.18kJ·mol-1·K-1,则
(2)恒压条件下,发生反应II,该反应的速率方程为v正=k正•x(CO2)•x3(H2),v逆=k逆•x(CH3OH)•x(H2O),k正、k逆为速率常数且只与温度有关,x为物质的量分数(也称摩尔分数)。
①摩尔分数平衡常数Kx=
②达到平衡时,升高温度,k正、k逆均增大,增大倍数较大的是
③我国科学家使用Pd—Cu双金属合金作催化剂,研究反应II。利用计算机模拟,反应历程如图所示(*表示催化剂吸附的物种),TS1表示过液态1。

通过降低步骤
(3)利用焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应的lgKp(Kp是以分压表示的平衡常数)与温度的关系如图所示。

①工业上用焦炭和水蒸气反应生成水煤气(CO、H2)时通常交替通入合适量的空气和水蒸气与焦炭反应,其理由是
②a点时,C(s)+CO2(g)
 2CO(g)的Kp=
2CO(g)的Kp=③等物质的量的CO和H2O发生反应III,b点时,CO的转化率=

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】环氧乙烷(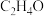 )被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯(
)被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯( )直接氧化法制取环氧乙烷,体系中发生的反应如下:
)直接氧化法制取环氧乙烷,体系中发生的反应如下:
主反应:


副反应: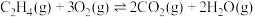

回答下列问题:
(1)已知几种化学键的键能如表所示:
试计算
___________ 。
(2)主反应与副反应的吉布斯自由能变( )与温度T的关系如图所示,则副反应的
)与温度T的关系如图所示,则副反应的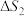
___________ (填“>”“<”或“=”)0,
___________ (填“>”“<”或“=”)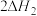 。
。

(3)在250℃、101kPa下,向某密闭容器中充入一定量的 和
和 ,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是
,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是 ,增大压强,
,增大压强, 的含量将
的含量将___________ (填“增大”“减小”或“不变”)。工业生产中常采用的反应条件为250℃、2.0MPa,并选择Ag作催化剂,充分反应后体系中含碳组分含量最高的是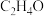 ,则Ag所起的作用可能为
,则Ag所起的作用可能为___________ 。
(4)一定条件下,用富氧空气(只含 和
和 ,且
,且 的体积分数为55%)代替
的体积分数为55%)代替 ,将
,将 、
、 、
、 按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa,
按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa, 的体积分数为31.25%,
的体积分数为31.25%,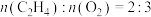 ,则
,则 和
和 的平衡转化率之比为
的平衡转化率之比为___________ ,该条件下主反应的压强平衡常数
___________  (
( 为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
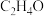 )被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯(
)被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯( )直接氧化法制取环氧乙烷,体系中发生的反应如下:
)直接氧化法制取环氧乙烷,体系中发生的反应如下:主反应:



副反应:
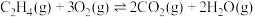

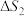
回答下列问题:
(1)已知几种化学键的键能如表所示:
| 化学键 | C-H | C=C | C-C | C-O | O=O |
键能 | 423 | 682 | 368 | 335 | 498 |

(2)主反应与副反应的吉布斯自由能变(
 )与温度T的关系如图所示,则副反应的
)与温度T的关系如图所示,则副反应的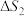

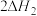 。
。
(3)在250℃、101kPa下,向某密闭容器中充入一定量的
 和
和 ,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是
,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是 ,增大压强,
,增大压强, 的含量将
的含量将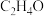 ,则Ag所起的作用可能为
,则Ag所起的作用可能为(4)一定条件下,用富氧空气(只含
 和
和 ,且
,且 的体积分数为55%)代替
的体积分数为55%)代替 ,将
,将 、
、 、
、 按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa,
按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa, 的体积分数为31.25%,
的体积分数为31.25%,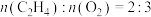 ,则
,则 和
和 的平衡转化率之比为
的平衡转化率之比为
 (
( 为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】将二氧化碳加氢制甲醇可以实现碳减排。如果选取氢气或水作为氢源,可能设计出以下两个反应:
Ⅰ:
Ⅱ: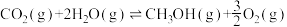
(1)通过计算判断哪个反应可能更适宜于甲醇的工业生产_______ 。
(2)若选择氢气作为氢源时,除了反应Ⅰ外,还可能发生副反应:
Ⅲ:
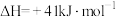
①为提高主反应Ⅰ中 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是_______ (填字母序号)。
a.升高温度 b.增大反应的压强 c.增大 浓度
浓度
②反应过程中,副反应生成的CO也可以与 反应生成甲醇,请写出该反应的热化学方程式:
反应生成甲醇,请写出该反应的热化学方程式:_______ 。
(3)下表是其他条件相同时,不同催化剂成分对甲醇产率及催化选择性的数据。
说明:wt%为质量百分数单位。
由上表数据,可以得到的结论是_______ (填字母序号)。
a.其它条件相同时,催化剂的组成会影响单位时间内所获得的产品质量
b.其它条件相同时,催化剂的组成会影响反应的限度
c.其它条件相同时,催化剂中 对甲醇选择性的影响大于
对甲醇选择性的影响大于
(4)综上所述,利用 合成甲醇,实现碳减排需要考虑的因素有
合成甲醇,实现碳减排需要考虑的因素有_______ 。
Ⅰ:

Ⅱ:
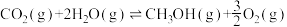
| 298K时反应 |  |  |
| Ⅰ | —49.0 | —177.2 |
| Ⅱ | +676.5 | —43.9 |
(2)若选择氢气作为氢源时,除了反应Ⅰ外,还可能发生副反应:
Ⅲ:

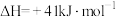
①为提高主反应Ⅰ中
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是a.升高温度 b.增大反应的压强 c.增大
 浓度
浓度②反应过程中,副反应生成的CO也可以与
 反应生成甲醇,请写出该反应的热化学方程式:
反应生成甲醇,请写出该反应的热化学方程式:(3)下表是其他条件相同时,不同催化剂成分对甲醇产率及催化选择性的数据。
| 组成/单位 催化剂 | CuO | ZnO |  |  | MnO |  产率 产率 | 选择性 |
| wt% | wt% | wt% | wt% | wt% |  | % | |
| 催化剂Ⅰ | 65.8 | 26.3 | 7.9 | 0 | 0 | 78 | 40 |
| 催化剂Ⅱ | 62.4 | 25 | 0 | 12.6 | 0 | 96 | 88 |
| 催化剂Ⅲ | 65.8 | 26.6 | 0. | 3.6 | 4 | 88 | 100 |
| 催化剂Ⅳ | 65.8 | 26.6 | 0 | 5.6 | 2 | 138 | 91 |
由上表数据,可以得到的结论是
a.其它条件相同时,催化剂的组成会影响单位时间内所获得的产品质量
b.其它条件相同时,催化剂的组成会影响反应的限度
c.其它条件相同时,催化剂中
 对甲醇选择性的影响大于
对甲醇选择性的影响大于
(4)综上所述,利用
 合成甲醇,实现碳减排需要考虑的因素有
合成甲醇,实现碳减排需要考虑的因素有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g)  2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法正确的是__________ 。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的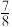 ,则N2的转化率为
,则N2的转化率为______________ 。
(3)工业上合成氨的部分工艺流程如下:
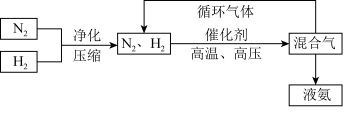
请用平衡移动原理来解释在流程中及时分离出氨气的原因_____________________________ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2_______ T1(填“>”“<”或“=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________ (填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
此条件下该反应的化学平衡常数K=_______________ 。
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g) 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-1
2H2(g)+O2 (g) 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________________________________ 。
 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。(1)下列关于工业合成氨的说法正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
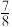 ,则N2的转化率为
,则N2的转化率为(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下该反应的化学平衡常数K=
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g)
 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1N2(g)+O2(g)
 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-12H2(g)+O2 (g)
 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1写出氨气催化氧化生成NO和水蒸气的热化学方程式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________ 。
(2)根据元素周期律,原子半径Ga______ As,第一电离能Ga________ As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为_____________ ,其中As的杂化轨道类型为_________ 。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____________ 。
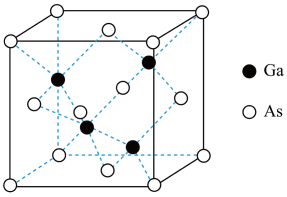
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________ ,Ga与As以________ 键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加 德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________ 。
Ⅱ.醋酸铜可合成复合材料石墨烯Cu,其制备原料为CuSO4、NH3·H2O和醋酸等。
(1)写出一种与SO42-互为等电子体的分子__________ 。
(2)二聚醋酸铜的结构示意图如图所示,Cu2+的配位数为___________ 。

(3)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为a nm该化合物中K原子和C60分子的个数比为______ ,该晶体的密度ρ=______ g/cm3(列出计算式)。
(1)写出基态As原子的核外电子排布式
(2)根据元素周期律,原子半径Ga
(3)AsCl3分子的立体构型为
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为

Ⅱ.醋酸铜可合成复合材料石墨烯Cu,其制备原料为CuSO4、NH3·H2O和醋酸等。
(1)写出一种与SO42-互为等电子体的分子
(2)二聚醋酸铜的结构示意图如图所示,Cu2+的配位数为

(3)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为a nm该化合物中K原子和C60分子的个数比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液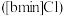 可以与
可以与 混合形成离子液体;
混合形成离子液体;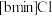 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是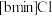 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体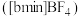 的流程:
的流程:

某种 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在 构成的八面体体心)。
构成的八面体体心)。

①该晶胞中 的配位数为
的配位数为___________ 。
②该晶胞有___________  (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。
③已知氧离子半径为 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为___________  (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液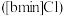 可以与
可以与 混合形成离子液体;
混合形成离子液体;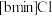 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是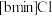 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体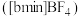 的流程:
的流程:
某种
 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在 构成的八面体体心)。
构成的八面体体心)。
①该晶胞中
 的配位数为
的配位数为②该晶胞有
 (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。③已知氧离子半径为
 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为 (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】元素周期表中,第四周期包括10种过渡元素(21号-30号),它们的单质及其化合物在化工生产和研究中有重要的应用。
(1)Fe原子核外电子排布式为___________ ,在第四周期过渡元素中,基态原子的未成对电子数与铁相同的元素有___________ 种。
(2)甘氨酸亚铁[(H2NCH2COO)2Fe]的主要生理功能是预防和改善缺铁性贫血。甘氨酸(H2NCH2COOH)中C原子的杂化形式为___________
(3)在 催化作用下,呋喃(
催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯(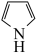 )。二者熔、沸点关系为:呋喃
)。二者熔、沸点关系为:呋喃___________ 吡咯(填“高于”或“低于”),原因是___________ 。
(4)离子水合能是气态离子溶于水中成为稀溶液时释放的能量,其值越大,离子越稳定。已知离子水合能跟溶解离子的半径和电荷数有关,试分析在水溶液中 比
比 稳定的原因
稳定的原因___________ 。
(5)Ti能形成化合物[TiCl(H2O)5] Cl2·H2O,该化合物中Ti3+的配位数为___________ ,在该化合物中不含___________ (填标号)。
A. 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键
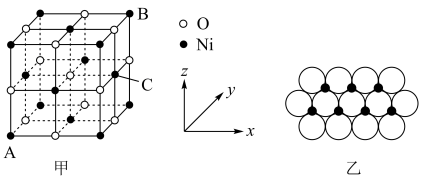
(6)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为___________ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为___________ g(用含a、NA的代数式表示)。
(1)Fe原子核外电子排布式为
(2)甘氨酸亚铁[(H2NCH2COO)2Fe]的主要生理功能是预防和改善缺铁性贫血。甘氨酸(H2NCH2COOH)中C原子的杂化形式为
(3)在
 催化作用下,呋喃(
催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯(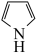 )。二者熔、沸点关系为:呋喃
)。二者熔、沸点关系为:呋喃(4)离子水合能是气态离子溶于水中成为稀溶液时释放的能量,其值越大,离子越稳定。已知离子水合能跟溶解离子的半径和电荷数有关,试分析在水溶液中
 比
比 稳定的原因
稳定的原因(5)Ti能形成化合物[TiCl(H2O)5] Cl2·H2O,该化合物中Ti3+的配位数为
A.
 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键(6)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为

您最近一年使用:0次



