回答下列问题
(1)依据事实,写出下列反应的热化学方程式:
①1 mol氨气和1 mol氯化氢气体化合生成氯化铵固体,放出176 kJ热量,该反应的热化方程式为:_______ 。
②25℃ 101 kPa时,氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,该反应的热化方程式为:_______ 。
(2)甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①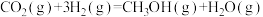 ∆H1
∆H1
②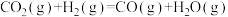 ∆H2
∆H2
③ ∆H3
∆H3
已知反应②中相关化学键键能(断裂1 mol化学键吸收或形成1 mol化学键放出的能量)数据如表:
由此计算∆H2=_______ kJ/mol。已知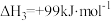 ,则∆H1=
,则∆H1=_______ kJ/mol。
(1)依据事实,写出下列反应的热化学方程式:
①1 mol氨气和1 mol氯化氢气体化合生成氯化铵固体,放出176 kJ热量,该反应的热化方程式为:
②25℃ 101 kPa时,氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,该反应的热化方程式为:
(2)甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①
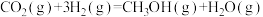 ∆H1
∆H1②
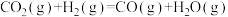 ∆H2
∆H2③
 ∆H3
∆H3已知反应②中相关化学键键能(断裂1 mol化学键吸收或形成1 mol化学键放出的能量)数据如表:
| 化学键 | H-H | C=O | C≡O | H-O |
 | 436 | 803 | 1076 | 465 |
由此计算∆H2=
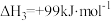 ,则∆H1=
,则∆H1=
更新时间:2022-10-22 10:23:57
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】到目前为止,约90%的工业产品是借助催化剂(工业上也称为触媒)生产出来的,催化剂解决了现代人类衣食住行中的许多问题。催化剂的研发具有重大的科学意义。
I.铁触媒催化合成氨的反应可表示为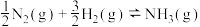 ,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。
,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。

(1)下列有关叙述正确的有_______(填代号)。
II.基元反应的过渡态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,称为过渡态,示意如下:
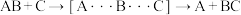
反应物 过渡态 生成物
(2)一溴甲烷与NaOH溶液反应的历程可以表示为:
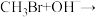
_______ 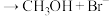
反应物 过渡态 生成物
III.降低 浓度,维持地球大气中
浓度,维持地球大气中 平衡,是当前的一项重要科研工程。我国力争于2030年前做到碳达峰,2060年前实现碳中和。有科学家提出以
平衡,是当前的一项重要科研工程。我国力争于2030年前做到碳达峰,2060年前实现碳中和。有科学家提出以 与
与 为原料,在催化剂作用下生成化工原料乙烯,反应原理如下:
为原料,在催化剂作用下生成化工原料乙烯,反应原理如下:
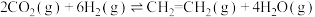
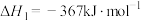
(3)已知上述反应中,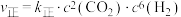 ,
, (
( 、
、 为速率常数,只与温度有关),反应在
为速率常数,只与温度有关),反应在 时达到平衡,已知
时达到平衡,已知 ,则该反应的平衡常数
,则该反应的平衡常数
_______ ; 下该反应达平衡时,若
下该反应达平衡时,若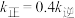 遀,则
遀,则
_______  (填“>”或“<”)。
(填“>”或“<”)。
(4)已知(4)中反应可能伴随有以下副反应:
 。在恒压密闭容器中,
。在恒压密闭容器中, 与
与 的起始浓度一定的条件下,催化反应在相同时间内,测得不同温度下乙烯的产率如图中实线所示(图中虚线表示相同条件下乙烯的平衡产率随温度的变化):
的起始浓度一定的条件下,催化反应在相同时间内,测得不同温度下乙烯的产率如图中实线所示(图中虚线表示相同条件下乙烯的平衡产率随温度的变化):

①一定温度下,乙烯的产率达到X点时,v(正)_______ v(逆)(选填“<”、“>”或“=”)。
②X点后乙烯的产率变小的原因可能是_______ 、_______ (写出两条即可)。
③工业生产中通常采用在一定条件下增大压强的方法来提高 的平衡转化率,从而提高乙烯的平衡产率,却意外发现的CO的平衡产率也显著提高了,请根据平衡移动原理解释其原因
的平衡转化率,从而提高乙烯的平衡产率,却意外发现的CO的平衡产率也显著提高了,请根据平衡移动原理解释其原因_______ 。
I.铁触媒催化合成氨的反应可表示为
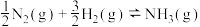 ,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。
,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。
(1)下列有关叙述正确的有_______(填代号)。
A. 分子中的 分子中的 键强度比 键强度比 键高 键高 |
| B.反应物分子被吸附到催化剂表面是一个吸热过程 |
C.反应 在历程中速率最慢 在历程中速率最慢 |
D.反应 的 的 |
II.基元反应的过渡态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,称为过渡态,示意如下:
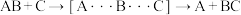
反应物 过渡态 生成物
(2)一溴甲烷与NaOH溶液反应的历程可以表示为:
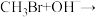
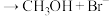
反应物 过渡态 生成物
III.降低
 浓度,维持地球大气中
浓度,维持地球大气中 平衡,是当前的一项重要科研工程。我国力争于2030年前做到碳达峰,2060年前实现碳中和。有科学家提出以
平衡,是当前的一项重要科研工程。我国力争于2030年前做到碳达峰,2060年前实现碳中和。有科学家提出以 与
与 为原料,在催化剂作用下生成化工原料乙烯,反应原理如下:
为原料,在催化剂作用下生成化工原料乙烯,反应原理如下: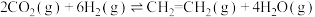
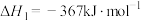
(3)已知上述反应中,
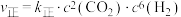 ,
, (
( 、
、 为速率常数,只与温度有关),反应在
为速率常数,只与温度有关),反应在 时达到平衡,已知
时达到平衡,已知 ,则该反应的平衡常数
,则该反应的平衡常数
 下该反应达平衡时,若
下该反应达平衡时,若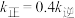 遀,则
遀,则
 (填“>”或“<”)。
(填“>”或“<”)。(4)已知(4)中反应可能伴随有以下副反应:

 。在恒压密闭容器中,
。在恒压密闭容器中, 与
与 的起始浓度一定的条件下,催化反应在相同时间内,测得不同温度下乙烯的产率如图中实线所示(图中虚线表示相同条件下乙烯的平衡产率随温度的变化):
的起始浓度一定的条件下,催化反应在相同时间内,测得不同温度下乙烯的产率如图中实线所示(图中虚线表示相同条件下乙烯的平衡产率随温度的变化):
①一定温度下,乙烯的产率达到X点时,v(正)
②X点后乙烯的产率变小的原因可能是
③工业生产中通常采用在一定条件下增大压强的方法来提高
 的平衡转化率,从而提高乙烯的平衡产率,却意外发现的CO的平衡产率也显著提高了,请根据平衡移动原理解释其原因
的平衡转化率,从而提高乙烯的平衡产率,却意外发现的CO的平衡产率也显著提高了,请根据平衡移动原理解释其原因
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】短周期元素A、B、C、D、E、F、G,其原子半径及主要化合价列表如表。用化学用语回答:
(1)A元素在周期表中的位置是_______ 。
(2)以上元素可形成的简单氢化物中,沸点最高的是_______ 。
(3)写出同时含A、C、D、F四种元素的离子化合物的化学式(任写一种)_______ 。
(4)C元素在一定条件下可置换出G单质。当1 mol还原剂参加反应时转移电子数为_______ 。若该反应可在高温条件下自发进行,可判断该反应的ΔH_______ 0(填“>”、“<”或“=”,下同)、ΔS_______ 0。
(5)B和E两种元素组成的化合物E2B2是一种黄红色液体,遇水迅速反应,产生能使品红溶液褪色的气体和淡黄色的沉淀。若0.1 mol的E2B2与足量水充分反应放热Q kJ的热量,写出E2B2与水反应的热化学方程式_______ 。
| 元素代码 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.075 | 0.099 | 0.077 | 0.074 | 0.102 | 0.037 | 0.117 |
| 主要化合价 | -3,+5 | -1,+7 | -4,+4 | -2 | -2,+6 | +1 | -4,+4 |
(2)以上元素可形成的简单氢化物中,沸点最高的是
(3)写出同时含A、C、D、F四种元素的离子化合物的化学式(任写一种)
(4)C元素在一定条件下可置换出G单质。当1 mol还原剂参加反应时转移电子数为
(5)B和E两种元素组成的化合物E2B2是一种黄红色液体,遇水迅速反应,产生能使品红溶液褪色的气体和淡黄色的沉淀。若0.1 mol的E2B2与足量水充分反应放热Q kJ的热量,写出E2B2与水反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】从2014年4月15日零点开始,上海市空气质量实时发布系统将以实时空气质量指数替代原来的AQI指数。燃煤烟气和汽车尾气是引发AQI指数上升的主要污染源。因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。
汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)+Q(Q>0)。
N2(g)+2CO2(g)+Q(Q>0)。
(1)该热化学反应方程式的意义是___ 。
一定条件下用气体传感器测得该反应在不同时间的NO和CO浓度如下表:
(2)前2s内的平均反应速率v(N2)___ (保留两位小数);CO的平衡转化率为___ 。
(3)下列描述中能说明上述反应已达平衡的是__ 。
a.2v正(NO)=v逆(N2)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,并获得铵盐。其中脱硫的总反应式:SO2+O3+2NH3+H2O→(NH4)2SO4+O2;在(NH4)2SO4溶液中存在水解反应,常温下该水解反应的平衡常数表达式可表示为K=___ ;
有三种铵盐溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,若它们的物质的量浓度相等,c(NH4+)由大到小的顺序是__ (填序号,下同);若它们的pH值相等,c(NH4+)由大到小的顺序是__ 。
汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)
 N2(g)+2CO2(g)+Q(Q>0)。
N2(g)+2CO2(g)+Q(Q>0)。(1)该热化学反应方程式的意义是
一定条件下用气体传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)/mol.L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(CO)/mol.L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(3)下列描述中能说明上述反应已达平衡的是
a.2v正(NO)=v逆(N2)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,并获得铵盐。其中脱硫的总反应式:SO2+O3+2NH3+H2O→(NH4)2SO4+O2;在(NH4)2SO4溶液中存在水解反应,常温下该水解反应的平衡常数表达式可表示为K=
有三种铵盐溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,若它们的物质的量浓度相等,c(NH4+)由大到小的顺序是
您最近一年使用:0次
【推荐1】硫酸是一种重要的化工原料。工业上生产硫酸的步骤之一是SO2与O2反应生成SO3。
(1)已知一定条件下该反应消耗3.2g氧气时,放出的热量为19.8kJ,则该反应的热化学方程式为___________ 。727℃时,该反应的平衡常数Kp=3.45×10-5Pa-1(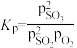 ,式中p为反应达平衡时各气体的分压),恒温恒容体系中,SO2、O2和SO3的分压分别为2.02×104Pa、1.01×104Pa和1.01×105
,式中p为反应达平衡时各气体的分压),恒温恒容体系中,SO2、O2和SO3的分压分别为2.02×104Pa、1.01×104Pa和1.01×105
Pa时,反应___________ 向进行(填“正”或“逆”);若开始时体系中只有SO2和O2,两种气体的分压分别为2.02×104Pa和1.01×104Pa,达平衡时,SO2的分压为aPa,则Kp=___________ Pa-1(列表达式)。
(2)铅酸蓄电池已有160多年历史,至今仍在多领域发挥着重要作用。在铅酸蓄电池生产过程中,一般是先将铅粉(主要成分为铅和氧化铅)与硫酸溶液混合,调制成铅膏后均匀地涂敷在铅板栅上,经干燥得到生极板。生极板化成(通入直流电使铅酸蓄电池的两极发生电化学反应的过程)、封装后,即可得到市售铅酸蓄电池。
①化成时,作为铅酸蓄电池负极的生极板应连接外电源的___________ 极。
②过充电时,铅酸蓄电池正极对应的电极反应式为___________ 。长时间使用后,电池内硫酸的浓度将___________ (填“变大”、“变小”或“不变”)。
③单位质量的电池理论上输出的能量称为理论质量比能量。已知,铅酸蓄电池的电压为2V,产生1Ah的电量消耗3.86g铅。铅酸蓄电池的理论质量比能量为___________ W·h·kg-1(填标号)。
A.518 B.449 C.197 D.167
(1)已知一定条件下该反应消耗3.2g氧气时,放出的热量为19.8kJ,则该反应的热化学方程式为
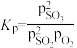 ,式中p为反应达平衡时各气体的分压),恒温恒容体系中,SO2、O2和SO3的分压分别为2.02×104Pa、1.01×104Pa和1.01×105
,式中p为反应达平衡时各气体的分压),恒温恒容体系中,SO2、O2和SO3的分压分别为2.02×104Pa、1.01×104Pa和1.01×105Pa时,反应
(2)铅酸蓄电池已有160多年历史,至今仍在多领域发挥着重要作用。在铅酸蓄电池生产过程中,一般是先将铅粉(主要成分为铅和氧化铅)与硫酸溶液混合,调制成铅膏后均匀地涂敷在铅板栅上,经干燥得到生极板。生极板化成(通入直流电使铅酸蓄电池的两极发生电化学反应的过程)、封装后,即可得到市售铅酸蓄电池。
①化成时,作为铅酸蓄电池负极的生极板应连接外电源的
②过充电时,铅酸蓄电池正极对应的电极反应式为
③单位质量的电池理论上输出的能量称为理论质量比能量。已知,铅酸蓄电池的电压为2V,产生1Ah的电量消耗3.86g铅。铅酸蓄电池的理论质量比能量为
A.518 B.449 C.197 D.167
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】完成下列空白处
(1)用化学方程式说明实验室以水和 制备
制备 的原理
的原理___________ 。
(2)50 mL 0.25 mol/L 溶液与50 mL 0.55 mol/L NaOH溶液充分反应,测得放出1.4 kJ的热量,写出该过程表示中和热的热化学方程式:
溶液与50 mL 0.55 mol/L NaOH溶液充分反应,测得放出1.4 kJ的热量,写出该过程表示中和热的热化学方程式:___________ 。
(3)工业上可用镍粉除去CO,其反应为
 ,则除去CO气体的适宜条件是
,则除去CO气体的适宜条件是___________ 。
(1)用化学方程式说明实验室以水和
 制备
制备 的原理
的原理(2)50 mL 0.25 mol/L
 溶液与50 mL 0.55 mol/L NaOH溶液充分反应,测得放出1.4 kJ的热量,写出该过程表示中和热的热化学方程式:
溶液与50 mL 0.55 mol/L NaOH溶液充分反应,测得放出1.4 kJ的热量,写出该过程表示中和热的热化学方程式:(3)工业上可用镍粉除去CO,其反应为

 ,则除去CO气体的适宜条件是
,则除去CO气体的适宜条件是
您最近一年使用:0次
【推荐3】肼(N2H4)是一种应用广泛的化工原料。
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式___________ 。
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
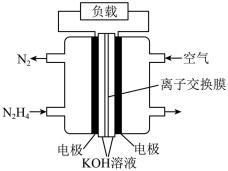
①负极的电极反应式为___________ 。
②电池工作时电子从___________ 电极经过负载后流向___________ 电极(填“左侧”或“右侧”)。
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为___________ g。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):
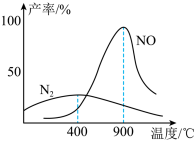
温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=________ 。
②1000℃,反应b达到平衡时,下列措施能使容器中 增大的是
增大的是________ 。
A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。

①负极的电极反应式为
②电池工作时电子从
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):

温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=
②1000℃,反应b达到平衡时,下列措施能使容器中
 增大的是
增大的是A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】用 转化为乙醇可实现碳循环。近年来,随着全球变暖及能源枯竭的加剧,由
转化为乙醇可实现碳循环。近年来,随着全球变暖及能源枯竭的加剧,由 制乙醇又再次成为各国的研究热点。
制乙醇又再次成为各国的研究热点。
Ⅰ. 转化为乙醇的一种途径如下:
转化为乙醇的一种途径如下:
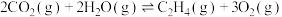
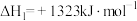
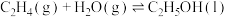
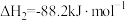

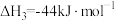
(1)则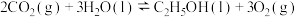

___________  。
。
Ⅱ.已知 催化加氢制乙醇原理为
催化加氢制乙醇原理为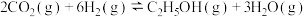 ,回答下列问题:
,回答下列问题:
(2)在恒温恒容的密闭容器中,对 催化加氢制乙醇反应体系说法不正确的是
催化加氢制乙醇反应体系说法不正确的是___________ 。(填序号)
A.增大原料气中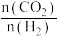 的比例,有利于提高
的比例,有利于提高 的转化率
的转化率
B.若混合气体的密度保持不变,说明反应体系已达平衡
C.体系达平衡后,若压缩容器容积,则反应平衡正向移动
(3)在均为2L的恒容密闭容器a和b中分别投入 和
和 ,在不同温度下进行
,在不同温度下进行 加氢制乙醇的反应,各容器中乙醇的物质的量与时间的关系如图所示:
加氢制乙醇的反应,各容器中乙醇的物质的量与时间的关系如图所示:
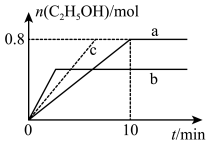
①容器a中0~10min氢气的平均反应速率
___________ ;
②若容器a、b中的反应温度分别为 、
、 ,则判断
,则判断
___________ 0(填“>”或“<);
③若容器a中改变条件时,反应情况会由曲线a变为曲线c,则改变的单一条件可是___________ (填序号);
A.加入更高效的催化剂 B.升温
C.增大压强 D.分离出乙醇
④ 温度下反应达平衡时,容器a中气体总压强为4MPa,则
温度下反应达平衡时,容器a中气体总压强为4MPa,则 时该反应的平衡常数
时该反应的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,气体的分压=气体总压强 气体的物质的量分数)。
气体的物质的量分数)。
 转化为乙醇可实现碳循环。近年来,随着全球变暖及能源枯竭的加剧,由
转化为乙醇可实现碳循环。近年来,随着全球变暖及能源枯竭的加剧,由 制乙醇又再次成为各国的研究热点。
制乙醇又再次成为各国的研究热点。Ⅰ.
 转化为乙醇的一种途径如下:
转化为乙醇的一种途径如下: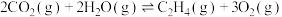
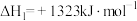
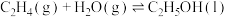
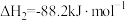

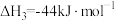
(1)则
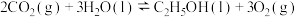

 。
。Ⅱ.已知
 催化加氢制乙醇原理为
催化加氢制乙醇原理为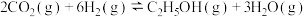 ,回答下列问题:
,回答下列问题:(2)在恒温恒容的密闭容器中,对
 催化加氢制乙醇反应体系说法不正确的是
催化加氢制乙醇反应体系说法不正确的是A.增大原料气中
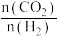 的比例,有利于提高
的比例,有利于提高 的转化率
的转化率B.若混合气体的密度保持不变,说明反应体系已达平衡
C.体系达平衡后,若压缩容器容积,则反应平衡正向移动
(3)在均为2L的恒容密闭容器a和b中分别投入
 和
和 ,在不同温度下进行
,在不同温度下进行 加氢制乙醇的反应,各容器中乙醇的物质的量与时间的关系如图所示:
加氢制乙醇的反应,各容器中乙醇的物质的量与时间的关系如图所示:
①容器a中0~10min氢气的平均反应速率

②若容器a、b中的反应温度分别为
 、
、 ,则判断
,则判断
③若容器a中改变条件时,反应情况会由曲线a变为曲线c,则改变的单一条件可是
A.加入更高效的催化剂 B.升温
C.增大压强 D.分离出乙醇
④
 温度下反应达平衡时,容器a中气体总压强为4MPa,则
温度下反应达平衡时,容器a中气体总压强为4MPa,则 时该反应的平衡常数
时该反应的平衡常数
 气体的物质的量分数)。
气体的物质的量分数)。
您最近一年使用:0次
【推荐2】温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。
I.在催化作用下由 和
和 转化为
转化为 的反应历程示意图如图。
的反应历程示意图如图。
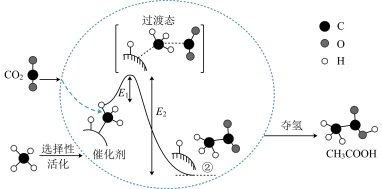
(1)在合成 的反应历程中,下列有关说法正确的是_______(填字母)。
的反应历程中,下列有关说法正确的是_______(填字母)。
II.以 、
、 为原料制备“21世纪的清洁燃料”二甲醚
为原料制备“21世纪的清洁燃料”二甲醚 涉及的主要反应如下:
涉及的主要反应如下:
①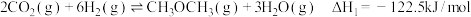
②
(2)反应 的
的
_______
(3)在压强、 和
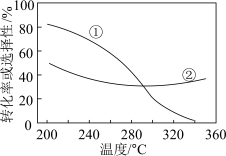
和 的起始投料一定的条件下,发生反应①、②,实验测得
的起始投料一定的条件下,发生反应①、②,实验测得 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
i.已知: 的选择
的选择
其中表示平衡时 的选择性的是曲线
的选择性的是曲线_______ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是_______ ;
ii.为同时提高 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为_______ (填标号)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
III.以 、为原料合成的主要反应为:
、为原料合成的主要反应为: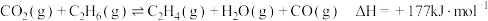
(4)某温度下,在 恒压密闭容器中充入等物质的量的
恒压密闭容器中充入等物质的量的 和
和 ,达到平衡时
,达到平衡时 的物质的量分数为
的物质的量分数为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)
物质的量分数)
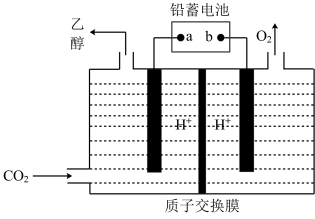
IV.
(5)以铅蓄电池为电源可将 转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为:
转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为:_______ ;每生成 乙醇,理论上需消耗铅蓄电池中
乙醇,理论上需消耗铅蓄电池中_______  硫酸。
硫酸。
 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。I.在催化作用下由
 和
和 转化为
转化为 的反应历程示意图如图。
的反应历程示意图如图。
(1)在合成
 的反应历程中,下列有关说法正确的是_______(填字母)。
的反应历程中,下列有关说法正确的是_______(填字母)。| A.该催化剂使反应的平衡常数增大 |
B. 过程中,有 过程中,有 键断裂和 键断裂和 键形成 键形成 |
C.生成乙酸的反应原子利用率 |
D.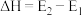 |
II.以
 、
、 为原料制备“21世纪的清洁燃料”二甲醚
为原料制备“21世纪的清洁燃料”二甲醚 涉及的主要反应如下:
涉及的主要反应如下:①
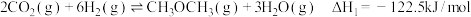
②

(2)反应
 的
的
(3)在压强、
 和
和 的起始投料一定的条件下,发生反应①、②,实验测得
的起始投料一定的条件下,发生反应①、②,实验测得 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
i.已知:
 的选择
的选择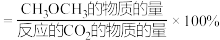
其中表示平衡时
 的选择性的是曲线
的选择性的是曲线ii.为同时提高
 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
III.以
 、为原料合成的主要反应为:
、为原料合成的主要反应为: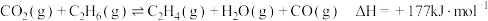
(4)某温度下,在
 恒压密闭容器中充入等物质的量的
恒压密闭容器中充入等物质的量的 和
和 ,达到平衡时
,达到平衡时 的物质的量分数为
的物质的量分数为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)
物质的量分数)IV.
(5)以铅蓄电池为电源可将
 转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为:
转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为: 乙醇,理论上需消耗铅蓄电池中
乙醇,理论上需消耗铅蓄电池中 硫酸。
硫酸。
您最近一年使用:0次
【推荐3】硒(Se)元素位于元素周期表第四周期第VIA族。请回答下列问题:
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)写出“混合气体用水吸收”时发生反应的化学方程式_______ 。
(2)下列说法正确的是_______ (填字母)。
A.SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性
B.热稳定性:H2Se>H2S
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓) CuSO4+SeO2↑+3SO2↑+4H2O
CuSO4+SeO2↑+3SO2↑+4H2O
II.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。
(3)已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=_______ kJ•mol−1(用含m、n、p的代数式表示)。
(4)已知常温H2Se的电离平衡常数K1=1.3×10−4,K2=5.0×10−11,则NaHSe溶液的离子浓度由大到小的顺序为_______ 。Ag2SO4在一定条件下可以制备Ag2SeO4已知该条件下Ag2SeO4的Ksp=5.7×10−8,Ag2SO4的的Ksp=1.4×10−5,则反应Ag2SO4(s)+SeO (aq)⇌Ag2SeO4(s)+SO
(aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=
(aq)的化学平衡常数K=_______ (保留两位有效数字)。
III.研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(5)用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4,电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体_______ L。
(6)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和_______ 。木炭包覆纳米零价铁在碱性含硒废水中形成许多微电池,加速SeO 的还原过程。已知SeO
的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式
转化为单质Se,写出其对应的电极反应式_______ 。
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)写出“混合气体用水吸收”时发生反应的化学方程式
(2)下列说法正确的是
A.SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性
B.热稳定性:H2Se>H2S
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓)
 CuSO4+SeO2↑+3SO2↑+4H2O
CuSO4+SeO2↑+3SO2↑+4H2OII.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。
(3)已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=
(4)已知常温H2Se的电离平衡常数K1=1.3×10−4,K2=5.0×10−11,则NaHSe溶液的离子浓度由大到小的顺序为
 (aq)⇌Ag2SeO4(s)+SO
(aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=
(aq)的化学平衡常数K=III.研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(5)用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4,电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体
(6)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和
 的还原过程。已知SeO
的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式
转化为单质Se,写出其对应的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】丙烯(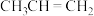 )是重要的有机合成单体,常用丙烷(
)是重要的有机合成单体,常用丙烷(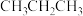 )为原料合成。回答下列问题:
)为原料合成。回答下列问题:
(1)加热条件下,以 和丙烷为原料合成丙烯的反应为
和丙烷为原料合成丙烯的反应为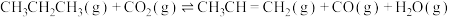
 。
。
①上述反应过程中,能量的变化形式为_______ 。
②其他条件不变,增大压强,丙烷的平衡转化率_______ (填“增大”“减小”或“不变”,下同);使用高效催化剂,该反应的
_______ 。
(2)在高效催化剂作用下,丙烷脱氢生成丙烯的反应如下:
 。
。
①已知断裂或形成1mol共价键需要吸收或放出的能量数据如表所示:
则
_______ 。若该反应的活化能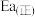 为
为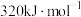 ,则该反应逆反应的活化能
,则该反应逆反应的活化能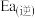 为
为_______  。
。
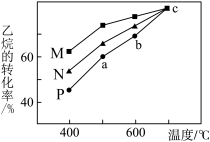
②其他条件不变时,在不同催化剂(M、N、P)作用下,反应进行相同时间后,乙烷的转化率随反应温度的变化如图所示。500℃时,三种催化剂(M、N、P)的催化活性由高到低的顺序为_______ ;b点乙烷的转化率高于a点的原因是_______ 。
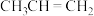 )是重要的有机合成单体,常用丙烷(
)是重要的有机合成单体,常用丙烷(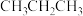 )为原料合成。回答下列问题:
)为原料合成。回答下列问题:(1)加热条件下,以
 和丙烷为原料合成丙烯的反应为
和丙烷为原料合成丙烯的反应为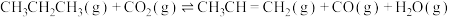
 。
。①上述反应过程中,能量的变化形式为
②其他条件不变,增大压强,丙烷的平衡转化率

(2)在高效催化剂作用下,丙烷脱氢生成丙烯的反应如下:

 。
。①已知断裂或形成1mol共价键需要吸收或放出的能量数据如表所示:
| 共价键 |  |  |  |  |
能量( ) ) | 345 | 412 | 615 | 436 |

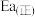 为
为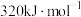 ,则该反应逆反应的活化能
,则该反应逆反应的活化能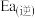 为
为 。
。②其他条件不变时,在不同催化剂(M、N、P)作用下,反应进行相同时间后,乙烷的转化率随反应温度的变化如图所示。500℃时,三种催化剂(M、N、P)的催化活性由高到低的顺序为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】利用化学反应可以为人类提供能源,也可用来解决环境问题。
(1)已知某些化学键的键能数据如下:
①写出H2与O2反应生成水蒸气的热化学方程式____________ ;
②利用该反应设计成燃料电池,已知该电池每发1kW·h电能生成360g水蒸气,则该电池的能量转化率为_____ % (结果保留三位有效数字)。
(2)三室式电渗析法可以处理含K2SO4的废水,原理如图所示,两极均为惰性电极,ab为阳离子交换膜,cd为阴离子交换膜。

①阴极区的pH______ (填“升高”或“降低”) ;
②阳极发生的电极反应式为__________ ;
③当电路中通过1 mol电子的电量时,阴极上生成气体的体积为_____ L (标准状况)。
(1)已知某些化学键的键能数据如下:
| 化学键 | H-H | O=O | O-H |
| 键能kJ·mol-1 | 436 | 495 | 463 |
①写出H2与O2反应生成水蒸气的热化学方程式
②利用该反应设计成燃料电池,已知该电池每发1kW·h电能生成360g水蒸气,则该电池的能量转化率为
(2)三室式电渗析法可以处理含K2SO4的废水,原理如图所示,两极均为惰性电极,ab为阳离子交换膜,cd为阴离子交换膜。

①阴极区的pH
②阳极发生的电极反应式为
③当电路中通过1 mol电子的电量时,阴极上生成气体的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题
(1)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
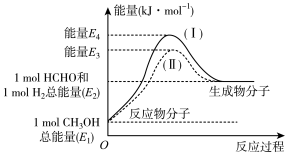
①甲醇催化脱氢转化为甲醛的反应是___________  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?___________ ,原因是___________ 。
(2)在 、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:
、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:___________ 。
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1;CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2,△H1___________ △H2(填“>”、“<”或“=”)
(4)白磷与氧可发生如下反应:P4(s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为
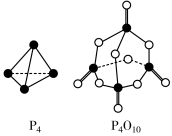
根据图示的分子结构和有关数据估算该反应的△H=___________ ;
(5)某温度时,在容积为2L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图。分析图中数据,回答下列问题:
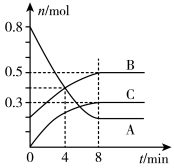
①该反应的化学方程式为___________ 。
②反应开始至4 min时,物质A的平均反应速率为___________ 。
③4 min时,正反应速率___________ (填“>”“<”或“=”,下同)逆反应速率,8 min时,正反应速率___________ 逆反应速率。
(1)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。

①甲醇催化脱氢转化为甲醛的反应是
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。②过程Ⅰ与过程Ⅱ的反应热是否相同?
(2)在
 、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:
、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1;CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2,△H1
(4)白磷与氧可发生如下反应:P4(s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |

根据图示的分子结构和有关数据估算该反应的△H=
(5)某温度时,在容积为2L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图。分析图中数据,回答下列问题:

①该反应的化学方程式为
②反应开始至4 min时,物质A的平均反应速率为
③4 min时,正反应速率
您最近一年使用:0次



